4-Fluorbenzonitril
4-Fluorbenzonitril weist neben einer aromatische Nitrilgruppe ein Fluoratom in 4-Stellung (para-ständig) auf und dient als Ausgangsstoff für Pestizide, pharmazeutische Wirkstoffe, Flüssigkristalle und Pigmente.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
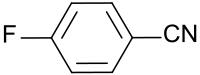 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Fluorbenzonitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H4FN | ||||||||||||||||||
| Kurzbeschreibung |
farblose[1] bzw. hellgelbe bis gelbe Kristallklumpen[2] bzw. Nadeln[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 121,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser, löslich in Toluol, Dimethylsulfoxid und in den meisten organischen Lösungsmitteln[4] | ||||||||||||||||||
| Brechungsindex |
1,4925 (55 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Für 4-Fluorbenzonitril wurden eine Vielzahl von Syntheserouten entwickelt, die auf dem Halogenaustausch (Cl, Br, I → F), dem Austausch Halogen gegen Nitril (Br → CN) oder auf der Umwandlung einer para-ständigen Carbonyl- oder Carboxygruppe zur Cyanogruppe beruhen.[5]
4-Fluorbenzonitril durch Halogenaustausch
So entsteht p-Fluorbenzonitril durch den Austausch Cl gegen F im Sinne einer nucleophilen aromatischen Substitution an einem elektronenarmen Aromaten, wie 4-Chlorbenzonitril, mit Kaliumfluorid KF in 1,3-Dimethyl-2-imidazolidinon DMEU bei 290 °C in einem druckfesten Reaktor in 91 %iger Ausbeute.[6]
Ausgehend von dem sehr effizient aus Fluorbenzol mit Brom in Gegenwart katalytischer Mengen Eisen(III)-chlorid bei tiefen Temperaturen zugänglichen 4-Bromfluorbenzol (>97 % Ausbeute bei >99 % Reinheit)[7], kann 4-Fluorbenzonitril durch Umsetzung mit Acetoncyanhydrin in Gegenwart von Palladium(II)-acetat Pd(OAc)2, dem zweizähnigen Chelatliganden 1,5-Bis(diphenylphosphanyl)pentan dpppe und dem Diamin Tetramethylethylendiamin TMEDA hergestellt werden (98 % Ausbeute).[8]
Auf ähnliche Weise entsteht PFBN aus 4-Bromfluorbenzol mit Natriumcyanid als Cyanquelle unter Palladiumkatalyse (Pd0/t-Bu3P) in einem Acetonitril-THF-Gemisch in 97 %iger Ausbeute.[9]
4-Fluorbenzonitril aus 4-Fluorbenzaldehyd
4-Fluorbenzaldehyd – aus 4-Chlorbenzaldehyd[10] durch Halogenaustausch in 75 %iger Ausbeute erhältlich[11] – kann in wässrigem Ammoniak mit 2-Iodoxybenzoesäure IBX über das intermediär gebildete Imin in einer Ausbeute von 92 % direkt zu 4-Cyanofluorbenzol oxidiert werden.[12]
In einer Eintopfreaktion in dem „grünen“ Lösungsmittel Glycerin reagiert 4-Fluorbenzaldehyd mit Hydroxylaminhydrochlorid bei 90 °C über das intermediär gebildete Oxim in 83 %iger Ausbeute zu 4-Fluorbenzonitril.[13] In DMSO als Lösungsmittel wird PFBN in 95 %iger Ausbeute erhalten.[5]
4-Fluorbenzonitril aus 4-Fluorbenzamid
Die Umwandlung einer para-ständigen Carboxygruppe in eine Nitrilgruppe verläuft quantitativ durch Dehydratisierung von 4-Fluorbenzamid mit einem Kupfersalz in Toluol bei 100 °C mit dem Silylierungsreagenz N-Methyl-N-(trimethylsilyl)trifluoracetamid MSTFA CF3CON(CH3)Si(CH3)3.[14]
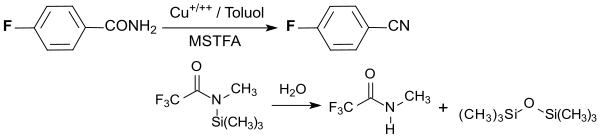
Als Nebenprodukte entstehen N-Methyltrifluoracetamid CF3CONHCH3 und Hexamethyldisiloxan (CH3)3SiOSi(CH)3.
4-Fluorbenzonitril aus anderen Ausgangsstoffen
Weitere Alternativrouten mit anderen Reaktanden sind in der Literatur beschrieben, wie z. B. aus 4-Fluorbenzylalkohol durch Oxidation mit dem Nitroxid-Radikal TEMPO zum 4-Fluorbenzaldehyd und dessen Umsetzung mit Iod I2 und wässrigem Ammoniak NH3 in 99 %iger Ausbeute.[15]
Eigenschaften
Reines 4-Fluorbenzonitril ist ein weißer bis gelber kristalliner Feststoff, der sich wenig in Wasser, aber in vielen organischen Lösungsmitteln löst. Der Geruch von PFBN wird als unangenehm beschrieben.[4]
Anwendungen
Die Synthese von Diarylethern und -thioethern mit para-ständiger Cyanogruppe gelingt praktisch quantitativ durch Umsetzung von 4-Fluorbenzonitril mit substituierten Phenolen in Acetonitril in Gegenwart von Kaliumfluorid auf basischem Aluminiumoxid und dem Kronenether 18-Krone-6.[16]
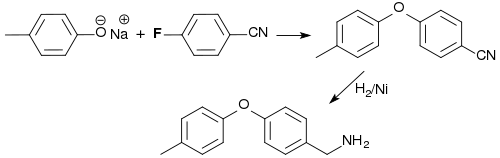
Die Diaryletherbildung von PFBN mit dem Natriumsalz des p-Kresols und anschließende Hydrierung der Cyano- zur Aminomethylgruppe liefert den variablen Molekülteil des Pyrazol-Insektizids Tolfenpyrad.[17]
Stäbchenförmige flüssigkristalline Fluorphenylpyrimidine mit hoher chemischer und thermischer Stabilität und Lichtbeständigkeit sind aus 4-Fluorbenzonitril durch mehrstufige Synthese zugänglich.[18]
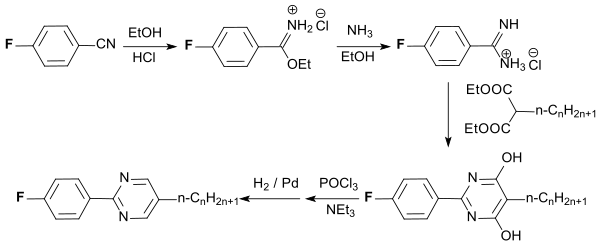
Die Verbindungen bilden niederviskose nematische Mesophasen in einem breiten Temperaturbereich und eignen sich zum Einsatz in LC-Displays.
Reaktion von 4-Fluorbenzonitril mit p-Toluidin erzeugt 4,4‘-Dicyano-4‘‘-methyltriphenylamin, dessen Cyanogruppen zur entsprechenden aromatischen Dicarbonsäure hydrolysiert und mit aromatischen Diaminen zu Polyamiden polykondensiert wird.[19]
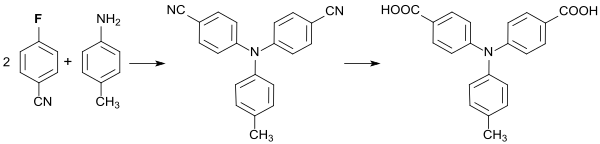
Die erhaltenen Polymeren besitzen interessante Eigenschaften als blauemittierende elektrochrome Materialien.
Intensive blaue Fluoreszenz zeigt das s-Triazin-Pigment 2,4,6-Tris(4-fluorophenyl)-1,3,5-triazin (TFPT), das aus dem aus 4-Fluorbenzonitril und Schwefeltrioxid SO3 gebildeten Addukt durch Umsetzung mit 4-Fluorbenzamidin-hydrochlorid zugänglich ist.
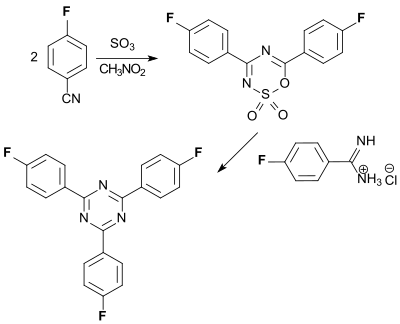
Nanopartikel, die solche fluoreszierende Triazinpigmente enthalten, sind biokompatibel und können zu Bildgebung in lebenden Zellen genutzt werden.[20]
Die wichtigste Verwendung von 4-Fluorbenzonitril ist als Synthesebaustein für den Aromatasehemmer Letrozol (FemaraR), der zur Behandlung von Brustkrebs bei Frauen nach den Wechseljahren eingesetzt wird.[21]
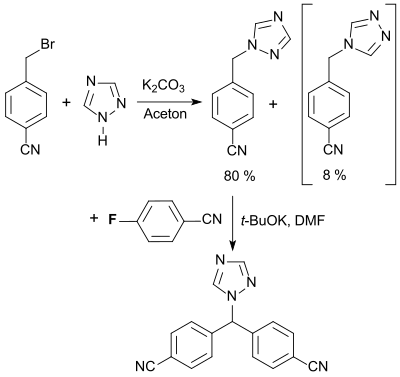
Der vorgeschlagene Synthese- und Aufarbeitungsprozess soll Letrozol in hoher Ausbeute und Reinheit liefern, mit möglichst geringen Verunreinigungen durch das im ersten Schritt der Umsetzung mit 1,2,4-Triazol entstehenden 1,3,4-Triazolylisomer.
Einzelnachweise
- Datenblatt 4-Fluor-benzonitril bei Sigma-Aldrich, abgerufen am 18. August 2019 (PDF).
- Eintrag zu 4-Fluorobenzonitrile bei TCI Europe, abgerufen am 18. August 2019.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–274.
- R.R.P. Torregrosa: 4-Fluorobenzonitrile. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2015, doi:10.1002/047084289X.rn01850.
- S.R.K. Samala, K. Gokavarapu, S.B. Rao, S. Gokavarapu, S. Gandhi: A mild, simple, cost efficient, chemoselective, and high yielding procedure for the anti-cancer drug letrozole key intermediate 4-fluorobenzonitrile. In: J. Current Res. Band 10, Nr. 08, 2018, S. 72908–72910, doi:10.24941/ijcr.32211.08.2018.
- H. Suzuki, Y. Kimura: Synthesis of 3,4-difluorobenzonitrile and monofluorobenzonitriles by means of halogen-exchange fluorination. In: J. Fluor. Chem. Band 52, Nr. 3, 1991, S. 341–351, doi:10.1016/S0022-1139(00)80348-6.
- Patent US5847241: Process for the preparation of p-bromofluorobenzene. Angemeldet am 26. August 1996, veröffentlicht am 8. Dezember 1998, Anmelder: Bromine Compounds Ltd., Erfinder: J. Oren.
- M. Sundermeier, A. Zapf, M. Beller: Ein praktikables Verfahren zur Palladium-katalysierten Cyanierung von Arylhalogeniden. In: Angew. Chem. Band 115, Nr. 14, 2003, S. 1700–1703, doi:10.1002/ange.200250778.
- A.V. Ushkov, V.V. Grushin: Rational catalysis design on the basis of mechanistic understanding: Highly efficient Pd-catalyzed cyanation of aryl bromides with NaCN in recyclable solvents. In: J. Amer.Chem. Soc. Band 133, Nr. 28, 2011, S. 10999–11005, doi:10.1021/ja2042035.
- W.L. McEwen: p-Chlorobenzaldehyde In: Organic Syntheses. 11, 1932, S. 12, doi:10.15227/orgsyn.012.0012; Coll. Vol. 2, 1943, S. 133 (PDF).
- Y. Yoshida, Y. Kimura: A convenient synthesis of fluorobenzaldehyde by KF/Ph4PBr/18-crown-6 reagent system. In: Chem. Lett. Band 17, Nr. 8, 1988, S. 1355–1358, doi:10.1246/cl.1988.1355.
- N.D. Arote, D.S. Bhalerao, K.G. Akamanchi: Direct oxidative conversion of aldehydes to nitriles using IBX in aqueous ammonia. In: Tetrahedron Lett. Band 48, Nr. 21, 2007, S. 3651–3653, doi:10.1016/j.tetlet.2007.03.137.
- A.P. Ingale, S.M. Patil, S.V. Shinde: Catalyst-free, efficient and one pot protocol for synthesis of nitriles from aldehydes using glycerol as green solvent. In: Tetrahedron Lett. Band 58, Nr. 52, 2017, S. 4845–4848, doi:10.1016/j.tetlet.2017.11.032.
- S. Enthaler, M. Weidauer: Copper-ctalyzed dehydration of primary amides to nitriles. In: Catal. Lett. Band 141, 2014, S. 1079–1085, doi:10.1007/s10562-011-0660-9.
- H. Shimojo, K. Moriyama, H. Togo: Simple one-pot conversion of alcohols into nitriles. In: Synthesis. Band 45, Nr. 15, 2013, S. 2155–2164, doi:10.1055/s-0033-1338489.
- J.S. Sawyer, E.A. Schmittling, J.A. Palkowitz, W.J. Smith: Synthesis of diaryl ethers, diaryl thioethers, and diarylamines mediated by potassium fluoride−alumina and 18-crown-6: Expansion of scope and utility. In: J. Org. Chem. Band 63, Nr. 18, 1998, S. 6338–6343, doi:10.1021/jo980800g.
- W. Krämer, U. Schirmer, P. Jeschke, M. Witschel (Hrsg.): Modern Crop Protection Compounds: 3 Volume Set. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32965-6, S. 1087.
- Patent EP0126949A2: Fluorhaltige Pyrimidinderivate. Angemeldet am 17. April 1984, veröffentlicht am 5. Dezember 1984, Anmelder: Merck Patent GmbH, Erfinder: J. Krause, M. Römer, L. Pohl, B. Scheuble, G. Weber.
- G.-S. Liou, N.-K. Huang, Y.-L. Yang: Blue-light-emitting and anodically electrochromic materials of new wholly aromatic amides derived from the high-efficiency chromophore 4,4‘-dicarboxy-4‘‘-methyltriphenylamine. In: J. Polym. Sci. Pol. Chem. Band 44, Nr. 13, 2006, S. 4095–4107, doi:10.1002/pola.21505.
- K. Zhang, K. Yang, S. Ai, J. Xu: Synthesis of novel cross-linked s-triazine-containing poly(aryl ether)s nanoparticles for biological fluorescent labeling. In: Des. Monomers Polym. Band 20, Nr. 1, 2016, S. 389–396, doi:10.1080/1685551.2017.1281786.
- Patent US20100234617A1: Process for preparation of letrozole and its intermediates. Angemeldet am 16. Januar 2008, veröffentlicht am 16. September 2010, Anmelder: Fresenius Kabi Oncology, Ltd., Erfinder: V.K. Shrawat, J.P. Singh, R.P. Nautiyal.

