p-Toluidin
p-Toluidin ist eine chemische Verbindung aus der Gruppe der aromatischen, einfach methylierten Aniline und ist isomer zu o-Toluidin und m-Toluidin.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | p-Toluidin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H9N | ||||||||||||||||||
| Kurzbeschreibung |
farbloser bis rotbrauner Feststoff mit weinartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 107,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,05 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
200 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
5,08 (der konjugierten Säure BH+)[2] | ||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (7,5 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,5534[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 0,2 ml·m−3[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Alle drei isomeren Toluidine werden aus Nitrotoluolen (aus Toluol durch Nitrierung zugänglich) durch Reduktion hergestellt. Die Reduktion kann zum einen mit Eisen, Essigsäure und Salzsäure durchgeführt werden (Béchamp-Reduktion). Heute überwiegt die katalytische Hydrierung mit Raney-Nickel. Als Lösungsmittel werden hier oft niedere, aliphatische Alkohole (Methanol, Ethanol, n-Propanol oder iso-Propanol) eingesetzt. Die Hydrierung findet in der Regel bei Drücken zwischen 3 bar und 20 bar H2-Druck (sog. Niederdruckhydrierung) oder bei 20 bis 50 bar (sog. Mitteldruckhydrierung) statt.
Eigenschaften
p-Toluidin ist ein brennbarer farbloser bis gelblicher, sich bei Licht- und Luftzutritt rotbraun verfärbender Feststoff mit weinartigem Geruch, der schwer löslich in Wasser ist. Er besitzt eine Leitfähigkeit von 6,2 × 10−6 S/m bei 100 °C.[1]
Alle Toluidine sind schwache Basen, ihre (pKs-Werte) liegen in der gleichen Größenordnung wie Anilin (4,603).[2]
Die Dampfdruckfunktionen ergeben sich nach Antoine entsprechend log10(p) = A−(B/(T+C)) (p in bar, T in K) wie folgt:
| Typ | T in K | A | B | C |
|---|---|---|---|---|
| o-Toluidin[6] | 391,6–473,4 | 4,19168 | 1617,232 | −87,126 |
| m-Toluidin[6] | 394,9–476,5 | 4,19983 | 1618,386 | −90,631 |
| p-Toluidin[7] | 315–473,5 | 4,71884 | 1961,716 | −57,0 |
Verwendung
Die Toluidine hatten früher fast ausschließlich als Zwischenprodukte zur Herstellung von Farbstoffen und Pigmenten sehr große Bedeutung. o- und p-Toluidin sind wichtige Ausgangsstoffe zur Herstellung von Chlortoluidinen und nitrierten Toluidinen. Diese dienen, neben den Toluidinsulfonsäuren, zur Herstellung von Pharmazeutika, Farbstoffen und Pigmenten.
Über eine Diazotierung (und anschließende „Verkochung“) können aus den Toluidinen die Kresole erhalten werden.
p-Toluidin wird als Reagenz auf Lignin, Nitrit, Phloroglucin und wird zur Herstellung von Farbstoffen, Textilhilfsmitteln und Vulkanisationsbeschleunigern verwendet.[1]
Wichtige Azofarbstoffe auf Basis von p-Toluidin sind der kationische Farbstoff C.I. Basic Red 9 (C.I. 42500) und der Säurefarbstoff C.I. Acid Green 25 (C.I. 61570).
Über eine Diazotierung und anschließende Reduktion des p-Toluidin kann p-Tolyl-hydrazin (vgl. Hydrazin) erhalten werden, welches als Vorprodukt für 3-Methyl-1-[p-tolyl]-5-pyrazolon (wichtiges Farbstoffzwischenprodukt; vgl. auch: Pyrazolone) dient.
Zur Herstellung von Triphenylmethanfarbstoffen und für 2,9-Dimethylchinacridon (vgl. Chinacridon-Pigmente), wird p-Toluidin ebenfalls in großen Mengen eingesetzt.
Ferner dient es auch zur Herstellung einiger Pflanzenschutzmittel, wie Oxythiochinox, Tolylfluanid oder dem Safener Daimuron und vieler Pharmazeutika.
| Chemische Struktur | Name | Verwendung |
|---|---|---|
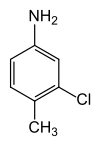 |
3-Chlor-4-methylanilin | zur Herstellung von 3-Chlor-4-methyl-6-nitroanilin, um daraus das Herbizid Chlortoluron zu gewinnen; in USA als Avizid gegen Stare und Möwen[8] |
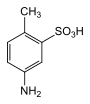 |
4-Aminotoluol-2-sulfonsäure | als Zwischenprodukt für Azofarbstoffe und optische Aufheller |
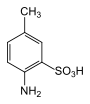 |
4-Aminotoluol-3-sulfonsäure | dient (nach Diazotierung und Reduktion zum entsprechenden Hydrazin) zur Herstellung wichtiger Pyrazolone |
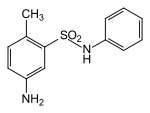 |
4-Aminotoluol-2-sulfonsäureanilid | als Diazo-Komponente für Azofarbstoffe |
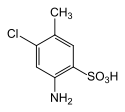 |
4-Amino-6-chlortoluol-3-sulfonsäure | als Diazo-Komponente für Azofarbstoffe und Vorstufe für Pyrazolone |
Sicherheitshinweise
Die Dämpfe von p-Toluidin können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 87 °C, Zündtemperatur 482 °C) bilden.[3]
Einzelnachweise
- Eintrag zu p-Toluidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Zvi Rappoport (Hrsg.): CRC Handbook of Tables for Organic Compound Identification. 3rd Edition, CRC Press/Taylor and Francis, Boca Raton, FL, 1967, ISBN 0-8493-0303-6, Acid Dissociation Constants of Organic Bases in Aqueous Solution, S. 437.
- J.S. Bowers, Jr.: Toluidines in Ullmann’s Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a27_159.
- Eintrag zu p-toluidine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 106-49-0 bzw. P-Toluidin), abgerufen am 2. November 2015.
- R. R. Dreisbach, S. A. Shrader: Vapor Pressure–Temperature Data on Some Organic Compounds. In: Ind. Eng. Chem. Band 41, Nr. 12, 1949, S. 2879–2880, doi:10.1021/ie50480a054.
- Daniel R. Stull: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds. In: Ind. Eng. Chem. Band 39, Nr. 4, 1947, S. 517–540, doi:10.1021/ie50448a022.
- James F. Glahn: Use Of Starlicide To Reduce Starling Damage At Livestock Feeding Operations, University of Nebraska – Lincoln, 1981.


