Polykondensation
Polykondensation ist eine vielfach ablaufende Kondensationsreaktion, die Monomere in Polymere (Kunststoffe) überführt. Damit ein Monomer an der Reaktion teilnehmen kann, muss es mindestens zwei funktionelle Gruppen besitzen, die besonders reaktionsfähig sind (z. B. –OH, –COOH, –NH2, –CHO …). Dabei werden in der Regel bifunktionelle Monomere verschiedener Art (z. B. Diole und Dicarbonsäuren, die zu Estern kondensieren) miteinander umgesetzt. Polykondensation verläuft stufenweise (Stufenwachstumsreaktion), über stabile, aber weiterhin reaktionsfähige Zwischenprodukte (Oligomere). Die Oligomere reagieren untereinander und bilden schließlich ein Makromolekül. Die Produkte werden Polykondensate genannt. Neben Kunststoffen gibt es auch eine ganze Reihe natürliche Polymere, z. B. Polykieselsäuren, die durch Polykondensation entstehen.
Im Gegensatz zur Polymergewinnung durch Kettenpolymerisation oder Polyaddition wird bei der Polykondensation mindestens ein Nebenprodukt frei. Diese Nebenprodukte (z. B. Wasser, Ammoniak, niedrige Alkohole, Chlorwasserstoff) müssen kontinuierlich abgeführt werden, sonst stoppt die Polykondensation aus thermodynamischen Gründen bei zu niedrigem Polymerisationsgrad.
Im Gegensatz zur Kettenpolymerisation, die über Kettenwachstum erfolgt, muss der Reaktionsumsatz bei Polykondensation mindestens 99 % betragen, um ein Polykondensat hoher molarer Masse zu bekommen. Weiterhin muss das Verhältnis der eingesetzten Mengen an jeweiligem Monomer so exakt wie möglich dem durch die Reaktion vorgegebenen stöchiometrischen Verhältnis angepasst werden, sonst gelangt man zu einem Punkt, an dem alle Oligomere die gleichen aktiven Enden besitzen und nicht mehr miteinander reagieren können (Carothers-Gleichung).
Historische Informationen
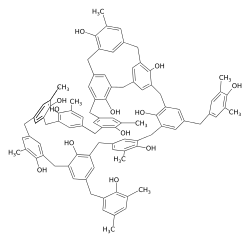 Struktur von Bakelit
Struktur von Bakelit
Die erste Polykondensation gelang dem deutschen Chemiker und Nobelpreisträger Adolf von Baeyer 1872. Er beschrieb die Polykondensationsreaktion von Phenol und Formaldehyd zu Bakelit und legte damit die Grundlage für die heutige Polymerchemie. Im großen Maßstab produziert wurde Bakelit erstmals 1909 von Leo Hendrik Baekeland und wurde jahrzehntelang in vielen Bereichen eingesetzt. Es wird auch heute noch hergestellt.
Anwendung
Die Polykondensation ist ein wichtiges Verfahren der Polymerchemie, mit dem zahlreiche wichtige Kunststoffe, wie zum Beispiel Phenoplast (z. B. Bakelit), Polyester und Polyamide hergestellt werden.[1] Von großer Bedeutung ist die Polykondensation auch bei der Herstellung von Klebstoffen, wie beispielsweise Phenolformaldehydklebstoffen, und in der Herstellung von Bremsbelägen für Kraftfahrzeuge.
Beispiele
Phenoplast
Durch Reaktion von Phenol mit einem Aldehyd entsteht unter Mitwirkung eines Katalysators ein erstes Zwischenprodukt.
Dieses Zwischenprodukt reagiert unter Abspaltung von Wasser wiederholt mit Formaldehyd und Phenol zu einem Makromolekül:
Dies ist eine Kondensationsreaktion, da sich in der fortlaufenden Polymerbildung immer wieder Wasser abspaltet. Es kommt zu einer Copolymerisation und einer räumlichen Vernetzung und man spricht von Polykondensation. Dabei entsteht ein Phenoplast (auch Phenolharz, Phenol-Formaldehyd-Kondensat oder Bakelit genannt).
Polyester
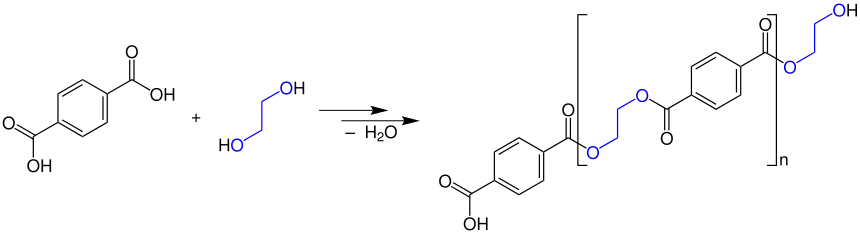
Durch Reaktion von Carbonsäuren (hier Terephthalsäure) mit Diolen (Verbindungen mit zwei Alkoholgruppen, hier Ethandiol) entsteht unter Abspaltung von Wasser ein Polyester (z. B. Polyethylenterephthalat (PET)). Läuft diese Reaktion unter Einbeziehung des Reaktionsproduktes als Ausgangsstoff mehrstufig ab, handelt es sich um eine Polykondensation.
Wird statt Ethandiol beispielsweise Glycerin als Ausgangsstoff verwendet, kommt es zu einer räumlichen Vernetzung und der Entstehung eines Duroplast.
Polyamide
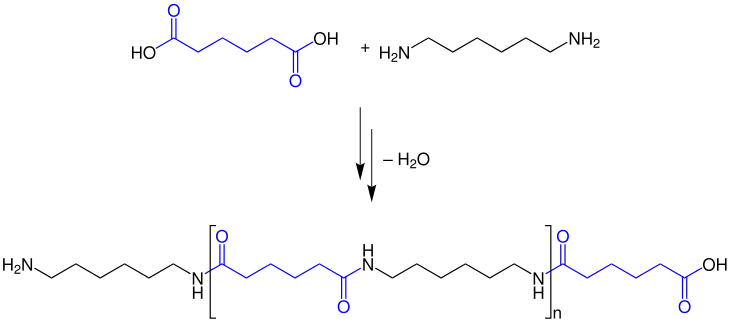
Diamine reagieren mit Dicarbonsäuren durch Polykondensation zu Polyamiden (z. B. Nylon):
Erhitzt man ein Gemisch aus Adipinsäure und Hexamethylendiamin, so erfolgt eine Polykondensation zum 6,6-Nylon.[2]
Technische Verfahren
- Lösungspolykondensation
- Schmelzpolykondensation
- Grenzflächenpolykondensation
- Festphasenpolykondensation
- Fällungspolykondensation
Siehe auch
Einzelnachweise
- M. D. Lechner, K. Gehrke und E. H. Nordmeier: Makromolekulare Chemie, 4. Auflage, Birkhäuser Verlag, 2010, S. 119–136, ISBN 978-3-7643-8890-4.
- Adalbert Wollrab: Organische Chemie. Springer-Verlag, 1999, ISBN 3-540-43998-6, S. 527.