Aromatase
Die Aromatase (auch CYP19A1) ist das Enzym, das in Wirbeltieren die Umsetzung von Testosteron zu Östradiol bzw. von Androstendion zu Östron katalysiert. Diese Aromatisierung von Androgenen ist der entscheidende letzte Schritt bei der Biosynthese der Östrogene.
| Aromatase | ||
|---|---|---|
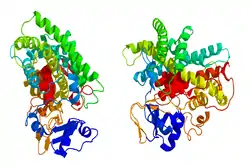 | ||
| Bändermodell nach PDB 1TQA (theoret.) | ||
|
Vorhandene Strukturdaten: 3EQM | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 502 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Membranprotein (ER) | |
| Bezeichner | ||
| Gen-Name | CYP19A1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.14.1, Oxidoreduktase | |
| Reaktionsart | Hydroxylierung, Dehydrierung, Deformylierung | |
| Substrat | Androstendion/Testosteron + 3NADPH/H+ + 3O2 | |
| Produkte | Östron/Östradiol + 3NADP+ + 4H2O + Formiat | |
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere[1] | |
Aromatase, auch Östrogen-Synthase genannt, ist eine Monooxygenase (EC 1.14.14.1), die Häm als Kofaktor nutzt und zur Cytochrom P450-Familie 19 zählt. Das daher als CYP19A1 bezeichnete Protein ist in der Membran des Endoplasmatischen Retikulums (ER) von Zellen verschiedener Gewebe lokalisiert. Es findet sich in den Gonaden, der Plazenta, der Brustdrüse, dem Fettgewebe und auch im Gehirn sowie in Haut, Knochen und Blutgefäßen. Mutationen im CYP19A1-Gen können zu erblichem Aromatasemangel oder -überschuss führen.[2]
Katalysierte Reaktionen
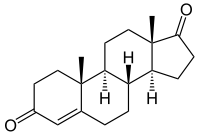 →
→ 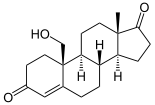 →
→ 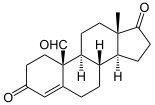 →
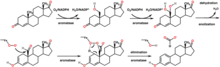
→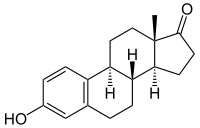
Androstendion wird über 19-OH-Androstendion und 19-Oxo-Androstendion zu Estron (E1) aromatisiert.
 → → →
→ → → 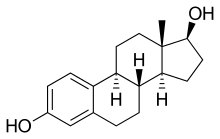
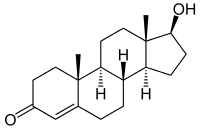
Testosteron wird auf ähnliche Weise zu Estradiol (E2) umgesetzt.
Die Geschichte der Aromatase
Die Aromatase ist das entscheidende Enzym bei der Biosynthese von Östrogenen, den sogenannten weiblichen Geschlechtshormonen. Schon in den 1930er Jahren wurde bekannt, dass sich Androgene (C19-Steroide) in Östrogene (C18-Steroide) umwandeln lassen. Bei der Aromatisierung des A-Ringes wird der C19-Substituent in der 10-Position als Formiat abgespalten. Als Quelle der Aromatase-Aktivität dienten in diesen frühen Jahren der Forschung Gewebsextrakte von Schweine-Nebennieren. Bevor das Enzym selbst charakterisiert werden konnte, wurden Zwischenstufen der Aromatisierung identifiziert, so 19-Hydroxy-Androstendion und 19-Oxo-Androstendion (siehe Abbildung oben).[3]

Die Analyse der Biochemie und der Funktion dieses Enzyms war mit der Suche nach Hemmstoffen der Aromatase-Funktion verbunden. Denn in den 1970er Jahren wurde nicht nur festgestellt, dass Aromatase auch außerhalb von Gonaden und Nebenniere exprimiert wird: u. a. im Fettgewebe und in der Brustdrüse sowie in Brustkrebszellen. Sondern auch, dass Estradiol ein Wachstumsfaktor von Brustkrebszellen ist, der von den Krebszellen und dem Drüsengewebe selbst gebildet wird.
Ein alternativer Weg für das Vorkommen von Östrogen bzw. Östradiol im Brustdrüsengewebe ist eine Abspaltung von Sulfat aus Östron-Sulfat durch eine im Gewebe exprimierte Sulfatase. Mit radioaktiv markiertem Östron-Sulfat ließ sich in Brusttumoren von Nagern zeigen, dass nur etwa 20 bis 50 % des Östrons in der weiblichen Brust durch die Wirkung der Sulfatase auf das im Blut zirkulierende Östron-Sulfat entstanden waren; die übrigen 80–50 % mussten daher durch Androstendion-Umwandlung entstanden sein.
Die Östrogen-Neubildung konnte durch ex-vivo-Versuche mit radioaktiv markiertem Androstendion bewiesen werden. Ein am C19-Kohlenstoff von Androstendion eingebautes radioaktives H-Isotop (Tritium) half, die Oxidoreduktase-Aktivität der Aromatase nachzuweisen als Verlust der Radioaktivität infolge Oxidationsreaktionen. In einem mehrschrittigen Reaktionsablauf bewirkt das Enzym als Monooxygenase die stufenweise Aufnahme dreier Sauerstoff-Moleküle an C19, unter Zuhilfenahme der NADPH-Cytochrom-P450-Oxidoreduktase und NADPH (siehe nebenstehende Abbildung).
In den 1980er Jahren war dann die Isolierung des menschlichen Aromatase-Proteins aus Plazenta-Mikrosomen möglich. Am isolierten Protein wurde seine enzymatische Wirkung für die Umwandlung von Androstendion in Östrogen nachgewiesen. Damit wurde bewiesen, dass die mehrstufige Reaktion durch ein einzelnes Protein katalysiert wird. Mit Hilfe von PCR sowie molekularbiologischer Klonierung und Sequenzierung wurde schließlich die Aromatase-Sequenz erhalten. Das zugehörige Gen wurde anschließend auf Chromosom 15 Genort q21.2 lokalisiert.
Aromatase-Evolution
Die Bildung von Östrogenen aus Androgenen mit Hilfe der Aromatase galt lange als charakteristisches Merkmal von Wirbeltieren. Befunde in Muscheln, in denen Östrogene identifiziert wurden, und die Sequenzierung von Aromatase-ähnlichen Genen in weiteren Nicht-Wirbeltieren haben den Vertebraten-Ursprung der Aromatase anzweifeln lassen. Bis heute allerdings sind keine wirklichen Aromatasen in Invertebraten genetisch und funktionell charakterisiert. Tiwary und Li[4] haben zwar im Jahre 2009 eine parallele Evolution von Androgenrezeptor und Aromatase postuliert, die verwendeten Invertebraten-Sequenzen werden aber von Reitzel und Tarrant[5] als ungeeignet für die Analyse abgelehnt.
Es sollte auch bedacht werden, dass Östrogene vom Cholesterin ausgehend über Pregnenolon, Progesteron, Testosteron gebildet werden. Schon die Umwandlung von Cholesterin zu Pregnenolon durch das dabei notwendige seitenkettenspaltende Enzym CYP11A1 ist vertebratenspezifisch. Die Bildung von Östrogenen aus Cholesterin benötigt also insgesamt fünf Enzyme. Diese fünf Enzyme sind bei Fischen und danach allen anderen Wirbeltieren vorhanden und funktionell. Für Nicht-Wirbeltiere ist die Beweiskette dagegen äußerst lückenhaft. Mal gibt es eine Enzymaktivität, aber weder Protein noch Gen; mal gibt es ein Gen, aber kein funktionelles Protein. Dabei liegt die Betonung auf ein und nicht fünf. Es bleibt daher abzuwarten, ob sich je ein Invertebraten-Ortholog für die Aromatase findet.
Struktur und Funktion der Aromatase
Die Aromatase ist wie die assoziierte NADPH-Cytochrom-P450-Oxidoreduktase (POR) ein membranassoziiertes Protein im Endoplasmatischen Retikulum. POR bindet NADPH/H+ und aktiviert über die FAD- und FMN-Kofaktoren unmittelbar das aktive Zentrum der Aromatase, die dann den aktiven Sauerstoff für den Angriff am C19-Kohlenstoffatom von Androgenen zur Verfügung stellt.
Das Aromatase-Gen auf Chromosom 15 hat neun codierende Exone (2 bis 10) und mehrere Varianten für das nichttranslatierte Exon 1. Unter dem Einfluss gewebsspezifischer Transkriptionsfaktoren wird die Aromatase-RNA-Transkription an unterschiedlichen Stellen initiiert. Die nachfolgende Aufstellung fasst den Aromatase-Genpromotor zusammen und beschreibt die Reihenfolge der verschiedenen Startstellen in der Reihenfolge von am weitesten vom codierenden Exon 2 entfernt bis dem Exon 2 am nächsten; die Zahlen in Klammern geben den Abstand (in Kilobasen) zum nächsten Startpunkt an:
- Plazenta (major) 1.1 (15 kb)
- Plazenta (minor 2) 2a (5 kb)
- Haut/Fettgewebe 1.4 (30 kb)
- Fötalgewebe 1.5 (7 kb)
- Endothelzellen/Brustkarzinom 1.7 (3 kb)
- Gehirn 1.f (20 kb)
- Plazenta (minor 1) 1.2 (12 kb)
- Knochen 1.6 (0,5 kb)
- Fettgewebe/Brustkrebs 1.3 (0,2 kb)
- Ovar/Hoden/Brustkrebs/Endometriose PII (0 kb)
Insgesamt umspannt das Gen etwa 120 kb (Kilobasenpaare). Diese Aufstellung zeigt auch, in welchen menschlichen Geweben die Aromatase exprimiert wird.
Funktion der Aromatase in den verschiedenen Geweben
In den Ovarien
In vielen Wirbeltieren, von Fischen über Vögel bis hin zu Säugern, ist die Aromatase ein spezielles Protein der Gonaden (und des Gehirns). Menschliche Granulosazellen in prä-ovulatorischen (sprungbereiten) Follikeln exprimieren die Aromatase wesentlich stärker als die Zellen kleinerer Follikel. Beim Menschen und in Nagern wurde Aromatase auch im Gelbkörper gefunden. In den Hoden findet sich die Aromatase vor der Pubertät in Sertoli-Zellen und später bei erwachsenen Männern in Leydig-Zellen. Auch in verschiedenen Spermien-Reifungsstadien von Nagern wurde Aromatase identifiziert.[6]
Das präovulatorische Östradiol ist das Wachstumshormon für die Uterus-Schleimhaut, das Endometrium. Unter dem E2-Einfluss bereitet sich diese darauf vor, das befruchtete Ei aufzunehmen. Wenn nach dem Eisprung und ohne die Progesteron-Bildung aus dem Trophoblast auch der Gelbkörper die E2-Bildung einstellt, verkümmert das Endometrium und wird bei der Monatsblutung abgestoßen.
Lektionen aus Patienten bzw. Aromatase-Genknock-out-Mäusen bzw. -überexprimierenden Mäusen
Patientinnen mit Aromatase-Defekten haben bei der Geburt keine eindeutig männlichen oder weiblichen Gonaden, entwickeln in der Pubertät eine Amenorrhö, fehlende Entwicklung einer weiblichen Brust, einen hypergonadotrophen Hypogonadismus und zystische Ovarien. Da mit Östradiol-Gabe die Symptome begrenzt werden können, fehlen Langzeituntersuchungen zu diesem Krankheitsbild.
Betroffenen Männern (bis 2006 sieben bekannte Fälle) fehlt jegliches Östradiol, sie besitzen aber normale Mengen an Testosteron und Gonadotropinen. Damit einher geht ein abnorm großes Wachstum mit verzögerter Knochenreifung und Epiphysenschließung. Außerdem kommt es zu Osteoporose mit Knochenschmerz und genu valgum. Auch erhöhtes Insulin, gestörter Lipidstoffwechsel oder fehlende Fruchtbarkeit wurden beschrieben.[7]
Mäuse mit ausgeschaltetem Aromatase-Gen (Genknock-out-Mäuse) zeigten u. a. Gehirndefekte, Gedächtnisstörungen, Autoimmunität mit Lymphozyten-Vermehrung, Verkleinerung des Thymus mit geringerer Zelldichte, Insulin-Resistenz, mit dem Altern ansteigende Adipositas, erhöhte Cholesterol-, Blutlipoprotein- und Triglycerid-Werte, abnehmende Knochenlänge und -dichte, verringerte Aggression gegen männliche Störenfriede, aber verstärkte Aggressivität gegen paarungsbereite Weibchen.[7][8]
Aromatasehemmer
Aromatasehemmer können die Bildung von Östrogenen im Muskel- und Fettgewebe blockieren und werden daher bei der Behandlung von hormonempfindlichem Brustkrebs eingesetzt. Da die Östrogenproduktion in den Eierstöcken von Aromatasehemmern nicht unterbunden wird, sind diese nur für Frauen nach der Menopause oder nach operativer Entfernung oder medikamentöser Blockade der Eierstöcke geeignet. Therapeutisch genutzte Arzneistoffe sind Anastrozol, Letrozol und Exemestan. Aromatasehemmer werden bei Brustkrebserkrankungen eingesetzt, deren Entstehung und Verlauf häufig durch das weibliche Sexualhormon Östrogen beeinflusst wird. Speziell bei fortgeschrittenen Brustkrebserkrankungen von Frauen nach den Wechseljahren werden Aromatasehemmer dann eingesetzt, wenn der Krebs nicht oder nicht ausreichend auf eine Behandlung mit Antiöstrogenen (Tamoxifen) ansprach.
Die häufigsten Nebenwirkungen der Aromatasehemmer sind Gelenksbeschwerden. Diese Arthralgien treten bei bis zu 50 % der behandelten Patientinnen auf, können jedoch mit regelmäßigem Sport (Kraft- und Ausdauertraining) etwas gelindert werden[9], um ein frühzeitiges Therapieende zu verhindern. Auch Bodybuilder setzen – insbesondere bei künstlicher Testosteronzufuhr – Aromatasehemmer ein, um die durch den erhöhten Testosteronspiegel verstärkte Umsetzung in Östrogene zu unterbinden. Die World Anti-Doping Agency (WADA) listet Aromatasehemmer in der Kategorie S4 der verbotenen Dopingmittel auf; explizit aufgeführt werden Anastrozol, Letrozol, Aminogluthetimid, Exemestan, Formestan und Testolacton.[10]
Literatur
- V. J. Assikis & A. Buzdar: Recent advances in aromatase inhibitor therapy for breast cancer. In: Seminars in Oncol. 29 (3 Suppl. 11), 2002, S. 120–128.
- Roselli CE, Liu M, Hurn PD: Brain aromatization: classic roles and new perspectives. In: Semin. Reprod. Med.. 27, Nr. 3, Mai 2009, S. 207–17. doi:10.1055/s-0029-1216274. PMID 19401952.
- Adams LS, Chen S: Phytochemicals for breast cancer prevention by targeting aromatase. In: Front. Biosci.. 14, 2009, S. 3846–63. PMID 19273315.
Weblinks
- OrphaNet: Aromatase deficiency
- Jassal / reactome: Testosterone is converted to estradiol
- Jassal / reactome: Androstenedione is converted to estrone by Aromatase (CYP19A1)
Einzelnachweise
- Homologe bei OMA
- UniProt P11511
- Santen RJ, Brodie H, Simpson ER, Siiteri PK, Brodie A: History of aromatase: saga of an important biological mediator and therapeutic target. In: Endocr. Rev.. 30, Nr. 4, Juni 2009, S. 343–375. doi:10.1210/er.2008-0016. PMID 19389994.
- Basant Tiwary, Wen-Hsiung Li: Parallel evolution between aromatase and androgen receptor in the animal kingdom. In: Molecular Biology and Evolution. 26, Nr. 1, Januar 2009, S. 123–129. doi:10.1093/molbev/msn233. PMID 18936441.
- Adam M Reitzel, Ann M Tarrant: Correlated evolution of androgen receptor and aromatase revisited. In: Molecular Biology and Evolution. 21. Mai 2010. doi:10.1093/molbev/msq129. PMID 20494939.
- Alan Conley1 and Margaret Hinshelwood: Mammalian aromatases. In: Reproduction. 121, 2001, S. 685–695;. PMID 11427156.
- Jones ME, Boon WC, Proietto J, Simpson ER.: Of mice and men: the evolving phenotype of aromatase deficiency.. In: Trends Endocrinol Metab.. 17, Nr. (2), 2006, S. 55–64.. PMID 16480891.
- Xiangdong Li, Nafis Rahman: Impact of androgen/estrogen ratio: Lessons learned from the aromatase over-expression mice. In: General and Comparative Endocrinology. 159, 2008, S. 1–9. PMID 18762187.
- SABCS: Exercise Improves Drug-associated Joint Pain in Breast Cancer Survivors
- NADA: Die Verbotsliste 2009 – Internationaler Standard. S. 5 (PDF; 165 kB).