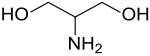
2-Amino-1,3-propandiol
2-Amino-1,3-propandiol (Serinol) ist ein Aminoalkohol mit einer sekundären Aminogruppe und zwei primären Hydroxygruppen. Serinol leitet sich von der α-Aminosäure Serin bzw. vom Glycerin ab, dessen sekundäre Hydroxygruppe durch eine Aminogruppe ersetzt ist. Als Synthesebaustein insbesondere für Arzneistoffe hat 2-Amino-1,3-propandiol einige Bedeutung erlangt.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Amino-1,3-propandiol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H9NO2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 91,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser (364 g·l-1 bei 20 °C[1]), löslich in Methanol[3] | ||||||||||||||||||
| Brechungsindex |
1,4698 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
2-Amino-1,3-propandiol kommt in der Natur im Zuckerrohr (Saccharum officinarum) und ist eine Zwischenstufe in der Biosynthese der so genannten Rhizobitoxine, die von einigen phytopathogenen Pilzen gebildet werden und die Synthese von Ethylen im pflanzlichen Wirtsorganismus hemmen.[4]
Sphingolipide, wie Sphingosin und besonders N-acylierte Derivate, wie z. B. Ceramide, Sphingomyeline, Cerebroside und Ganglioside enthalten alle das Strukturelement 2-Aminopropan-1,3-diol und spielen in der Lipid-Signalübertragung (engl. lipid signaling) als Second Messenger bei Eukaryoten eine wichtige Rolle.
Auch das Multiple-Sklerose-Medikament Fingolimod und das Antibiotikum Chloramphenicol enthält Serinol als Strukturelement, ohne dass 3-Amino-1,3-propandiol selbst in der Biosynthese des Chloramphenicols und den verschiedenen chemischen Routen als Molekülbaustein auftritt.
Die erste chemische Synthese von 2-Amino-1,3-propandiol wurde 1897 von Oskar Piloty und Otto Ruff beschrieben.[5]
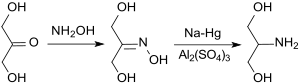
Im Labormaßstab wurde dabei das Oxim des Dihydroxyacetons mit Natriumamalgam in Gegenwart von Aluminiumsulfat zum Amin reduziert. Eine moderne Variante nutzt die heterogenkatalytische Hydrierung des Oxims an einem Rhodium-Katalysator auf Aluminiumoxid (90 % Rohausbeute) und soll sich auch für den industriellen Maßstab eignen.[6]
Die Vorstufe Dihydroxyaceton kann auch direkt mit flüssigem Ammoniak in Methanol mit Raney-Nickel als Katalysator über die Zwischenstufe des Imins zu Serinol hydriert werden.
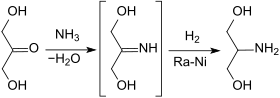
Das in 99%iger Ausbeute erhaltene Rohprodukt wird zur Reinigung mit Oxalsäure-Dihydrat in das Oxalat überführt.[7]
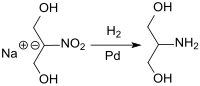
Das aus Nitromethan durch Umsetzung mit der zweifachen molaren Masse Paraformaldehyd zugängliche 2-Nitro-1,3-propandiol kann als (im trockenen Zustand explosives) Natriumsalz im großtechnischen Maßstab in einem Schlaufenreaktor unter exakter Dosierungs- und Temperaturkontrolle an einem Palladium-Kontakt praktisch quantitativ und in hoher Reinheit zu Serinol hydriert werden.[8]
Auch das aus Nitromethan durch vollständigen Ersatz der Wasserstoffatome der aktivierten Methylgruppe durch Hydroxymethylgruppen erhaltene Tris(hydroxymethyl)nitromethan kann nach Blockierung von zwei Hydroxymethylgruppen durch Ketalbildung mit Aceton, Abspaltung der dritten Hydroxymethylgruppe im Alkalischen, Hydrierung der Nitro- zur Aminogruppe und Abspaltung der Schutzgruppe im Sauren in einer Gesamtausbeute über vier Stufen von ca. 66 % und für ein industrielles Verfahren eher weniger geeignet.[9]
Das vom natürlichen und billigen Rohstoff Glycerin abgeleitete und nach effizienten Verfahren hergestellte Dihydroxyaceton[10][11] erscheint wegen kurzer Synthesewege mit unproblematischen Reaktanden und Reaktionsbedingungen als der geeignetste Ausgangsstoff zur Herstellung von Serinol.
Eigenschaften
2-Amino-1,3-propandiol ist ein weißes, geruchloses Kristallpulver, das sich sehr gut in Wasser, sowie in Methanol und DMSO löst.[12] Die Substanz ist hygroskopisch und wirkt besonders am Auge ätzend.
Anwendungen
Das als Arachidonoylserinol bezeichnete Amid der Arachidonsäure mit 2-Amino-1,3-propandiol ist das N-Analogon des 2-Arachidonylglycerols (2-AG), des natürlichen Endocannabinoid-Liganden für den Cannabinoid-Rezeptor 1 CB1.
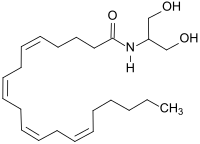
Arachidonoylserinol ist zwar sehr viel stabiler als das Glycerinderivat, allerdings um mindestens eine Zehnerpotenz weniger aktiv als 2-AG.[13]
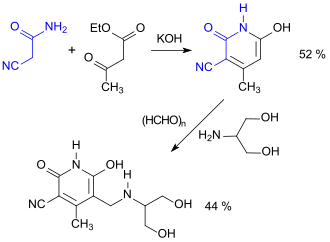
Das Nucleosid Uridin soll die in vivo Toxizität des Zytostatikums 5-Fluoruracil reduzieren, ohne seine Zytotoxizität zu verringern. Da Uridin in hohen Gaben schlecht vertragen wird, sollte die gezielte Hemmung des inaktivierenden Enzyms Uridinphosphorylase (engl. human uridine phosphorylase hUP) eine Erhöhung des Uridinspiegels im Organismus bewirken. Uracil-Derivate mit einer 2-Amino-1,3-propandiol-Funktion zeigten besondere Wirksamkeit als hUP-Inhibitoren.[14]
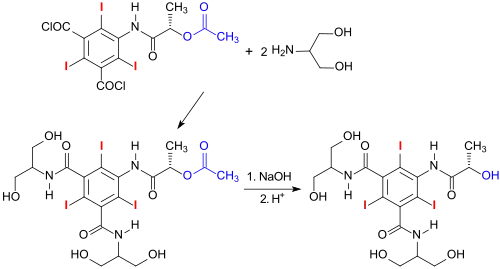
Kürzlich wurden tensidartige antimikrobielle Substanzen beschrieben, bei denen zwei jeweils dreifach positiv geladene Kopfgruppen über 2-Amino-1,3-propandiol mit einer langen (C16 oder C18) Carbonsäure verknüpft sind.[15] Die erhaltenen quartären Ammoniumverbindungen sind gegen grampositive Bakterien, darunter auch multiresistente Problemstämme in vitro wirksam.
Die wasserunlösliche Isophthalsäure-Vorstufe des iodhaltigen Röntgenkontrastmittels Iopamidol wird durch Amidierung mit 2-Amino-1,3-propandiol gut wasserlöslich.[16]
Eine mehrstufige Synthese des Iminozuckers 1-Deoxygalactonojirimycin, einem kompetitiven Hemmer des Enzyms α-Galactosidase A, geht von N-benzoylgeschütztem und O-TBS-geschütztem Serinol aus.
Das Cyclohexan-Derivat Voglibose ist ein Antidiabetikum vom Typ der α-Glucosidasehemmer, wie z. B. Acarbose und Miglitol. Die Synthese geht aus von Valiolamin, einem so genannten Aminocyclitol, das wie auch das Immunsuppressivum Sirolimus aus Streptomyces hygroscopicus isoliert werden kann.[17]
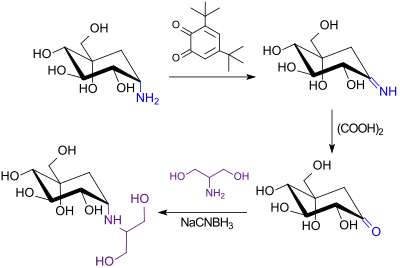
Die Aminogruppe des Valiolamins wird mit 3,5-Di-tert.-butyl-1,2-benzochinon DBQ zum Imin oxidiert, das Imin zum Keton (Valiolone) hydrolysiert und anschließend mit Serinol in Gegenwart von Natriumcyanoborhydrid im Sauren reduzierend aminiert.[18]
Einzelnachweise
- Eintrag zu 2-Aminopropan-1,3-diol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. April 2020. (JavaScript erforderlich)
- Carl L. Yaws: Thermophysical Properties Ob Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Amsterdam, NL 2015, ISBN 978-0-12-800834-8, S. 36.
- Eintrag zu 2-Amino-1,3-propanediol bei TCI Europe, abgerufen am 9. April 2020.
- B. Andreeßen, A. Steinbüchel: Serinol: small molecule – big impact. In: AMB Express. Band 1, 2011, S. 12, doi:10.1186/2191-0855-1-12.
- O. Piloty, O. Ruff: Ueber einige Aminoalkohole der Fettreihe. In: Ber. Dtsch. Chem. Ges. Band 30, Nr. 2, 1897, S. 2057–2068, doi:10.1002/cber.189703002181.
- Patent US5922917A: Process for the preparation of 2-amino-1,3-propanediol. Angemeldet am 5. April 1995, veröffentlicht am 13. Juli 1999, Anmelder: Bracco International B.V., Erfinder: A. Nardi, M. Villa.
- Patent EP0238961A2: Verfahren zur Herstellung von Hydroxyaminen. Angemeldet am 14. März 1987, veröffentlicht am 30. September 1987, Anmelder: Merck Patent Gesellschaft mbH, Erfinder: E. Felder, M. Römer, H. Bardonner, H. Härtner, W. Fruhstorfer.
- Patent US4448999: Process for the preparation of 2-aminopropanediol-1,2 (serinol). Angemeldet am 30. Juli 1982, veröffentlicht am 15. Mai 1984, Anmelder: Dynamit Nobel AG, Erfinder: K. Thewalt, G. Bison, H. Egger.
- Patent EP0348223A2: Novel process for the preparation of serinol. Angemeldet am 23. Juni 1989, veröffentlicht am 27. Dezember 1989, Anmelder: W.R. Grace & Co.-Conn., Erfinder: J.M. Quirk, S.G. Harsy, C.L. Hakansson.
- M. Pagliaro, R. Ciriminna, H. Kimura, M. Rossi: Von Glycerin zu höherwertigen Produkten. In: Angew. Chem. Band 119, Nr. 24, 2007, S. 4516–4522, doi:10.1002/ange.200604694.
- F. Ulgheri, P. Spanu: An efficient chemical conversion of glycerol to dihydroxyacetone. In: ChemistrySelect. Band 3, Nr. 41, 2018, S. 11569–11572, doi:10.1002/select.201802841.
- Eintrag zu 2-Aminopropane-1,3-diol bei Toronto Research Chemicals, abgerufen am 10. April 2020 (PDF).
- A.D. Khanolkar, V. Abadji, S. Lin et al.: Head group analogs of arachidonylethanolamide, the endogenous cannabinoid ligand. In: J. Med. Chem. Band 39, Nr. 22, 1996, S. 4515–4519, doi:10.1021/jm960152y.
- D. Renck et al.: Design of Novel Potent Inhibitors of Human Uridine Phosphorylase-1: Synthesis, Inhibition Studies, Thermodynamics, and in Vitro Influence on 5-Fluorouracil Cytotoxicity. In: J. Med. Chem. Band 56, Nr. 21, 2013, S. 8892–8902, doi:10.1021/jm401389u.
- A. Jiménez et al.: A Novel Class of Cationic and Non-Peptidic Small Molecules as Hits for the Development of Antimicrobial Agents. In: Molecules. Band 23, Nr. 7, 2018, S. 1513–43, doi:10.3390/molecules23071513.
- Patent GB01472050: Non-ionic x-ray contrast agents. Angemeldet am 26. November 1975, veröffentlicht am 27. April 1977, Anmelder: SAVAC AG, Erfinder: N.N..
- Y. Kameda, N. Asano, M. Yoshikawa, M. Takeuchi, T. Yamaguchi, K. Matsui, S. Horii, H. Fukase: Valiolamine, a new alpha-glucosidase inhibiting aminocyclitol produced by Streptomyces hygroscopicus. In: J. Antibiot (Tokyo). Band 37, Nr. 11, 1984, S. 1301–1307, doi:10.7164/antibiotics.37.1301.
- X. Chen, Y. Zheng, Y. Shen: Voglibose (Basen, AO-128), one of the most important alpha-glucosidase inhibitors. In: Curr. Med. Chem. Band 13, Nr. 1, 2006, S. 109–116, doi:10.2174/092986706789803035.

