Iminozucker
Iminozucker, veraltet auch als Azazucker bezeichnet (engl. iminosugar), sind eine biologisch, pharmakologisch und chemisch bedeutende Stoffklasse, die zu den Alkaloiden gezählt wird. Es sind Zucker-Analoga, die statt eines endozyklischen Sauerstoffatoms ein Stickstoffatom tragen. Im Unterschied dazu tragen die Aminozucker den Stickstoff am und nicht im Ring des Zuckermoleküls.
Natürliche Vorkommen
Iminozucker sind Sekundärmetabolite einer Reihe von Pflanzen. Maulbeerbäume (Morus) enthalten einen hohen Anteil von verschiedenen Iminozuckern. 1976 wurde 1-Deoxynojirimycin (DNJ) als erster Iminozucker aus den Wurzeln von Maulbeerbäumen isoliert und zunächst als Molanolin bezeichnet.[1] DNJ findet sich auch in anderen Bestandteilen der Maulbeerbäume, beispielsweise den Blättern.[2] Relativ hohe Konzentrationen enthält vor allem die Weiße Maulbeere (Morus alba).[3][4] Der DNJ-Gehalt liegt im Bereich von etwa 0,1 %. Durch Optimierung der Ernte und Trocknung kann der Gehalt bis auf 1,5 % gesteigert werden.[5]
Eine Untergruppe der Iminozucker bilden die Calystegine. Dabei handelt es sich um hydroxylierte Nortropan-Alkaloide. Diese starken Glycosidase-Inhibitoren wurden in Kartoffel, Paprika und Auberginen isoliert. Die Konzentration beträgt bis zu 100 mg pro kg Trockenmasse.[6] Die höchste Konzentration findet sich in den Schalen der Früchte. Man vermutet eine Funktion der Calystegine in der Pflanze als Antifraßmittel.[7]
Pharmakologische Bedeutung
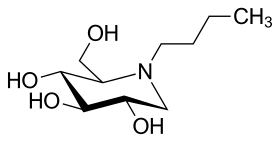
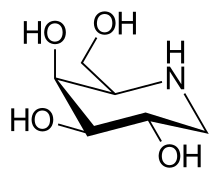
Eine Reihe von Iminozuckern sind reversible kompetitive Inhibitoren von Enzymen, deren „natürliches“ Substrat der korrespondierende „normale“ Zucker ist. Im Gegensatz zu kovalent bindenden Inhibitoren, die irreversibel hemmen, lässt sich diese Art der Inhibierung besser kontrollieren. Pharmakologisches Interesse besteht vor allem durch das antibakterielle[8] und antivirale[9] Potenzial der Iminozucker. Auch für die Behandlung maligner Tumoren[10], des Diabetes mellitus[11] und von Adipositas[12] gibt es vielversprechende Ansätze, die vor allem auf der selektiven Hemmung bestimmter Enzyme, beispielsweise der Glucosidasen, beruht.
Miglustat (= n-Butyldeoxynojirimycin, NB-DNJ) ist ein Glucosylceramidsynthase-Inhibitor, der für die Substratreduktionstherapie von zwei lysosomalen Speicherkrankheiten (Niemann-Pick-Krankheit Typ C und Morbus Gaucher Typ 1) zugelassen ist. 1-Deoxygalactonojirimycin (= DGJ) bekam unter dem Freinamen Migalastat im April 2016 eine Zulassungsempfehlung vom Ausschuss für Humanarzneimittel zur Behandlung von Morbus Fabry[13] und ist seit Mai 2016 in der EU zugelassen.
In der traditionellen chinesischen Medizin (TCM) dienen die Blätter der Weißen Maulbeere der Behandlung und Vorbeugung von Diabetes mellitus.[14] Die Wurzeln werden unter dem Namen Sang-bai-pi (jap. Sohakuhi) als Entzündungshemmer, Diuretikum, Antitussivum und Antipyretikum verwendet. Als Glucosidase-Inhibitor ist 1-Deoxygalactonojirimycin in der Lage den Glucosespiegel im Blut zu senken.[5]
Synthese und Geschichte
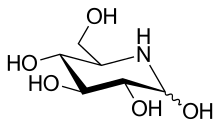
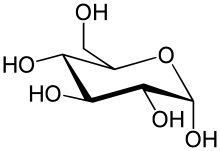
1966 synthetisierte der deutsche Naturstoffchemiker Hans Paulsen an der Universität Hamburg[15] mit 1-Deoxynojirimycin den ersten Iminozucker, bevor Iminozucker in der Natur gefunden wurden.[16] Ebenfalls 1966 wurde 5-Amino-5-desoxy-D-glucose aus der Fermentationsbrühe von Streptomyces lavaendulae isoliert und von den Entdeckern Norjirimycin genannt.[17]
Die Synthese der Iminozucker ist, vor allem bedingt durch die Anzahl an Stereozentren, relativ aufwändig und schwierig.
Literatur
- P. Compain, O. R. Martin (Hrsg.): Iminosugars: from synthesis to therapeutic applications. Verlag John Wiley and Sons, 2007, ISBN 0-470-03391-6 eingeschränkte Vorschau in der Google-Buchsuche
- A. E. Stütz: Iminosugars as Glycosidase Inhibitors: Nojirimycin and Beyond. Wiley-VCH, 1999, ISBN 3-527-29544-5
- D. D'Alonzo, A. Guaragna, G. Palumbo: Glycomimetics at the mirror: medicinal chemistry of L-iminosugars. In: Current Medicinal Chemistry. Band 16, Nummer 4, 2009, S. 473–505, PMID 19199917. (Review).
- T. D. Butters, R. A. Dwek, F. M. Platt: Imino sugar inhibitors for treating the lysosomal glycosphingolipidoses. (PDF; 285 kB) In: Glycobiology. Band 15, Nummer 10, 2005, S. 43R–52R. doi:10.1093/glycob/cwi076 (Review)
- N. Asano: Glycosidase inhibitors: update and perspectives on practical use. In: Glycobiology. Band 13, Nummer 10, Oktober 2003, S. 93R–104R, doi:10.1093/glycob/cwg090. PMID 12851286. (Review).
- A. de Raadt, C. W. Ekhart u. a.: Chemical and chemo-enzymatic approaches to glycosidase inhibitors with basic nitrogen in the sugar ring. In: Topics in Current Chemistry. Band 187, 1997, S. 157–186. doi:10.1007/BFb0119256 (Review).
- F. Schieweck: Stereoselektive Synthese von Iminozuckern. Bergische Universität-Gesamthochschule Wuppertal, Fachbereich Chemie, 2000.
- J. Ostrowski: Untersuchungen zur Darstellung von Iminozuckersystemen auf Nojirimycinbasis über zentrale Bausteine. Bergische Universität-Gesamthochschule Wuppertal, 2002.
- D. Best: Rare Monosaccharides and Biologically Active Iminosugars from Carbohydrate Chirons. PhD Thesis, University of Oxford, 2010.
Einzelnachweise
- M. Yagi, T. Kouno u. a.: The structure of maranoline, a piperidine alkaloid from Morus species. In: Nippon Nogei Kagaku Kaishi. 50, 1976, S. 571–572.
- T. Kimura, K. Nakagawa u. a.: Simple and rapid determination of 1-deoxynojirimycin in mulberry leaves. In: BioFactors. Band 22, Nummer 1–4, 2004, S. 341–345, PMID 15630308.
- W. Song, H. J. Wang u. a.: Phytochemical profiles of different mulberry (Morus sp.) species from China. In: Journal of Agricultural and Food Chemistry. Band 57, Nummer 19, Oktober 2009, S. 9133–9140, doi:10.1021/jf9022228. PMID 19761189.
- B. Islam, S. N. Khan u. a.: Novel anti-adherence activity of mulberry leaves: inhibition of Streptococcus mutans biofilm by 1-deoxynojirimycin isolated from Morus alba. In: Journal of Antimicrobial Chemotherapy. Band 62, Nummer 4, Oktober 2008, S. 751–757, doi:10.1093/jac/dkn253. PMID 18565974.
- T. Kimura, K. Nakagawa u. a.: Food-grade mulberry powder enriched with 1-deoxynojirimycin suppresses the elevation of postprandial blood glucose in humans. In: Journal of agricultural and food chemistry. Band 55, Nummer 14, Juli 2007, S. 5869–5874, doi:10.1021/jf062680g. PMID 17555327.
- N. Asano, A. Kato u. a.: The effects of calystegines isolated from edible fruits and vegetables on mammalian liver glycosidases. In: Glycobiology. Band 7, Nummer 8, Dezember 1997, S. 1085–1088, PMID 9455909.
- F. Schieweck: Stereoselektive Synthese von Iminozuckern. Bergische Universität-Gesamthochschule Wuppertal, Fachbereich Chemie, 2000, S. 5.
- S. V. Evans, L. E. Fellows u. a.: Glycosidase inhibition by plant alkaloids which are structural analogues of monosaccharides. In: Phytochemistry. Band 24, Nummer 9, 1985, S. 1953–1955. doi:10.1016/S0031-9422(00)83099-X
- R. A. Gruters, J. J. Neefjes u. a.: Interference with HIV-induced syncytium formation and viral infectivity by inhibitors of trimming glucosidase. In: Nature. Band 330, Nummer 6143, 1987 Nov 5-11, S. 74–77, doi:10.1038/330074a0. PMID 2959866.
- M. J. Humphries, K. Matsumoto u. a.: Inhibition of experimental metastasis by castanospermine in mice: blockage of two distinct stages of tumor colonization by oligosaccharide processing inhibitors. In: Cancer research. Band 46, Nummer 10, Oktober 1986, S. 5215–5222, PMID 3093061.
- E. Truscheit, W. Frommer u. a.: Chemistry and Biochemistry of Microbial α-Glucosidase Inhibitors. In: Angewandte Chemie International Edition. Band 20, Nummer 9, 1981, S. 744–761. doi:10.1002/anie.198107441
- W. Puls, U. Keup u.a: Glucosidase inhibition: a new approach to the treatment of diabetes, obesity, and hyperlipoproteinaemia. In: Naturwissenschaften. Band 64, 1977, S. 536–537.
- Galafold. Europäische Arzneimittel-Agentur. 1. April 2016.
- N. Asano: Naturally occuring iminosugars and related alkaloids: structure, activity and applications. In: P. Compain, O. R. Martin (Hrsg.): Iminosugars: from synthesis to therapeutic applications. Verlag John Wiley and Sons, 2007, ISBN 0-470-03391-6 eingeschränkte Vorschau in der Google-Buchsuche
- H. Paulsen: Carbohydrates Containing Nitrogen or Sulfur in the “Hemiacetal” Ring . In: Angew Chem Int Ed. Band 5, 1966, S. 495–510.
- N. Asano: Naturally occuring iminosugars and related alkaloids: structure, activity and applications. In: P. Compain, O. R. Martin (Hrsg.): Iminosugars: from synthesis to therapeutic applications. Verlag John Wiley and Sons, 2007, ISBN 0-470-03391-6, S. 7. eingeschränkte Vorschau in der Google-Buchsuche
- S. Inouye, T. Tsuruoka, T. Nida: The structure of nojirimycin, a piperidinose sugar antibiotic. In: Journal of Antibiotics. Band 19, Nummer 6, November 1966, S. 288–292, PMID 6013242.