Sirolimus
Sirolimus (SRL), auch Rapamycin genannt, ist ein Immunsuppressivum und mTOR-Inhibitor mit Makrolidstruktur (makrozyklisches Lacton). Es ist ein Produkt des Streptomyzeten Streptomyces hygroscopicus, einer Bakterienart, die erstmals aus dem Boden der Insel Rapa Nui (Osterinsel) isoliert wurde. Sirolimus und Tacrolimus sind miteinander verwandte Substanzen, die allerdings aus unterschiedlichen Streptomyzeten isoliert wurden und auch unterschiedliche Wirkmechanismen haben.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
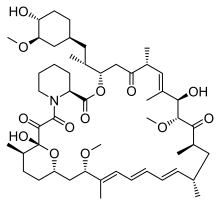 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sirolimus | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C51H79NO13 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L04AA10 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 914,17 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendungen
Sirolimus wird nach Nierentransplantationen, meist in Kombination mit Ciclosporin und Corticosteroiden, zur Verhinderung einer Organabstoßung eingesetzt. Als eine der wichtigen Nebenwirkungen ist die Wundheilungsstörung zu nennen. Im Gegensatz zu Ciclosporin oder auch Tacrolimus ist Sirolimus nicht nierentoxisch,[2] weshalb es keinen Beitrag zu einer chronischen Transplantatnephropathie liefert.[3][4][5][6]
In der Kardiologie werden die anti-proliferativen Effekte des Sirolimus ausgenutzt, um Wiederverengungen (Restenosen) durch eine Hyperplasie der Gefäß-Intima nach Implantation eines Stents in den Herzkranzgefäßen zu verhindern. Mit Sirolimus beschichtete Stents zeigen in mehreren Studien die Ausbildung von weniger Restenosen im Vergleich zum konventionellen Metallstent. Jedoch besteht die Gefahr einer Stentthrombose, da Sirolimus auch die Neubildung der Neointima verhindert und sich so über einen längeren Zeitraum Thrombozyten an dem Stent ansetzen und den Stent verschließen können.
Aufgrund seiner antiproliferativen Effekte auf Zellen rückte Rapamycin auch ins Blickfeld der Antitumortherapie, da es vermutlich Wachstum als auch Neovaskularisation bestimmter Tumore zu hemmen vermag. 2015 wurde in den USA von der FDA Sirolimus zur Behandlung der seltenen Lungenkrankheit Lymphangioleiomyomatose anerkannt.[7]
Des Weiteren zeigte sich Sirolimus außerordentlich wirksam beim Autoimmun-lymphoproliferativen Syndrom (ALPS), bei welchem der hyperaktive mTor-Signalweg in den pathognomonischen CD4- CD8- doppelt negativen T-Zellen (DNT) spezifisch inhibiert wird.[8][9]
In der Biochemie wird Sirolimus bei der chemisch induzierten Dimerisierung von bestimmten Fusionsproteinen verwendet.
Verlängerung der Lebensspanne
In einer Studie aus dem Jahr 2009 konnte die Lebensspanne von Mäusen um 28–38 % von Beginn der Behandlung verlängert werden, was insgesamt einer Verlängerung der maximalen Lebenserwartung um 9–14 % entspricht. Bemerkenswert ist dabei auch, dass die behandelten Mäuse bereits 20 Monate alt waren, was einem menschlichen Alter von etwa 60 Jahren entspricht.[10] Wegen der stark immunsuppressiven Wirkung – und der damit verbundenen Nebenwirkungen – von Rapamycin ist eine Übertragung der Ergebnisse auf den Menschen grundsätzlich nicht ohne Weiteres möglich.[11] Mittlerweile wurde eine Verlängerung der Lebensspanne bei Mäusen um 60 % erreicht.[12]
In den Vereinigten Staaten wurde 2016 ein fünfjähriger Feldversuch mit Rapamycin an über 1500 Hunden mit einem Körpergewicht von über 25 kg begonnen.[13][14]
Potenzial zur Therapie der Alzheimer-Krankheit
Im Tiermodell Maus zeigt Rapamycin eine potenziell positive Wirkung gegen Symptome der Alzheimer-Krankheit. Es wird vermutet, dass die Wirkung durch eine mTOR-Hemmung erfolgt. Erhöhte Ablagerungen von β-Amyloid erhöhen vermutlich die Expression von mTOR, während umgekehrt durch eine mTOR-Hemmung durch Rapamycin die Konzentration von β-Amyloid sich zu reduzieren scheint. Der mTOR-Signalweg spielt bei der Regulation der Proteinhomöostase eine Hauptrolle.[15][16] Bereits 2010 wies Derek Lowe in einem kleinen Blog-Beitrag mit der Überschrift „Rapamycin for Alzheimer’s?“ auf diese Option hin.[17] 2014 berichteten auch chinesische Wissenschaftler, dass eine mTOR-Blockade das Leben verlängern und die Entwicklung einer Alzheimer-Erkrankung verzögern könnte. Allerdings seien noch viele Fragen zu klären, bis dieser Wirkstoff in klinischen Studien geprüft werden könnte.[18]
Die Entwicklung neuer Wirkstoffe gegen die Alzheimer-Demenz ist von vielen Rückschlägen geprägt. Nach Ansicht der Wissenschaftler Matt Kaeberlein (University of Washington, Seattle) und Veronica Galvan (UT Health San Antonio, Texas) ist es sinnvoll, Rapamycin in klinischen Studien zu prüfen, und zwar am besten bei Patienten mit MCI (mild cognitive impairment) und bei Patienten, bei denen gerade eine Alzheimer-Erkrankung diagnostiziert wurde.[19]
Wirkmechanismus
Sirolimus hat einen anderen Wirkmechanismus als Ciclosporin und Tacrolimus, die beide Calcineurin hemmen. Die immunsuppressive Wirkung von Sirolimus (Rapamycin) dagegen kommt zustande, indem es mit einem intrazellulären zytosolischen Protein (FKBP12) einen Komplex bildet, der an eine 282 kDa große Serin/Threonin-Proteinkinase bindet und so dieses Protein, mTOR (mammalian Target of Rapamycin, etwa „Ziel von Rapamycin bei Säugetieren“) genannt, hemmt.[20]
Darüber können verschiedene Zytokin-vermittelte Signaltransduktionswege unterdrückt werden, die sonst von mTOR als Teil der Proteinkomplexe mTORC1 und mTORC2 ausgehen. In Folge unterbleibt die Transkription und Translation diverser Gene, insbesondere auch solcher, deren Produkte eine Proliferation vor allem von T-Lymphozyten vorantreiben. Sowohl deren Aktivierung als auch das Voranschreiten von der G1-Phase in die S-Phase des Zellzyklus der T-Zellen wird verhindert.
Handelsnamen
Rapamune®, Hersteller: Pfizer
Einzelnachweise
- Datenblatt Rapamycin from Streptomyces hygroscopicus bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- J. J. Augustine u. a.: Use of sirolimus in solid organ transplantation. In: Drugs 67, 2007, S. 369–391, PMID 17335296.
- Umstellung der Abstoßungsprophylaxe auf Sirolimus - Chance auf längeren Erhalt der Nierentransplantatfunktion. In: Dialyse aktuell 12, 2008, S. 526–528. doi:10.1055/s-0028-1104662.
- R. K. Wali und M. R. Weir: Chronic allograft dysfunction: can we use mammalian target of rapamycin inhibitors to replace calcineurin inhibitors to preserve graft function? In: Curr Opin Organ Transplant 13, 2008, S. 614–621, PMID 19060552.
- C. Morath u. a.: Sirolimus in renal transplantation. In: Nephrol Dial Transplant 22, 2007, S. 61–65, PMID 17890266.
- G. Stallone u. a.: There is a choice for immunosuppressive drug nephrotoxicity: Is it time to change? In: J Nephrol 22, 2009, S. 326–332, PMID 19557709.
- https://www.europeanpharmaceuticalreview.com/news/32030/rapamune-becomes-first-fda-approved-treatment-for-lymphangioleiomyomatosis-lam/In: European Pharmaceutical Review vom 1. Juni 2015.
- Christian Klemann, Myrian Esquivel, Aude Magerus-Chatinet, Myriam R. Lorenz, Ilka Fuchs: Evolution of disease activity and biomarkers on and off rapamycin in 28 patients with autoimmune lymphoproliferative syndrome. In: Haematologica. Band 102, Nr. 2, 1. Februar 2017, S. e52–e56, doi:10.3324/haematol.2016.153411, PMID 27789675, PMC 5286954 (freier Volltext).
- S. Volkl, A. Rensing-Ehl, A. Allgauer, E. Schreiner, M. R. Lorenz: Hyperactive mTOR pathway promotes lymphoproliferation and abnormal differentiation in autoimmune lymphoproliferative syndrome. In: Blood. Band 128, Nr. 2, 14. Juli 2016, S. 227–238, doi:10.1182/blood-2015-11-685024.
- D. E. Harrison, R. Strong, Z. D. Sharp u. a.: Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. In: Nature. 8. Juli 2009. doi:10.1038/nature08221.
- J. Rice: First Drug Shown to Extend Life Span in Mammals. In: Massachusetts Institute of Technology (Hrsg.): Technology Review. 8. Juli 2009, S. 1–2. Abgerufen am 9. Juli 2009.
- A. Bitto, T. K. Ito, V. V. Pineda, N. J. LeTexier, H. Z. Huang, E. Sutlief, H. Tung, N. Vizzini, B. Chen, K. Smith, D. Meza, M. Yajima, R. P. Beyer, K. F. Kerr, D. J. Davis, C. H. Gillespie, J. M. Snyder, P. M. Treuting, M. Kaeberlein: Transient rapamycin treatment can increase lifespan and healthspan in middle-aged mice. In: eLife. Band 5, August 2016, S. , doi:10.7554/eLife.16351, PMID 27549339, PMC 4996648 (freier Volltext).
- Elke Bodderas: Rapamycin könnte Ihnen neun Lebensjahre schenken. In: welt.de. 4. Juni 2016, abgerufen am 8. Juni 2016.
- Amy Harmon: Dogs Test Drug Aimed at Humans’ Biggest Killer: Age. In: nytimes.com. 16. Mai 2016, abgerufen am 8. Juni 2016 (englisch).
- A. Caccamo, S. Majumder, A. Richardson, R. Strong, S. Oddo: Molecular interplay between mammalian target of rapamycin (mTOR), amyloid-beta, and Tau: effects on cognitive impairments. In: J Biol Chem. 285, 2010, S. 13107–13120 PMID 20178983 PMC 285710 (freier Volltext).
- Rapamycin reduziert Alzheimersymptome bei Mäusen. In: Spektrumdirekt vom 26. Februar 2010.
- Rapamycin for Alzheimer’s?, Blog in Science Translational Medicine von Derek Lowe vom 5. April 2010, abgerufen am 5. Mai 2019
- Chong WangJin-Tai Yu et al.: Targeting the mTOR Signaling Network for Alzheimer’s Disease Therapy In: Molecular Neurobiology, Band 49, Februar 2014, doi:10.1007/s12035-013-8505-8
- Matt Kaeberlein, Veronica Galvan: Rapamycin and Alzheimer’s disease: Time for a clinical trial? In: Science Translational Medicine, Band 11, Januar 2019, doi:10.1126/scitranslmed.aar4289
- C. Sabers, M. Martin, G. Brunn, J. Williams, F. Dumont, G. Wiederrecht, R. Abraham: Isolation of a protein target of the FKBP12-rapamycin complex in mammalian cells. In: Journal of Biological Chemistry. Band 270, Nr. 2, Januar 1995, PMID 7822316, doi:10.1074/jbc.270.2.815, S. 815–822.
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Sirolimus
- Podcast-Folge zur Entdeckung von Rapamycin von Radiolab (englisch)