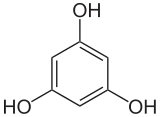
1,3,5-Trihydroxybenzol
1,3,5-Trihydroxybenzol (Trivialname Phloroglucin) ist ein Derivat des Benzols, ein dreiwertiges Phenol und gehört zur Gruppe der Polyphenole. Formal kann es daher auch als (Cyclo-)Trimer des Ketens (H2C=C=O) aufgefasst werden. Die beiden anderen Isomere sind 1,2,3-Trihydroxybenzol (Pyrogallol) und 1,2,4-Trihydroxybenzol (Hydroxyhydrochinon). Vom 1,3,5-Trihydroxybenzol leiten sich viele Naturstoffe wie Flavone und Anthocyanfarbstoffe ab.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 1,3,5-Trihydroxybenzol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H6O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser bis hellbeiger Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A03AX12 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 126,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,46 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Dampfdruck |
0,0036 Pa (100 °C, Sublimationsdruck)[3] | |||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Die erste Darstellung gelang dem österreichischen Chemiker Heinrich Hlasiwetz im Jahr 1855 aus dem Naturstoff Phloretin, der aus der Rinde von Obstbäumen gewonnen wurde.[7] Der Name Phloroglucin stammt aus der griechischen Umschreibung für "Süße Rinde".[5] Eine frühe Quelle beschreibt einen sehr süßen Geschmack der Verbindung.[8]
Vorkommen
Phloroglucin kommt in freier Form in verschiedenen Eucalyptus- und Akazienarten, wie z. B. Eucalyptus kino und Acacia arabica vor. Es konnte auch aus Streptomycetenkulturen isoliert werden. In Form von Glucosid- und Prenylderivaten wurde es in Hopfen, Farnen, Johanniskraut und Braunalgen gefunden. Es kann aus pflanzlichen Polyphenolen, wie Gerbstoffen, Flavonen und Anthocyanen durch einen Abbau isoliert werden.[2]
Darstellung und Gewinnung
1,3,5-Trihydroxybenzol kann durch die Spaltung vieler höher zusammengesetzter Pflanzenstoffe, wie Drachenblut, Gummigutt, Quercetin, Morin oder Maklurin erhalten werden.[8] Eine erste technische Synthese geht vom Trinitrotoluol aus, welches zunächst mittels Natriumdichromat zur entsprechenden Benzoesäure oxidiert wird. Im Folgeschritt wird nach einer Decarboxylierung und Reduktion mittels Eisen im sauren Medium das 1,3,5-Triaminobenzol erhalten. Eine nucleophile Substitution im wässrig saurem Medium ergibt dann die Zielverbindung.[5][2][9][10] Ein neueres Verfahren geht vom 1,3,5-Triisopropylbenzol aus, das analog zum Cumolhydroperoxid-Verfahren zunächst mittels Sauerstoff in das entsprechende Trihydroperoxid überführt wird. Dessen saure Spaltung ergibt dann 1,3,5-Trihydroxybenzol und Aceton.[5]
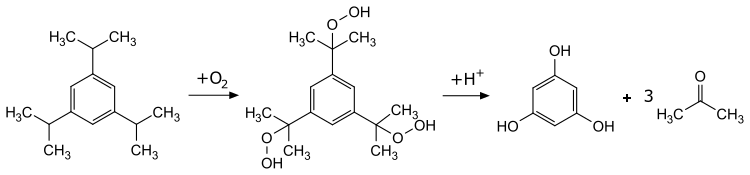
Weitere Synthesevarianten sind Umsetzung des 1,3,5-Triacetylbenzoltrioxims in einer Beckmann-Umlagerung und anschließender Hydrolyse[11], einer Hofmann-Umlagerung von Benzol-1,3,5-tricarbonsäuretriamid, sowie der nucleophilen Substitution mittels Alkoxiden am 1,3,5-Tribrombenzol und anschließender sauren Etherspaltung.[5] Auch durch das Schmelzen von Resorcin mit Natriumhydroxid kann 1,3,5-Trihydroxybenzol erhalten werden.[2]
Eigenschaften
Physikalische Eigenschaften
1,3,5-Trihydroxybenzol tritt in fester Phase in zwei Kristallformen, einem Anhydrat und einem Dihydrat auf.[12] Das Anhydrat schmilzt bei 218,7 °C mit einer Schmelzenthalpie von 34,5 kJ·mol−1.[3] Bei Raumtemperatur wandelt sich das Anhydrat schon ab einer relativen Luftfeuchte von 16 % in das Dihydrat um. Das Dihydrat gibt beim Erhitzen ab 50 °C das Wasser wieder ab. Der Prozess ist endotherm und mit einer Reaktionsenthalpie von 107 kJ·mol−1 verbunden. Nach Korrektur mit der Verdampfungsenthalpie von Wasser ergibt sich eine Umwandlungsenthalpie vom Dihydrat zum Anhydrat mit 19,3 kJ·mol−1. Beide Formen kristallisieren in orthorhombischen Kristallgittern, allerdings in unterschiedlichen Raumgruppen mit P212121 für das Anhydrat bzw. Pnma für das Dihydrat.[12] Die Verbindung zersetzt sich, bevor der Siedepunkt erreicht ist. Die Löslichkeit in Wasser beträgt etwa 1 Ma%, in Alkohol etwa 9 Ma% und in Pyridin 75 Ma%. In Ether und Benzol ist es gering löslich.[5]
Chemische Eigenschaften
Auf Grund einer Keto-Enol-Tautomerie mit einem Gleichgewicht zwischen 1,3,5-Trihydroxyphenol und Cyclohexa-1,3,5-trion verhält es sich chemisch sowohl wie ein Phenol wie auch ein Keton. In Veresterungs- und Veretherungsreaktionen können die entsprechenden mono, di- und trisubstituierten Phenole erhalten werden. Als Phenol geht es elektrophile Substitutionen wie Friedel-Crafts-Acylierungen, Halogenierungen oder Nitrierungen ein. Mit Hydroxylamin bildet es als Keton ein Trioxim bzw. mit Natriumbisulfit die entsprechenden Addukte.[5]

- Tautomerie von 1,3,5-Trihydroxybenzol
Die Hydrierung der Verbindung ergibt das 1,3,5-Trihydroxycyclohexan. Mit Diazoniumsalzen geht sie leicht Azokupplungen ein.[5] 1,3,5-Trihydroxybenzol ist lichtempfindlich und wird daher in braunen Glasflaschen aufbewahrt.
Verwendung
Salzsaure 1,3,5-Trihydroxybenzol-Lösung wird bei der Papier-Herstellung zum Nachweis von Lignin, der im Holzschliff enthalten ist, verwendet. Bei Anwesenheit von Lignin in einer Probe tritt eine rotviolette Färbung auf.[13] Dabei reagiert die Carbonylgruppe des in der Ligninstruktur enthaltenen Coniferylaldehyds mit dem 1,3,5-Trihydroxybenzol.[14] Es ist außerdem Bestandteil von Günzburgs Reagenz – einer alkoholischen Lösung von 1,3,5-Trihydroxybenzol und Vanillin zum qualitativen Nachweis der freien Salzsäure im Magensaft.[2]
In der Mikroskopie dient es zum Entkalken von Knochenproben. 1,3,5-Trihydroxybenzol dient auch als Reagens für Pentosen, Pentosane und Aldehyde.[2]
Es dient als Azo-Kupplungskomponente zum Färben von Baumwolle, Cellulosefasern, Viskose, Seide, Nylon und Leder und ist in Haarfärbemitteln und Kosmetika enthalten. Weiterhin wird es als Kuppler im Diazo-Druck genutzt. In der organischen Chemie dient als Ausgangskomponente für Lichtschutzsubstanzen, Photoresists, Pharmawirkstoffen, Stabilisatoren, Antioxidantien oder Flüssigkristallen. In der Polymerchemie führt es zu hochverzweigten Polymeren wie Polyimide, Polyester und Polyether.[2]
Nachweis
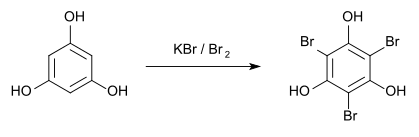
Zum qualitativ-analytischen Nachweis entsteht bei der Bromierung mit Kaliumbromid und Brom[15] das Tribromphloroglucin, das einen Schmelzpunkt von 151 °C hat.[16]
Siehe auch
Einzelnachweise
- Datenblatt 1,3,5-Trihydroxybenzol bei Acros, abgerufen am 27. November 2014.
- Eintrag zu Phloroglucin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Januar 2021.
- Verevkin, S.P.; Schick, C.: Determination of vapor pressures, enthalpies of sublimation, and enthalpies of fusion of benzenetriols in Thermochim. Acta 415 (2004) 35–42, doi:10.1016/j.tca.2003.09.011.
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Fiege, H.; Voges, H.-W.; Hamamoto, T.; Umemura, S.; Iwata, T.; Miki, H.; Buysch, H.-J.; Garbe, D.; Paulus, W.: Phenol Derivatives, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a19_313.
- Eintrag zu Phloroglucin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Hlasiwetz, H.: Ueber das Phloretin in Annalen der Chemie und Pharmacie 96 (1855) 118–123; doi:10.1002/jlac.18550960115.
- Meyers Konversations-Lexikon, 1888.
- Brockhaus ABC Chemie, 3. Auflage, F.A. Brockhausverlag Leipzig 1971, S. 1055.
- Clarke, H.T.; Hartman, W.W.: Phloroglucinol in Org. Synth. 9 (1929) 74, doi:10.15227/orgsyn.009.0074.
- Gorecki, P.; Kuran, W.: Diethylzinc–trihydric phenol catalysts for copolymerization of carbon dioxide and propylene oxide: Activity in copolymerization and copolymer destruction processes in J. Polym. Sci. Polym. Lett. 23 (1985) 299–304, doi:10.1002/pol.1985.130230603.
- Braun, D.E.; Tocher, D.A.; Price, S.L.; Griesser, U.J.: The Complexity of Hydration of Phloroglucinol: A Comprehensive Structural and Thermodynamic Characterization in J. Phys. Chem. B 116 (2012) 3961–3972, doi:10.1021/jp211948q.
- Brockhaus' Konversations-Lexikon, Vierzehnte vollständig neubearbeitete Auflage, 13. Band, F.A. Brockhaus in Leipzig, Berlin und Wien, 1895, S. 102.
- Experimentalvortrag "Vom Baum zum Apfel", Marietta Fischer, Universität Marburg (MS Word; 2,1 MB).
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 331.
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 653.