Hexamethylphosphorsäuretriamid
Hexamethylphosphorsäuretriamid (kurz HMPT) ist eine stark krebserregende organische Verbindung aus der Stoffgruppe der Phosphorsäureamide.[1] Es wird als Lösungsmittel in der Organischen Chemie verwendet, allerdings wird von der Verwendung von HMPT als Lösungsmittel aufgrund der Gesundheitsgefährdung dringend abgeraten.[5][6] Das aprotisch-polare Lösungsmittel löst sowohl anorganische, als auch organische Verbindungen, viele Kunststoffe und auch Gase.[2] HMPT befindet sich auf der Liste der besonders gefährlichen krebserregenden Stoffe im Anhang der Gefahrstoffverordnung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
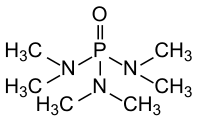 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexamethylphosphorsäuretriamid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H18N3OP | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 179,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,024 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
233 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
beliebig mit Wasser mischbar[1] | |||||||||||||||
| Brechungsindex |
1,4579 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung und Gewinnung
Hexamethylphosphorsäuretriamid kann durch die Umsetzung von Phosphoroxychlorid mit Dimethylamin hergestellt werden.[7]
Eigenschaften
Hexamethylphosphorsäuretriamid ist eine farblose Flüssigkeit, die einen Schmelzpunkt von 7 °C und unter Normaldruck einen Siedepunkt von 233 °C besitzt.[1] Die Verbindung ist mit Wasser vollständig mischbar. Die Wärmekapazität beträgt bei 25 °C 321,3 J·mol−1·K−1 bzw. 1,793 J·g−1·K−1.[8] Bei erhöhter Temperatur können entzündbare Dampf-Luft-Gemische gebildet werden. Der Flammpunkt liegt bei 105 °C.[1] Die Zündtemperatur beträgt 230 °C. Der Stoff fällt somit in die Temperaturklasse T3.[1]
Verwendung
In der Reihe DMF, DMSO und HMPT ist HMPT das beste aprotisch-polare Lösungsmittel. Daher wird es in der organischen Synthese verwendet. Nachteilig ist jedoch, dass es sich bei dem Stoff um eine besonders gefährliche krebserzeugende und erbgutverändernde Substanz (in Kategorie 1B) handelt.[1] Daher darf der Stoff nach Anhang II Nr. 6 der deutschen GefStoffV nur in geschlossenen Anlagen hergestellt oder verwendet werden.[9] Auf Grund der krebserzeugenden Eigenschaften wird HMPT im Laborjargon mitunter auch als liquid cancer („flüssiger Krebs“) bezeichnet.[10][11][12] Aufgrund der toxischen Eigenschaften wird versucht, HMPT durch andere Lösungsmittel – insbesondere die oben genannten, oder die Harnstoffderivate Dimethylpropylenharnstoff (DMPU)[13] und 1,3-Dimethyl-2-imidazolidinon (DMI) – zu ersetzen. Weitere Ersatzstoffe sind N-Methyl-2-pyrrolidon (NMP), Sulfolan und Kohlensäureester.
Sicherheitshinweise
Die Verbindung hat sich im Tierversuch als eindeutig krebserzeugend erwiesen. Es wird durch die Haut resorbiert.[2] HMPT bewirkt die innere Verbrückung von DNA-Doppelsträngen.[14] Die enzymatische Verstoffwechselung von HMPT mittels Cytochrom P450 führt zur N-Demethylierung und in der Folge zur oxidativen Bildung von Formaldehyd. Das hohe krebserzeugende Potenzial des Phosphoramids könnte herrühren aus dem Zusammenwirken innerzellulärer Formaldehyd-Freisetzung und zusätzlicher Mitogenese-Stimulation.
Einzelnachweise
- Eintrag zu Hexamethylphosphorsäuretriamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Eintrag zu Hexamethylphosphorsäuretriamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Dezember 2017.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-280.
- Eintrag zu Hexamethylphosphoric triamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- PubChem: Hexamethylphosphoramide. Abgerufen am 18. Oktober 2021 (englisch).
- Chi -Chu Lo, Pei -Min Chao: Replacement of carcinogenic solvent HMPA by DMI in insect sex pheromone synthesis. In: Journal of Chemical Ecology. Band 16, Nr. 12, Dezember 1990, ISSN 0098-0331, S. 3245–3253, doi:10.1007/BF00982095 (springer.com [abgerufen am 18. Oktober 2021]).
- B. B. Pavankumar, E. V. Goud, R. Selvakumar, S. K. A. Kumar, A. Sivaramakrishna, K. Vijayakrishna, C. V. S. Rao, K. N. Sabharwal, P. C. Jha: Function of substituents in coordination behaviour, thermolysis and ligand crossover reactions of phosphine oxides. In: RSC Advances. 5, 2015, S. 4727–4736, doi:10.1039/c4ra13645d.
- A. F. Vorob'ev, P. N. Yakovlev: The specific heats of dimethylformamide-water and hexamethylphosphoramide-water mixtures. In: Zhur. Fiz. Khim. 56, 1982, S. 1933–1936.
- Gefahrstoffverordnung. Stand: April 2017.
- M. Wiecko: Komplexe zweiwertiger Lanthanoide und Erdalkalimetalle und neue Bindungen mit Metallen der Gruppe 13. Cuvillier Verlag, Göttingen 2008, ISBN 978-3-86727-689-4.
- Florian Mummy: Polymer supported organocatalysts for regio- and stereoselective synthesis. 2012. urn:nbn:de:kobv:188-fudissthesis000000039472-8
- Marco Röben: NMR-spektroskopische Untersuchungen des an Cph1-, Agp1-gebundenen und des freien Chromophors zur Aufklärung des Phytochrom Photozyklus. 2012. urn:nbn:de:kobv:188-fudissthesis000000036732-2
- Triptikumar Mukhopadhyay, Dieter Seebach: Substitution of HMPT by the cyclic urea DMPU as a cosolvent for highly reactive nucleophiles and bases. In: Helvetica Chimica Acta. 65, 1982, S. 385–391.
- E. W. Vogel, A. T. Natarajan: DNA damage and repair in somatic and germ cells in vivo. In: Mutation Research. (330), 1995, S. 183.
