Nukleotidase
Nukleotidase (auch: Nukleotid-Phosphatase) heißen Enzyme, die die Hydrolyse einer Phosphatgruppe von (Desoxy-)Ribonukleosidmonophosphaten (also dAMP, AMP, GMP, TMP und so weiter) zum jeweiligen Nukleosid katalysieren. Sie kommen in allen Lebewesen vor. Die Reaktion ist Teil des Abbaus der Nukleotide.
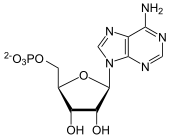
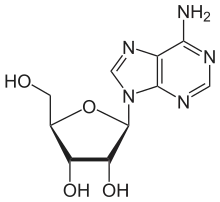
Es gibt mehrere verschiedene Nukleotidasen, die sich durch den Reaktionsmechanismus unterscheiden. Die Hydrolyse von an 5'-Position gebundenen Phosphaten wird durch die 5'-Nukleotidase bewerkstelligt (EC 3.1.3.5), die die größte Substratbandbreite besitzen. Entsprechend erleichtert die 3'-Nukleotidase in Bakterien die Abspaltung einer 3'-Phosphatgruppe von 3'-AMP, -GMP, -UMP und -CMP sowie 3'-dAMP und -dGMP (EC 3.1.3.6); weiterhin katalysiert die Phosphoadenylat-3'-Nukleotidase die Abspaltung des 3'-Phosphats in PAP (EC 3.1.3.7).
Beim Menschen sind folgende Nukleotidasen bekannt:
| EC | Gen-Name | UniProt | Substrate | Besonderheiten |
|---|---|---|---|---|
| 3.1.3.5 | NT5C1A | Q9BXI3 | AMP, CMP, GMP, IMP, TMP, UMP, XMP (Desoxy- schwächer) | Skelettmuskeln |
| 3.1.3.5 | NT5C1B | Q96P26 | AMP, CMP, GMP, IMP, TMP, UMP, XMP (Desoxy- schwächer) | Hoden, Plazenta, Pankreas |
| 3.1.3.5 | NT5C2 | P49902 | AMP, GMP, IMP (schwach: CMP, TMP, UMP, XMP) | |
| 3.1.3.5 | NT5C3A | Q9H0P0 | CMP, TMP, UMP | 4 Isoformen; Retikulozyten, Lymphozyten; Pathologie: erblicher P5N-Mangel, impliziert bei Bleivergiftung |
| 3.1.3.5 | NT5C3L | Q969T7 | AMP, CMP, GMP, IMP, TMP, UMP, XMP (Desoxy- schwächer) | |
| 3.1.3.5 | NT5E | P21589 | AMP, CMP, GMP, IMP, TMP, UMP, XMP | CD73, Pathologie: erbliche Gelenk- und Arterienverkalkung (CALJA) |
| 3.1.3.5 | ACPP | P15309 | AMP (nur Isoform 2) | Drüsen- und Epithelzellen; Isoform 2 multifunktionell |
| 3.1.3.7 | BPNT1 | O95861 | PAPS, PAP | Nieren, Leber, Pankreas, Herz |
| 3.1.3.7 | IMPAD1 | Q9NX62 | PAP, InsP | Pathologie: Chondrodysplasie (CDR-GPAPP) |
Literatur
- T. M. Grazia: Inborn errors in purine metabolism: role of 5'-nucleotidases and their involvement in the etiology of neurological impairments. In: Nucleosides, nucleotides & nucleic acids. Band 30, Nummer 12, Dezember 2011, S. 1276–1283, ISSN 1532-2335. doi:10.1080/15257770.2011.616869. PMID 22132987. (Review).
- P. L. Ipata, M. Camici u. a.: Metabolic network of nucleosides in the brain. In: Current Topics in Medicinal Chemistry. Band 11, Nummer 8, 2011, S. 909–922, ISSN 1873-4294. PMID 21401502. (Review).
- C. Rampazzo, C. Miazzi u. a.: Regulation by degradation, a cellular defense against deoxyribonucleotide pool imbalances. In: Mutation Research. Band 703, Nummer 1, November 2010, S. 2–10, ISSN 0027-5107. doi:10.1016/j.mrgentox.2010.06.002. PMID 20561600. (Review).
- H. Zimmermann, M. Zebisch, N. Sträter: Cellular function and molecular structure of ecto-nucleotidases. In: Purinergic signalling. Band 8, Nummer 3, September 2012, S. 437–502, ISSN 1573-9546. doi:10.1007/s11302-012-9309-4. PMID 22555564. PMC 3360096 (freier Volltext).
- B. L. Dhananjaya, C. J. D'Souza: The pharmacological role of nucleotidases in snake venoms. In: Cell biochemistry and function. Band 28, Nummer 3, April 2010, S. 171–177, ISSN 1099-0844. doi:10.1002/cbf.1637. PMID 20186872. (Review).