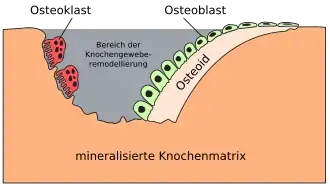
Knochenumbau
Der Knochenumbau (englisch bone (re)modeling ‚Knochengewebe(re)modellierung‘)[2] ist ein fortwährend ablaufender Prozess, in dessen Verlauf altes Knochengewebe von Osteoklasten abgebaut und von Osteoblasten am gleichen (remodeling) oder anderen (modeling) Ort neu gebildet wird. Pro Jahr werden etwa 3 % des kortikalen Knochens und 25 % des trabekulären Knochens auf diese Weise umgebaut; innerhalb von 7 bis 10 Jahren wird demnach das Äquivalent der gesamten Knochenmasse des Menschen einmal abgebaut und neu synthetisiert.
Aufgabe
Der Knochenumbau dient dem Erhalt eines stabilen und funktionsfähigen Skelettsystems, das ohne diesen Reparaturmechanismus schnell verschleißen würde. Ein wesentlicher Mechanismus besteht darin, Strukturschäden (Micro Cracks), die durch alltägliche Bewegungen und Beanspruchungen entstehen, zu reparieren und dabei zugleich die Mikroarchitektur der Beanspruchung anzupassen. Die Anpassung des Knochens an seine Belastung wurde erstmals von Julius Wolff am Beispiel der Spongiosaarchitektur gezeigt und ist Gegenstand des Wolffschen Gesetzes von 1892.
Auf gleiche Weise übernimmt der Knochenumbau auch die Wiederherstellung des voll funktionsfähigen Knochens am Ende der Frakturheilung. Hierbei wird der Kallus aus Geflechtknochen nach und nach durch an die Belastungsrichtung angepassten Lamellenknochen ersetzt.
Da die Knochen zusätzlich zu ihrer Funktion im Stütz- und Bewegungsapparat das größte Reservoir des Körpers für Calcium und Phosphat darstellen, ist die Demineralisierung oder der Abbau von Knochengewebe auch für die Calciumhomöostase von großer Bedeutung: Durch Verstärkung der ohnehin im Rahmen des Knochenumbaus stattfindenden Osteoklastenaktivität kann bei akutem Calciummangel schnell Calcium zur Verfügung gestellt werden, ohne dass langfristig Knochensubstanz verloren geht.
Funktionsweise
Im Laufe des Remodelings „graben“ sich Osteoklasten mit Hilfe verschiedener lytischer Enzyme (Cathepsin K, MMP-3 und 9, ALP) in die Knochenmatrix und bilden Gruben an der Oberfläche der Trabekel (Howshipsche Lakunen) oder Bohrkanäle im Inneren der Kortikalis. Dieser Resorption nachfolgend sezernieren Osteoblasten in großen Feldern von wenigstens 50 Zellen neues kollagenes Knochengrundgerüst (Osteoid) ab, welches im weiteren Verlauf nach und nach kalzifiziert und somit neue Knochenmatrix bildet. Einige der Osteoblasten werden hierbei von der mineralisierenden Matrix eingeschlossen und differenzieren im weiteren Verlauf zu Osteozyten.
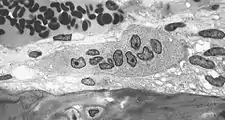 Transmissionselektronenmikroskopische Aufnahme (TEM) eines Osteoklasten in der Bildmitte. Die Mehrkernigkeit dieses knochenabbauenden Zelltyps ist gut sichtbar.
Transmissionselektronenmikroskopische Aufnahme (TEM) eines Osteoklasten in der Bildmitte. Die Mehrkernigkeit dieses knochenabbauenden Zelltyps ist gut sichtbar.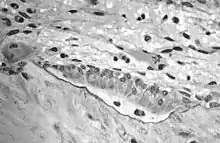 Aufnahme mehrerer Osteoblasten, den knochenaufbauenden Gegenspielern der Osteoklasten. In der TEM-Aufnahme ist das von den Osteoblasten synthetisierte Osteoid als helle, zur mineralisierten Knochenmatrix hin scharf abgegrenzten Zone (schwarze Grenzlinie) mit zwei eingelagerten Osteozyten (ehemalige Osteoblasten) gut zu erkennen.
Aufnahme mehrerer Osteoblasten, den knochenaufbauenden Gegenspielern der Osteoklasten. In der TEM-Aufnahme ist das von den Osteoblasten synthetisierte Osteoid als helle, zur mineralisierten Knochenmatrix hin scharf abgegrenzten Zone (schwarze Grenzlinie) mit zwei eingelagerten Osteozyten (ehemalige Osteoblasten) gut zu erkennen.
Regulation
Im Zentrum der Regulation des Knochenumbaus stehen die Osteozyten, die mit ihren Zellfortsätzen in den Canaliculi das gesamte Knochengewebe durchziehen und untereinander mittels Gap Junctions Informationen austauschen: Sie erfassen die mechanische Beanspruchung über Scherkräfte an ihrer Zelloberfläche, die entstehen, wenn extrazelluläre Flüssigkeit bei Verformung des Knochens durch das lakuno-kanalikuläre System gepresst wird. Auch den radiär ausgespannten feinen Fädchen, mit denen die Zellmembranen an den Wänden der Canaliculi befestigt sind, könnte eine mechanosensorische Funktion zukommen. Darüber hinaus detektieren Osteozyten Mikroschäden des Knochengewebes in ihrer Umgebung. All diese Informationen integrieren sie mit chemischen Signalen des lokalen Milieus und des endokrinen Systems. Osteoblasten wirken teilweise synergistisch in der Regulation mit. Über die folgenden Mechanismen können Osteozyten auf den Knochenauf- und -abbau einwirken:
- Sekretion von Sclerostin, das die Proliferation und Differenzierung von Vorläuferzellen zu Osteoblasten sowie die Osteoblastenaktivität hemmt (ausgeschüttet bei mangelnder mechanischer Belastung; Parathormon hemmt die Sekretion)
- Sekretion von M-CSF, das die Proliferation von Vorläuferzellen der Osteoklasten fördert
- Expression des Membranproteins RANKL, dessen Bindung an RANK, einen Membranrezeptor der Osteoklasten, Voraussetzung für deren Aktivierung ist (Parathormon fördert die Expression)
- Sekretion von Osteoprotegerin, das als Decoy-Rezeptor den RANKL besetzt und unwirksam macht
Daneben können die Osteozyten über die endokrine Sekretion von FGF23 die Phosphatausscheidung in der Niere stimulieren. Auf Mikroschäden des Knochengewebes reagieren die lokalen Osteozyten mit Apoptose, während die umliegenden Osteozyten vermehrt RANKL exprimieren, sodass der geschädigte Bereich rasch von Osteoklasten abgeräumt wird. Die Osteoblasten koordinieren ihre Aktivität untereinander über Gap Junctions. Die Mechanismen, über die die Aktivität von Osteoklasten an die Aktivität von Osteoblasten gekoppelt ist, sind schlecht verstanden.
Parathormon dient der akuten Bereitstellung von Calcium im Rahmen der Calciumhomöostase. Chronisch erhöhte PTH-Spiegel bewirken zunächst einen erhöhten Knochenumsatz und später den Verlust von Knochensubstanz, da die RANKL-vermittelte Osteoklastenaktivierung die erhöhte Osteoblastenaktivität überwiegt, die aus der verminderten Hemmung durch Sclerostin resultiert. Bei intermittierend erhöhten Hormonspiegeln, wie sie etwa durch tägliche Injektionen herbeigeführt werden können, besteht die wesentliche Wirkung des PTHs dagegen in der Hemmung der Sclerostinsekretion, was therapeutisch zum Gewinn von Knochensubstanz ausgenutzt werden kann.
Calcitriol (aktiviertes Vitamin D) fördert einerseits die Differenzierung von Osteoklasten aus Vorläuferzellen und andererseits die Aktivität der Osteoblasten. Insgesamt bewirkt es meist den Aufbau von Knochensubstanz, woran aber die Erhöhung des Calciumangebots durch seine Wirkungen an Darm und Niere den größeren Anteil hat.
Östrogene und Androgene hemmen die Apoptose von Osteozyten, außerdem hemmen sie die Entstehung und Aktivierung und fördern die Apoptose von Osteoklasten. Der so vermittelte Schutz vor Knochenabbau vermindert sich mit der Menopause, was das erhöhte Osteoporoserisiko älterer Frauen gegenüber gleichaltrigen Männern erklärt.
Literatur
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, Kapitel 8.4 Knochen.
- A. G. Porras, S. D. Holland, B. J. Gertz: Pharmacokinetics of alendronate. In: Clinical Pharmacokinetics Band 36, Nummer 5, Mai 1999, S. 315–328, ISSN 0312-5963. PMID 10384857. (Review).
- M. M. Cohen: The new bone biology: pathologic, molecular, and clinical correlates. In: American journal of medical genetics. Part A Band 140, Nummer 23, Dezember 2006, S. 2646–2706, ISSN 1552-4825. doi:10.1002/ajmg.a.31368. PMID 17103447. (Review).
- G. A. Rodan, T. J. Martin: Role of osteoblasts in hormonal control of bone resorption–a hypothesis. In: Calcified tissue international, Band 33, Nummer 4, 1981, S. 349–351, PMID 6271355, ISSN 0171-967X.
Einzelnachweise
- Bone Health and Osteoporosis. (PDF; 25 MB) U. S. Department of Health and Human Services under the general direction of the Office of the Surgeon General, 2004, S. 22. Nach: F. Rauch, F. H. Glorieux: Osteogenesis imperfecta. In: Lancet Band 363, Nummer 9418, April 2004, S. 1377–1385, ISSN 1474-547X. doi:10.1016/S0140-6736(04)16051-0. PMID 15110498. (Review).
- P. Reuter: Der Große Reuter: Springer Universalwörterbuch Medizin, Pharmakologie und Zahnmedizin. Deutsch-Englisch. Birkhäuser, 2005, ISBN 3-540-25104-9, S. 742, books.google.de