Zeolith A
Zeolith A ist ein synthetisches, farbloses, kristallines Alumosilicat und hat in seiner hydratisierten Natrium-Form die Summenformel Na12((AlO2)12(SiO2)12) · 27 H2O. Unter der Sammelbezeichnung Zeolith A verbergen sich verschiedene Varianten dieser Verbindung. Alle verfügen über das gleiche Alumosilicat-Gitter, enthalten aber statt Natrium-Ionen andere Ionen wie Kalium oder Calcium. Da die Struktur des Zeolith-Gitters unabhängig vom Wassergehalt ist, werden auch die wasserfreien Formen zu Zeolith A gezählt. Zeolith A gehört zur Gruppe der Zeolithe, zählt jedoch nicht zu den Mineralen.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Zeolith A | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | Na12((AlO2)12(SiO2)12) · 27 H2O | ||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 2191,05 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Zeolith A wird in seiner Natrium-Form als ein Enthärtungsmittel, in seinen dehydratisierten (=entwässerten, aktivierten) Formen als Trockenmittel verwendet. Es findet so Anwendung in Waschmitteln als Enthärter, im Laborbereich als Entwässerungsmittel von Lösemitteln, zur Trocknung von Gasen (z. B. der Luft oder Erdgasen) und dient zur technischen Trennung geradkettiger und verzweigter Alkane. Der breite Nutzen von Zeolith A hat diese Chemikalie zu einer Massenchemikalie gemacht. Es werden mehrere hunderttausend Tonnen pro Jahr hergestellt.
Struktur
Einleitung

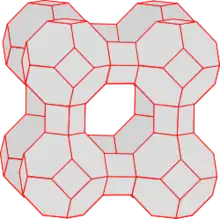
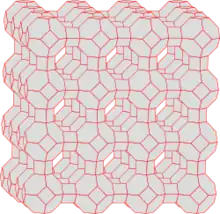
Zeolith A hat eine Gerüststruktur aus AlO4− und SiO4−Tetraedern. Sie bilden ein kovalentes Gitter mit Hohlräumen, die in der Regel Wasser enthalten. Dieses Gitter ist ein riesiges Anion. Daher enthalten die Hohlräume entsprechend viele Kationen, die im inneren Wasser gelöst oder an den inneren Wänden koordiniert sind. Die Abbildung 1 zeigt einen repräsentativen Ausschnitt der Gitterstruktur (Einheitszelle). Im nächsten Abschnitt wird die Einheitszelle in einigen Gedankenschritten aufgebaut, um die übliche Präsentationsform der Einheitszellen, sowie die physikalischen und chemischen Eigenschaften verstehen zu können.
Das anionische Gitter
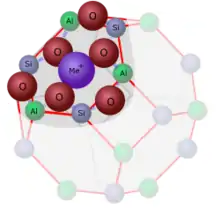
Zeolith A hat eine Gerüststruktur aus AlO4- und SiO4-Tetraedern im Verhältnis 1:1. Dabei sind im Wechsel Aluminium- und Silicium-Atome untereinander durch Sauerstoffatome verbunden. Da sich die Tetraeder an jeder Knüpfungsstelle ein Sauerstoffatom teilen, fallen auf jedes Al- und Si-Atom je 2 Sauerstoffatome. Aus einer Bilanz der Oxidationsstufen ergibt sich, dass jedes Al-Atom des kovalenten Gerüstes eine negative Ladung erzeugt. Diese Ladung wird durch ionische Bindungen mit Kationen wie z. B. Na+ ausgeglichen. (Oxidationsstufen: Si +4, Al +3 und O −2; SiO2 = 0; AlO2 = −1).
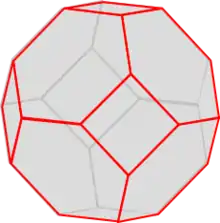
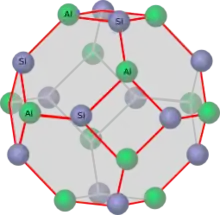
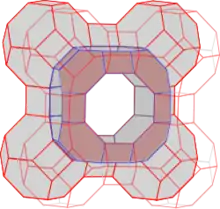
Die Verknüpfung der Al- und Si-Tetraeder führt zu einer räumlich dreidimensionalen Struktur. Aus Tetraedern lassen sich eine Vielzahl Strukturen bilden, was die große Anzahl verschiedener Zeolithe erklärt. Im Fall Zeolith A wird der so genannte Sodalithkäfig (Abb. 2) gebildet. Abbildung 3 zeigt die Positionen von Al und Si. Sauerstoffatome sind hier nicht gezeigt. Je ein Sauerstoff befindet sich in der Nähe der zwischen den Atomen gezeichneten roten Linien. Diese Darstellung zeigt nur drei Bindungsrichtungen der Al- und Si-Tetraeder. Die vierte Richtung erlaubt eine Verknüpfung mit weiteren Sodalithkäfigen. Abb. 1 zeigt die Verknüpfung von acht Käfigen, wie sie bei Zeolith A vorliegen. Bei dieser Verknüpfung der Sodalithkäfige wird im Zentrum ein neuer Käfig gebildet, der Alpha-Käfig genannt wird. In Abbildung 4 ist dieser Käfig deutlicher abgehoben dargestellt. Die Einheitszelle stellt nur einen kleinen Ausschnitt des Zeolithen dar. Abbildung 5 stellt acht verknüpfte Einheitszellen dar. Reihen sich viele Einheitszellen aneinander, bildet sich ein mikroskopisch großer, würfelförmiger Kristall. Jeder Kristall ist ein einziges riesiges Multi-Anion.
Die Kationen
Die Ladung des Multi-Anions wird durch eine ionische Bindung zu Kationen ausgeglichen. In einem wasserfreien Zeolith nehmen die Kationen recht feste Koordinationsplätze in der Nähe der Sin Aln O2n-Ringen ein. Abbildung 6 zeigt die Position eines Kations an dem 12-Ring des Sodalith-Käfigs. Bei Zeolith A mit einfach geladenen Kationen reicht die Anzahl der 12-Ringe nicht aus. Es müssen auch die großen Ringe des alpha-Käfigs genutzt werden. Kationen an dieser Position versperren einen Teil dieser großen Öffnung. Bei zweifach geladenen Kationen reicht die Zahl der 12-Ringe aus. Der Ring des alpha-Käfigs bleibt ungenutzt. Diese Belegung oder Nichtbelegung des alpha-Käfigs und die Größe der Kationen ist entscheidend für die Verwendung von Zeolith A als Molsieb (s. u.).
Enthält der Zeolith Wasser, sind die Kationen sehr beweglich. Sie sind im Wasser (fast) gelöst und somit gegen andere Kationen austauschbar. Diese Eigenschaft ist entscheidend für die Verwendung als Enthärter von Wasser (s. u.). Hier wird jeweils 2 Na+ gegen ein Ca2+ ausgetauscht, da Ca2+ eine höhere Affinität zum Zeolithen besitzt als das Na+ Kation.
Suspendiert man Natrium-Zeolith A in reinem Wasser, steigt der pH-Wert des Wassers auf pH = 10 bis 10.5 (bei 3 g in 100 ml). Der Zeolith hat Na+ in das Wasser gegeben und dafür H+-Ionen aufgenommen. Die H+-Ionen waren zuvor Bestandteil von H2O. OH− bleibt zurück, der pH-Wert ist gestiegen. Auch diese Reaktion ist ein Ionenaustausch des Zeolithen.
Das Wasser
Das Wasser im Zeolith A befindet sich in den Sodalith- und den alpha-Käfigen. Die Wassermoleküle sind (fast) frei beweglich, wechselwirken aber stark mit den Kationen und dem anionischen Zeolith-Gitter. Daher ist der Dampfdruck des Wassers im Zeolith deutlich niedriger als derjenige von freiem Wasser (siehe Kapillareffekt). Das Wasser kann durch Erhitzen aus dem Zeolith entfernt werden, ohne die Gitterstruktur zu verändern oder zu zerstören. Beim Erhitzen des Zeolithen scheint es, als wenn der Feststoff kochen würde. Dabei strömt gasförmiges Wasser aus dem Feststoff und wirbelt die Kristalle auf (Siedestein).
Synthese

Die Synthese kann aus einer Mischung aus Aluminium- und Silicium-Hydroxiden in Natronlauge bei Temperaturen zwischen 50 und 90 Grad Celsius durchgeführt werden. Die Hydroxide können mit Natronlauge frisch aus Aluminiumpulver und Tetraethylorthosilicat getrennt hergestellt und dann vermischt werden. Vorteilhaft ist ein Überschuss von Aluminium.
Die Kristalle sind in Abbildung 7 zu sehen und sind in der Regel zwischen 0.5 und 10 µm groß.
Verwendung
Trockenmittel
Zeolith A als Trockenmittel: Der alpha-Käfig und der Sodalith-Käfig haben genug freies Innenvolumen und ausreichend große Ringöffnungen (auch Poren oder Kanälen genannt), um Wassermoleküle aufzunehmen oder abzugeben. Enthält der Zeolith kein Wasser, so zeigt sich eine hohe Tendenz, Wasser aufzunehmen. Die Aufnahme ist eine exotherme Reaktion und führt zur Hydratation der Kationen und der anionischen Gerüststruktur. Das Wasser lässt sich gut unter Vakuum und erhöhter Temperatur reversibel entfernen. Zeolith A ist in Form kleiner Kugeln erhältlich, die aus den kleinen Kristallen und Bindemitteln geformt sind. Sie lassen sich staubarm trocknen oder durch Dekantieren von einem Lösemittel trennen, das damit getrocknet wurde.
Wasserenthärtung: Ionenaustausch
Zeolith Natrium-A als Enthärter von Wasser: In der hydratisierten Form des Zeolithen liegen die Kationen in den Hohlräumen ähnlich wie in einer Lösung vor. Sie sind mobil und wenig fest an einen Ort gebunden. Sie können durch andere Kationen ausgetauscht werden, wenn der Zeolith in Wasser suspendiert ist. Ca2+ wird bevorzugt aufgenommen. Dabei werden 2 Na+-Ionen zur Erhaltung der Ladungsbilanz abgegeben (Ionenaustausch). In der wässrigen Phase (= im Wasser) steht nun kein freies Ca2+ mehr zur Verfügung, die z. B. bei Waschmitteln zur Bildung von unlöslichen Kalkseifen führen. Da der Austausch eine Gleichgewichtsreaktion ist, kann das Ca2+ aus dem Zeolithen durch Na+ entfernt werden, wenn Na+ in hoher Konzentration in der wässrigen Phase angeboten wird (Regenerierung).
Zeolith A ist der übliche Ersatzstoff für Phosphate in Waschmitteln, gilt als umweltneutral und ist ungiftig. Es wurde zuerst von Milan Schwuger und Heinz-Gerd Smolka bei Henkel 1972 eingeführt und die ersten phosphatfreien Waschmittel kamen damit 1977 auf den Markt. Sein Nachteil ist sein Anfallen im Klärschlamm. Da ein Mineral grundsätzlich nicht biologisch abbaubar ist, erhöht es die zurückbleibende Schlammmenge.
Selektivität beim Ionenaustausch:
Ag+ > Na+ > K+ > NH4+ > Li+
Ba2+ > Ca2+ > Cd2+ > Mg2+
Molekularsieb
Zeolith A als Molekularsieb: Technische Trennung geradkettiger und verzweigter Alkane mit wasserfreiem Zeolith A. Geradkettige (n-) Alkane können durch die Öffnung des alpha-Käfigs in den Zeolith eindringen. Verzweigte (iso-) Alkane sind sperriger und werden nicht aufgenommen. n-Alkane werden sozusagen herausgesiebt. Die Größe der Öffnung des alpha-Käfigs wird nicht nur durch die fixe Ringgröße bestimmt, sondern wird von den Kationen des Zeolithen beeinflusst. Bei Na-A im wasserfreien Zeolith nutzen Na+-Ionen diesen Platz als recht festen Bindungssort, da kein Wasser zum Lösen vorhanden ist. Die Öffnung scheint kleiner geworden zu sein. Bei Ca-A nutzen die Ca2+-Ionen diesen Platz nicht. Es steht die volle Ringöffnung zur Verfügung. Die verfügbare Ringöffnung in Ångström gibt den Molekularsieben (MS) ihren Namen: MS 5A (Calcium-Form), MS 4A (Natrium-Form), MS 3A (Kalium-Form).
| Typ | Adsorbierte (=aufgenommene) Stoffe | Anwendungen |
|---|---|---|
| 3A | H2O, NH3 | Trocknung von Methanol, Ethanol und Gasen (z. B. H2) |
| 4A | CO2, H2S, Ethen, Ethan (plus in der Tabelle weiter oben genannte Verbindungen) | Standard für die Trocknung polarer und unpolarer Lösemittel, Trocknung gesättigter, gasförmiger Kohlenwasserstoffen |
| 5A | n-Alkane, n-Propanol, n-Butanol (plus in der Tabelle weiter oben genannte Verbindungen) | Sorption von Alkanthiolen und H2S aus Erdgasen, Abtrennung von n-Alkanen in Aromaten und iso-Alkanen. |
Biozid-Depot
Biozid-Depot Silber-Zeolith A: Durch Ionentausch mit Ag+ lassen sich leicht Silberionen in den Zeolith einlagern. Silber wird sehr bevorzugt eingefügt. Bei der Verwendung als Zusatzstoff in Oberflächenbeschichtungen wird Silber in niedriger Dosierung freigesetzt. Silber-Ionen haben biozide Eigenschaften (siehe Oligodynamie).
Weblinks
- The International Zeolite Association (IZA): Strukturdaten für Zeolithe
- Schulexperiment: Ionenaustausch durch Zeolith A (Memento vom 17. Juni 2008 im Internet Archive)
Einzelnachweise
- Eintrag zu ZEOLITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Datenblatt Zeolith A (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Zeolith in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Dezember 2012. (JavaScript erforderlich)