Polyphosphate
Polyphosphate sind Kondensationsprodukte von Salzen der ortho-Phosphorsäure (H3PO4) mit der allgemeinen Summenformel M′n+2PnO3n+1 und der Struktur
- M′–O–[P(OM′)(O)–O]n–M′
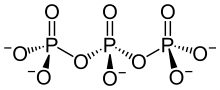
(M′ = einwertiges Metall).
Zu den Polyphosphaten werden sehr häufig auch die kurzkettigen (also eigentlich oligo-) Phosphate gezählt. Cyclische Polymere werden als Metaphosphate bezeichnet. Der Polymerisationsgrad kann mehrere Tausend betragen.
Beispiele
mit n = 3: Adenosintriphosphat (ATP), Pentanatriumtriphosphat Na5P3O10
mit n = 15 bis 20: (NaPO3)n; trägt häufig den sachlich falschen Namen Natriumhexametaphosphat.
mit n = Hunderte bis Tausende: Volutin (stabilisiert mit Ca2+, Mg2+) in Prokaryoten, sowie in Acidocalcisomen in Einzeller-Eukaryoten.[1][2]
Beispiele für hochmolekulare unverzweigte Polyphosphate der allgemeinen Formel Na2H2PnO3n+1 sind das Grahamsche Salz, das Madrellsche Salz und das Kurrolsche Salz. Das Grahamsche Salz wird beim Erhitzen von Natriumdihydrogenphosphat auf eine Temperatur über 600 °C und anschließendem Abschrecken der Schmelze als klar durchsichtige, hygroskopische, glasige Masse gebildet. Bei 580 °C geht es in das Kurrolsche Salz über. Dieses entsteht auch, wenn man Natriumdihydrogenphosphat auf über 600 °C erhitzt und die Schmelze anschließend langsam abkühlen lässt. Beim Erhitzen von Natriumdihydrogenphosphat auf 250 °C oder durch Tempern von Kurrolschem Salz bei 380 °C erhält man das Madrellsche Salz als kristallines lineares Polyphosphat.[3] Die Struktur des Maddrellschen Salzes besteht aus linear schraubenförmig angeordneten PO4 Tetraedern[4] Der Name des Maddrellschen Salzes leitet sich von Robert Maddrell, der langkettige Polyphosphater 1886 beschrieben hat, ab.[5]
Verwendung
(NaPO3)15–20 war ehemals Hauptbestandteil (neben Metaphospaten) von Calgon™, einem Produkt zur Wasserenthärtung für Haushaltsgeräte. Diese Chemikalie wird auch als Hexametaphosphat bezeichnet. Die Silbe "Hexa" lässt sechs Untereinheiten vermuten, was sich jedoch weder in der Summenformel noch in der Struktur des Moleküls wiederfindet.
Polyphosphate werden in der Lebensmitteltechnik als Komplexbildner, Säurepuffer, Schmelzsalze, Festigungsmittel und Stabilisatoren eingesetzt.
Natrium-, Kalium-, Natriumcalcium- und Calcium-Polyphosphat sind in der EU als Lebensmittelzusatzstoff der Nummer E 452 für bestimmte Lebensmittel mit jeweils unterschiedlichen Höchstmengenbeschränkungen zugelassen. Nach der Zusatzstoff-Zulassungsverordnung sind dies – für die meisten zugelassenen Phosphate weitgehend einheitliche – einzelne Festlegungen für eine breite Palette mit zahlreichen unterschiedlichen Lebensmittelsorten. Die zugelassenen Höchstmengen variieren von 0,5 über meist um 5 bis hin zu 50 Gramm pro Kilogramm (in Getränkeweißer für Automaten) oder auch dem Fehlen einer festen Beschränkung (quantum satis – nach Bedarf, bei Nahrungsergänzungsmitteln). Phosphate stehen im Verdacht Hyperaktivität, allergische Reaktionen und Osteoporose auszulösen. Es wurde eine erlaubte Tagesdosis von 70 Milligramm pro Kilogramm Körpergewicht für die Gesamtmenge aufgenommener Phosphorsäure und Phosphate insgesamt festgelegt.
Biologische Funktionen
Alle eukaryotischen und prokaryotischen Zellen enthalten Polyphosphate. Bei Bakterien und Hefen dienen die Polymere der Energiespeicherung und sind in Acidocalcisomen gespeichert. Thrombozyten enthalten homologe Polyphosphat-speichernde Strukturen sogenannte dichte Granula (dense granules), die Polyphosphate-reich sind. Die Aktivierung von Thrombozyten führt zur Sekretion der Polymere, die dann über eine Aktivierung des Blutgerinnungsfaktors XII (Hageman-Faktor, FXII) die Bildung von Fibrin und die Freisetzung des Entzündungsmediators Bradykinin starten und so prokoagulant und proinflammatorisch wirken.
Eigenschaften
Polyphosphatmoleküle sind labil. Eine Hydrolyse wird durch Temperaturerhöhungen (auf 60–70 °C), eine Absenkung des pH-Wertes (auf pH 3,5–4), Anwesenheit von Kationen beziehungsweise durch Heraufsetzung der Ionenstärke des Mediums in dem sie sich befinden gefördert.
Literatur
- Müller et al., Platelet Polyphosphates Are Proinflammatory and Procoagulant Mediators In Vivo, Cell 139(6):1143–56; doi:10.1016/j.cell.2009.11.001.
- N. J. Mutch: Polyphosphate as a haemostatic modulator. In: Biochemical Society transactions. Band 44, Nummer 1, Februar 2016, S. 18–24, doi:10.1042/BST20150207, PMID 26862183.
- P. R. Angelova, A. Y. Baev, A. V. Berezhnov, A. Y. Abramov: Role of inorganic polyphosphate in mammalian cells: from signal transduction and mitochondrial metabolism to cell death. In: Biochemical Society transactions. Band 44, Nummer 1, Februar 2016, S. 40–45, doi:10.1042/BST20150223, PMID 26862186.
- N. Lander, C. Cordeiro, G. Huang, R. Docampo: Polyphosphate and acidocalcisomes. In: Biochemical Society transactions. Band 44, Nummer 1, Februar 2016, S. 1–6, doi:10.1042/BST20150193, PMID 26862180.
Einzelnachweise
- Joseph W. Lengeler, G. Drews, Hans Günter Schlegel: Biology of the prokaryotes. Thieme, Stuttgart 1999, ISBN 3-13-108411-1, S. 156.
- Docampo R, Ulrich P, Moreno SN: Evolution of acidocalcisomes and their role in polyphosphate storage and osmoregulation in eukaryotic microbes. In: Philosophical Transactions of the Royal Society London, B, Biological Sciences. 365, Nr. 1541, März 2010, S. 775–84. doi:10.1098/rstb.2009.0179. PMID 20124344.
- Nils Wiberg: Holleman-Wiberg Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter & Co, Berlin, New York 2007, ISBN 978-3-11-017770-1, S. 807.
- Acta Crist. (1963). 16, 428 Zur Struktur des Maddrellschen Salzes von K.H. Jost Institut für anorganische Chemie des Instituts der Wissenschaften, Berlin, Adlershof, Deutschland, abgerufen http://scripts.iucr.org/cgi-bin/paper?S0365110X63001109 Aufruf 2021-01-14
- Memoirs and Proceedings of the Chemical Society of London for 1845–1848 by Chemical Society (Great Britain) S. 273–280 Artikel Dec. 7 1886 CLXXX Metaphosphates by Robert Maddrell Esq. abgerufen über https://play.google.com/books/reader?id=yrFJAQAAMAAJ&hl=de&pg=GBS.PA7