Kaliumdihydrogenphosphat
Kaliumdihydrogenphosphat ist ein farb- und geruchloses Kaliumsalz der Phosphorsäure. Es ist zusammengesetzt aus einem Kalium-Kation (K+) und einem Dihydrogenphosphat-Anion (H2PO4−). Es gehört damit zu den Dihydrogenphosphaten.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
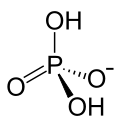 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kaliumdihydrogenphosphat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | KH2PO4 | |||||||||||||||||||||
| Kurzbeschreibung |
geruch- und farblose Kristalle[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 136,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,34 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser: 222 g·l−1 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften

Chemische Eigenschaften
Kaliumdihydrogenphosphat reagiert in Wasser sauer: pH 4,4 bei einer 5%igen Lösung. Wasserfreies Kaliumdihydrogenphosphat ist hygroskopisch.
Verwendung

Kaliumdihydrogenphosphat findet, vor allem in der Biochemie und verwandten Naturwissenschaften, Verwendung zur Herstellung von Pufferlösungen. Oft wird es dabei gemeinsam mit Dikaliumhydrogenphosphat eingesetzt, welches im Gegensatz zu Kaliumdihydrogenphosphat basisch reagiert. Das zugehörige basische Phosphat ist Kaliumphosphat. Durch Kombinationen der drei Salze gelangt man zu wässrigen Phosphatlösungen mit definiertem pH-Wert. Die Kaliumhydrogenphosphate können durch die entsprechenden Natriumhydrogenphosphate substituiert werden, falls Kaliumionen nicht erwünscht sind.
Kaliumdihydrogenphosphat wird in der Lebensmitteltechnik als Säureregulator eingesetzt. Es ist zusammen mit dem sekundären Dikaliumphosphat (K2HPO4) und tertiären Kaliumphosphat (K3PO4) in der EU als Lebensmittelzusatzstoff unter der gemeinsamen Nummer E 340 („Kaliumphosphate“) für bestimmte Lebensmittel mit jeweils unterschiedlichen Höchstmengenbeschränkungen zugelassen. Nach der Zusatzstoff-Zulassungsverordnung sind dies – für die meisten zugelassenen Phosphate weitgehend einheitliche – einzelne Festlegungen für eine breite Palette mit zahlreichen unterschiedlichen Lebensmittelsorten. Die zugelassenen Höchstmengen variieren von 0,5 bis hin zu 50 Gramm pro Kilogramm (in Kaffeeweißer für Automaten) oder auch dem Fehlen einer festen Beschränkung (quantum satis – nach Bedarf, bei Nahrungsergänzungsmitteln und teils bei Kaugummis). Phosphorsäure und ihre Salze stehen im Verdacht Hyperaktivität, allergische Reaktionen und Osteoporose auszulösen. Es wurde eine erlaubte Tagesdosis von 70 Milligramm pro Kilogramm Körpergewicht für die Gesamtmenge aufgenommener Phosphorsäure und Phosphate festgelegt.
Weiterhin wird Kaliumdihydrogenphosphat als Düngemittel eingesetzt.
In der nichtlinearen Optik werden in bestimmten Winkeln geschnittene Kaliumdihydrogenphosphat-Kristall-Platten zur Frequenzverdopplung verwendet. Auf dem Wege der parametrischen Fluoreszenz ist auch Frequenzhalbierung möglich. Für die Versuche zur Entwicklung der Laser-gezündeten Trägheitsfusion in der National Ignition Facility wurden mehrere Kaliumdihydrogenphosphat-Kristalle mit jeweils 318 kg Masse pro Kristall gezüchtet.
Nachweis
Kalium-Kation
Kaliumdihydrogenphosphat lässt sich wie andere Kaliumsalze über die violette Flammenfärbung nachweisen.
Sehr spezifisch, wenn auch nicht sehr empfindlich lässt sich Kalium mit Perchlorsäure nachweisen. Dabei fällt schwerlösliches Kaliumperchlorat aus.
Dihydrogenphosphat-Anion
Gibt man Ammoniumheptamolybdatlösung zu einer salpetersauren, phosphathaltigen Lösung, so fällt gelbes Ammoniummolybdatophosphat aus.
Arsensäure wirkt bei diesem Nachweis störend, da sie teilweise, analog zum Phosphat, als Molybdoarsenat ausgefällt wird.
Wird die Lösung zunächst neutralisiert, ergeben sich weitere Möglichkeiten für Nachweise:
Mit Silbernitrat bildet sich ein gelber Niederschlag von Silberphosphat, der sich in schwachen Säuren löst.
Bei Zugabe von Bariumchlorid fällt weißes Bariumhydrogenphosphat aus, das sich leicht in Essigsäure löst.
Literatur
- Gerhart Jander, Ewald Blasius et al.: Einführung in das anorganisch-chemische Praktikum. 14. neu bearbeitete Auflage. Hirzel, Stuttgart, 1995. ISBN 3-7776-0672-3
Quellen
- Eintrag zu E 340: Potassium phosphates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 1. Juli 2020.
- Eintrag zu POTASSIUM PHOSPHATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Juli 2020.
- Eintrag zu Kaliumdihydrogenphosphat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)