Neptunium(VI)-fluorid
Neptunium(VI)-fluorid (NpF6), meistens Neptuniumhexafluorid genannt, ist eine chemische Verbindung aus den Elementen Neptunium und Fluor. Es ist ein orangefarbener kristalliner Feststoff, welcher leicht flüchtig, radioaktiv und korrosiv ist. Neptuniumhexafluorid ist beständig in trockener Luft, reagiert jedoch sehr heftig mit Wasser. In den meisten Fällen wird es aus Neptunium(IV)-fluorid (NpF4) durch Umsetzung mit elementarem Fluor (F2) gewonnen.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
Pnma (Nr. 62) | |||||||||
| Gitterparameter |
a = 990,9 pm | |||||||||
| Allgemeines | ||||||||||
| Name | Neptunium(VI)-fluorid | |||||||||
| Andere Namen |
Neptuniumhexafluorid | |||||||||
| Summenformel | NpF6 | |||||||||
| Kurzbeschreibung |
orangefarbener kristalliner Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 351,04 g·mol−1 (237Np) | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
55,18 °C[1] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||

Radioaktiv | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−1970,0 ± 20,0 kJ·mol−1[3] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Bei Normaldruck schmilzt es bei 54,4 °C und siedet bei 55,18 °C. Es ist die einzige Neptuniumverbindung, die sich leicht in die Gasphase überführen lässt. Aufgrund dieser Eigenschaften ist eine Trennung von Neptunium aus abgebrannten Brennelementen möglich. Dadurch wuchs schnell das Interesse an seiner Darstellung und an der genauen Untersuchung seiner Eigenschaften.
Darstellung
Neptuniumhexafluorid wurde erstmals im Jahre 1943 von dem amerikanischen Chemiker Alan E. Florin dargestellt. Er erhitzte eine Probe von Neptunium(III)-fluorid in einem Nickeltiegel in einem Fluorgasstrom und kondensierte das flüchtige Neptuniumhexafluorid in einer dünnwandigen Glaskapillare.[4][5] Die Darstellung von Neptuniumhexafluorid sowohl aus Neptunium(III)-fluorid wie auch Neptunium(IV)-fluorid wurde von Glenn T. Seaborg und Harrison S. Brown am 17. Oktober 1947 in Form einer Patentschrift publiziert und eingereicht.[6]
Standardmethode
Die gängige Methode zur Darstellung von Neptuniumhexafluorid ist die Umsetzung von Neptuniumtetrafluorid (NpF4) mit elementarem Fluor (F2) bei 500 °C.[7]
Uranhexafluorid (UF6) entsteht relativ zügig schon bei 300 °C aus Urantetrafluorid (UF4) und Fluor (F2), während Plutoniumhexafluorid (PuF6) erst bei 750 °C aus Plutoniumtetrafluorid (PuF4) und F2 entsteht.[7] Auf diesem Wege können Uran, Neptunium und Plutonium effektiv voneinander getrennt werden.
Mit anderen Ausgangsstoffen
Neptuniumhexafluorid wurde auch durch Fluorierung von Neptunium(III)-fluorid oder Neptunium(IV)-oxid dargestellt.[5]
Mit anderen Fluorverbindungen
Die Darstellung gelingt auch mittels starker Fluorierungsreagenzien wie Bromtrifluorid (BrF3) oder Brompentafluorid (BrF5). Diese Reaktionen können gezielt zur Trennung von Plutonium herangezogen werden, da Plutoniumtetrafluorid (PuF4) keine entsprechenden Reaktionen eingeht.[8][9]
Neptuniumdioxid und -tetrafluorid werden praktisch vollständig durch Disauerstoffdifluorid (O2F2) zum flüchtigen Neptuniumhexafluorid umgewandelt. Dies gelingt sowohl in Gas-Feststoff-Reaktionen bei moderaten Temperaturen als auch in flüssigem wasserfreien Fluorwasserstoff bei −78 °C:[10]
Diese Reaktionstemperaturen stehen in deutlichem Gegensatz zu den ansonsten höheren Temperaturen von über 200 °C, die zuvor zur Darstellung von NpF6 bei Verwendung von elementarem Fluor oder Halogenfluoriden benötigt werden.[10] Bei dieser Reaktion wurde Neptunyl(VI)-fluorid (NpO2F2) durch Raman-Spektroskopie als wesentliches Zwischenprodukt bei der Reaktion mit Neptuniumdioxid identifiziert. Eine direkte Reaktion von NpF4 mit flüssigem O2F2 führt dagegen zu einer heftigen Zersetzung des O2F2 mit geringer bis keiner Umsetzung zu NpF6.[10]
Eigenschaften
Physikalische Eigenschaften
Parameter für die Antoine-Gleichung[11]
nach lg p = A−B·T + C·lg(T); für 0–55,1 °CA B C 18,48130 2892,0 −2,6990 nach lg p = A−B·T + C·lg(T); für 55,1–76,82 °C A B C 0,01023 1191,1 2,5825
Neptuniumhexafluorid bildet orangefarbene orthorhombische Kristalle. Sie schmelzen bei Normaldruck (1013,25 hPa) bei 54,4 °C. Der Siedepunkt liegt bei 55,18 °C.
Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht stehen, liegt bei einer Temperatur von 55,10 °C bei einem Druck von 1010 hPa (758 Torr).[1] Dies bedeutet, dass unterhalb dieses Drucks – der nur geringfügig unterhalb des Normaldrucks liegt – festes Neptuniumhexafluorid beim Erwärmen durch Sublimation direkt in den gasförmigen Zustand übergeht.
Die Flüchtigkeit von NpF6 ist ähnlich derjenigen von Uranhexafluorid (UF6) und Plutoniumhexafluorid (PuF6); sie gehören zusammen zu den drei bekannten Hexafluoriden der Actinoidenelemente. Die Bildungsentropie (S0m) beträgt für NpF6 229,1 ± 0,5 J·K−1·mol−1.[3] Festes NpF6 ist paramagnetisch;[12] die molare magnetische Suszeptibilität χmol beträgt 165 · 10−6 cm3·mol−1.[13]
Kristall- und Molekülstruktur
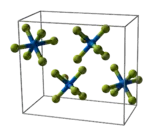
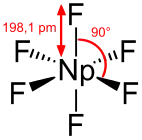
Neptuniumhexafluorid ist eine kovalente Verbindung und kein Salz. Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma (Nr. 62) mit den Gitterparametern a = 990,9 pm, b = 899,7 pm und c = 520,2 pm mit vier Formeleinheiten pro Elementarzelle.[14] Im gasförmigen Zustand besteht es aus regulär oktaedrischen Molekülen (Oh) mit einheitlicher Np–F-Bindungslänge von 198,1 pm.[15]
Spektroskopische Eigenschaften
Neptuniumhexafluorid besitzt sechs Grundschwingungen. ν1, ν2 und ν3 sind Streckschwingungen und ν4, ν5 und ν6 sind Biegeschwingungen. Davon sind ν1, ν2 und ν5 Raman-aktiv,[16] ν3 und ν4 IR-aktiv, ν6 ist IR- und Raman-inaktiv.[17][18][19][20]
Grundschwingung ν1 ν2 ν3 ν4 ν5 ν6 Termsymbol A1g Eg F1u F1u F2g F2u Wellenzahl (cm−1)[14] 654 535 624 198,6 208 (164) IR-aktiv − − + + − − Raman-aktiv + + − − + −
Chemische Eigenschaften
Neptuniumhexafluorid ist beständig in trockener Luft. Es reagiert hingegen sehr heftig mit Wasser (schon durch Luftfeuchtigkeit), wobei das wasserlösliche Neptunyl(VI)-fluorid (NpO2F2) und Fluorwasserstoff (HF) entstehen.
Es kann unbegrenzt bei Raumtemperatur in Quarz- oder PYREX-Ampullen aufbewahrt werden, wenn sichergestellt ist, dass keine Spuren von Feuchtigkeit vorhanden sind, das Glas selbst von allen Gaseinschlüssen frei ist und eventuell vorhandener Fluorwasserstoff (HF) restlos entfernt wurde.[7]
NpF6 und PuF6 sind lichtempfindlich und zersetzen sich zu den Tetrafluoriden und Fluor.[7]
NpF6 bildet mit Alkalifluoriden Fluorokomplexe. Mit Caesiumfluorid (CsF) bildet es bei 25 °C das CsNpF6,[21] mit Natriumfluorid (NaF) reagiert es reversibel zum Na3NpF8.[22] In beiden Fällen erfolgt eine Reduktion vom sechswertigen Neptunium zum fünfwertigen.
In Gegenwart von Chlortrifluorid (ClF3) als Lösungsmittel und bei tieferen Temperaturen gibt es Anzeichen für die Bildung eines instabilen Np(VI)-Komplexes.[21]
Die Hydrolyse von Neptuniumhexafluorid in fast wasserfreier Fluorwasserstoff-Lösung führt zum Oxid-Fluorid NpOF4. Es hat die gleiche Struktur wie die trigonale Form des UOF4. Eine Oxidation des NpOF4 durch Kryptondifluorid (KrF2) in wasserfreiem HF zur maximal möglichen Oxidationsstufe Np(VII) erfolgt jedoch nicht.
Neptuniumhexafluorid reagiert mit Kohlenstoffmonoxid (CO) und Licht zu einem feinen weißen Pulver, welches aus Neptuniumpentafluorid (NpF5) und weiterem, nicht identifiziertem Material besteht.[23]
Verwendung
Bei der Bestrahlung von Brennelementen in Kernkraftwerken entstehen neben den Spaltprodukten auch Transurane, darunter Neptunium und Plutonium. Die Trennung von Uran, Neptunium und Plutonium ist für die Wiederaufarbeitung erforderlich. Neptuniumhexafluorid spielt aufgrund seiner Flüchtigkeit vor allem eine Rolle bei der Abtrennung von Neptunium sowohl von Uran als auch von Plutonium.
Zur Abtrennung des Urans (95 % der Gesamtmasse) aus abgebrannten Brennelementen wurde vorgeschlagen, das Material fein zu zerkleinern und mit elementarem Fluor zu behandeln („direkte Fluorierung“). Die dabei entstehenden flüchtigen Fluoride (hauptsächlich UF6 und geringe Mengen NpF6) lassen sich leicht von den nichtflüchtigen Fluoriden, z. B. Plutonium(IV)-fluorid (PuF4), Americium(III)-fluorid (AmF3), Curium(III)-fluorid (CmF3), sowie den Fluoriden der meisten Spaltprodukte abtrennen.[24]
Aus Gemischen von Uran- und Neptuniumhexafluorid wird mit pelletiertem Cobalt(II)-fluorid selektiv das Neptuniumhexafluorid zum Neptuniumtetrafluorid reduziert, bei Temperaturen im Bereich von 93 bis 204 °C. Das im Gemisch vorhandene Uranhexafluorid geht diese Reaktion nicht ein.[25] Bei Verwendung von Magnesiumfluorid bei 100 °C wird Neptuniumhexafluorid zu 60–70 % absorbiert, während Uranhexafluorid keine Reaktion eingeht.[26]
Sicherheitshinweise
Neptuniumhexafluorid bildet beim Kontakt mit Feuchtigkeit Flusssäure, die auf der Haut und den Schleimhäuten der Atemwege Verätzungen hervorruft und bei längerer Exposition zu Pneumonitis und Lungenödemen und damit zum Tod führen kann. Es ist außerdem wie alle Neptuniumverbindungen radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Neptuniums abhängig. Das zumeist in Frage kommende 237Np hat eine Halbwertszeit von 2,144 Millionen Jahren und ist ein α-Strahler. 235Np und 236Np haben Halbwertszeiten von 396,1 Tagen bzw. 154.000 Jahren und sind daher deutlich aktiver; beide zerfallen in erster Linie durch Elektroneneinfang.[27]
Einstufungen nach der GHS-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen, die eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielt.
Literatur
- Zenko Yoshida, Stephen G. Johnson, Takaumi Kimura, John R. Krsul: Neptunium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 699–812 (doi:10.1007/1-4020-3598-5_6; Volltext (PDF)).
- C. Keller: Die Chemie des Neptuniums, in: Fortschr. chem. Forsch., 1969/70, 13/1, S. 1–124 (doi:10.1007/BFb0051170).
- G. L. Goodman, Mark Fred: Electronic Structure of Neptunium Hexafluoride, in: J. Chem. Phys., 1959, 30, S. 849–850 (doi:10.1063/1.1730060; Abstract).
- B. Frlec: The density of liquid neptunium hexafluoride, in: Journal of Inorganic and Nuclear Chemistry, 1967, 29 (7), S. 1804–1805 (doi:10.1016/0022-1902(67)80227-6; Abstract).
Einzelnachweise
- C. Keller: Die Chemie des Neptuniums, in: Fortschr. chem. Forsch., 1969/70, 13/1, S. 1–124, hier: S. 71–75.
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Zenko Yoshida, Stephen G. Johnson, Takaumi Kimura, John R. Krsul: Neptunium, S. 736 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. E. Florin, Report MUC-GTS-2165 (1943).
- Sherman Fried, Norman Davidson: The Preparation of Solid Neptunium Compounds, in: J. Am. Chem. Soc., 1948, 70 (11), S. 3539–3547 (doi:10.1021/ja01191a003).
- Patent US2982604A: Preparation of neptunium hexafluoride. Angemeldet am 17. Oktober 1947, veröffentlicht am 2. Mai 1961, Erfinder: Glenn T. Seaborg, Harrison S. Brown.
- John G. Malm, Bernard Weinstock, E. Eugene Weaver: The Preparation and Properties of NpF6; a Comparison with PuF6, in: J. Phys. Chem., 1958, 62 (12), S. 1506–1508 (doi:10.1021/j150570a009).
- L. E. Trevorrow, T. J. Gerding, M. J. Steindler: Laboratory Investigations in Support of Fluid-bed Fluoride Volatility Processes, Part XVII, The Fluorination of Neptunium(IV) fluoride and Neptunium(IV) oxide (Argonne National Laboratory Report ANL-7385); 1. Januar 1968 (doi:10.2172/4492135; Abstract; PDF).
- L. E. Trevorrow, T. J. Gerding, M. J. Steindler: The Fluorination of Neptunium(IV) fluoride and Neptunium(IV) oxide, in: Journal of Inorganic and Nuclear Chemistry, 1968, 30 (10), S. 2671–2677 (doi:10.1016/0022-1902(68)80394-X).
- P. Gary Eller, Larned B. Asprey, Scott A. Kinkead, Basil I. Swanson, Richard J. Kissane: Reactions of Dioxygen Difluoride with Neptunium Oxides and Fluorides, in: Journal of Alloys and Compounds, 1998, 269 (1–2), S. 63–66 (doi:10.1016/S0925-8388(98)00005-X).
- Zenko Yoshida, Stephen G. Johnson, Takaumi Kimura, John R. Krsul: Neptunium, S. 733 (eingeschränkte Vorschau in der Google-Buchsuche).
- Clyde A. Hutchison, Bernard Weinstock: Paramagnetic Resonance Absorption in Neptunium Hexafluoride, in: J. Chem. Phys., 1960, 32, S. 56–61 (doi:10.1063/1.1700947; Abstract).
- Clyde A. Hutchison, Tung Tsang, Bernard Weinstock: Magnetic Susceptibility of Neptunium Hexafluoride in Uranium Hexafluoride, in: J. Chem. Phys., 1962, 37, S. 555–562 (doi:10.1063/1.1701373; Abstract).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 108–114.
- Masao Kimura, Werner Schomaker, Darwin W. Smith, Bernard Weinstock: Electron-Diffraction Investigation of the Hexafluorides of Tungsten, Osmium, Iridium, Uranium, Neptunium, and Plutonium, in: J. Chem. Phys., 1968, 48 (8), S. 4001–4012 (doi:10.1063/1.1669727).
- Earl L. Grasner, Boris Frlec: Raman Spectrum of Neptunium Hexafluoride, in: J. Chem. Phys., 1968, 49 (11), S. 5135–5137 (doi:10.1063/1.1670010; Abstract).
- B. Weinstock, E. E. Weaver, J. G. Malm: Vapour-Pressures of NpF6 and PuF6; Thermodynamic Calculations with UF6, NpF6 and PuF6, in: Journal of Inorganic and Nuclear Chemistry, 1959, 11 (2), S. 104–114 (doi:10.1016/0022-1902(59)80054-3).
- K. C. Kim, R. N. Mulford: Vibrational Properties of Actinide (U, Np, Pu, Am) Hexafluoride Molecules, in: Journal of Molecular Structure: THEOCHEM, 1990, 207 (3–4), S. 293–299 (doi:10.1016/0166-1280(90)85031-H).
- J. C. Eisenstein, M. H. L. Pryce: Theory of the Magnetic and Spectroscopic Properties of Neptunium Hexafluoride, in: Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences, (5. April 1960), Vol. 255, Nr. 1281, S. 181–198 (doi:10.1098/rspa.1960.0061; Abstract; Abstract).
- M. J. Steindler, T. J. Gerding: The absorption spectrum of neptunium hexafluoride, in: Spectrochimica Acta, 1966, 22 (6), S. 1197–1200 (doi:10.1016/0371-1951(66)80212-6; Abstract).
- R. D. Peacock, Norman Edelstein: Some Reactions of Neptunium Hexafluoride, in: Journal of Inorganic and Nuclear Chemistry, 1976, 38 (4), S. 771–773 (doi:10.1016/0022-1902(76)80353-3).
- LeVerne E. Trevorrow, T. J. Gerding, Martin J. Steindler: The Reaction of Neptunium Hexafluoride with Sodium Fluoride, in: Inorg. Chem., 1968, 7 (11), S. 2226–2229 (doi:10.1021/ic50069a010).
- Zenko Yoshida, Stephen G. Johnson, Takaumi Kimura, John R. Krsul: Neptunium, S. 732 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jan Uhlíř, Martin Marečeka: Fluoride Volatility Method for Reprocessing of LWR and FR Fuels, in: Journal of Fluorine Chemistry, 2009, 130 (1), S. 89–93 (doi:10.1016/j.jfluchem.2008.07.002).
- Patent US3615267A: Separation of neptunium from uranium hexafluoride containing the same. Angemeldet am 11. März 1969, veröffentlicht am 26. Oktober 1971, Anmelder: Atomic Energy Commission, Erfinder: Waldo R. Golliher et al.
- Tsuyoshi Nakajima, Henri Groult (Hrsg.): Fluorinated Materials for Energy Conversion, Elsevier, Amsterdam 2005, S. 559 (eingeschränkte Vorschau in der Google-Buchsuche).
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128, hier: S. 117–118. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).