Disauerstoffdifluorid
Disauerstoffdifluorid ist eine chemische Verbindung aus der Gruppe der Fluoride, genauer der Sauerstofffluoride.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Disauerstoffdifluorid | ||||||||||||
| Andere Namen |
Fluorperoxid | ||||||||||||
| Summenformel | O2F2 | ||||||||||||
| Kurzbeschreibung |
braunes Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 70,0 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−57 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Disauerstoffdifluorid kann durch Reaktion von Sauerstoff und Fluor mithilfe einer elektrischen Entladung gewonnen werden.[1] Die erste Synthese geht auf Otto Ruff aus dem Jahr 1933 zurück.[4]
Eigenschaften
Disauerstoffdifluorid ist als Gas braun, als Flüssigkeit kirschrot und im festen Zustand orangegelb.[1] Die Struktur des Feststoffs entspricht der von Wasserstoffperoxid.[5][2]
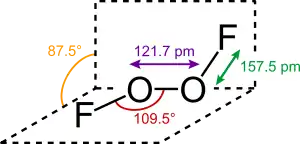
Es ist instabil (Zersetzung ab −95 °C)[6] und ein starkes Oxidations- und Fluoridierungsmittel.[7] So oxidiert es Chlor zu Chlorfluorid und Chlortrifluorid, sowie Schwefelwasserstoff zu Schwefelhexafluorid.[8]
Verwendung
Disauerstoffdifluorid dient als Fluorierungsmittel, um Neptunium- bzw. Plutoniumverbindungen bei niedrigen Temperaturen zu den Hexafluoriden umzusetzen.
Neptuniumdioxid und -tetrafluorid werden praktisch vollständig durch Disauerstoffdifluorid (O2F2) zum flüchtigen Neptuniumhexafluorid umgewandelt. Dies gelingt sowohl in Gas-Feststoff-Reaktionen bei moderaten Temperaturen als auch in flüssigem wasserfreien Fluorwasserstoff bei −78 °C:[9]
Einzelnachweise
- G. Brauer; Handbuch der präparativen anorganischen Chemie, F. Enke Verlag 1978, ISBN 978-3-432-26081-5.
- Eintrag zu Sauerstoff-Fluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2017.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Otto Ruff, W. Menzel: "Neue Sauerstofffluoride: O2F2 und OF", Zeitschrift für anorganische und allgemeine Chemie, 1933, 211 (1–2), S. 204–208 (doi:10.1002/zaac.19332110122).
- A. J. Bridgeman, J. Rothery: "Bonding in mixed halogen and hydrogen peroxides", Journal of the Chemical Society, Dalton Transactions, 1999, S. 4077–4082 (doi:10.1039/a904968a).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- A. G. Streng: The Chemical Properties of Dioxygen Difluoride. In: Journal of the American Chemical Society. 85, Nr. 10, 1963, S. 1380–1385. doi:10.1021/ja00893a004.
- Ralf Steudel: Chemie der Nichtmetalle; ISBN 978-3-11-012322-7.
- P. Gary Eller, Larned B. Asprey, Scott A. Kinkead, Basil I. Swanson, Richard J. Kissane: „Reactions of Dioxygen Difluoride with Neptunium Oxides and Fluorides“, in: Journal of Alloys and Compounds, 1998, 269 (1–2), S. 63–66 (doi:10.1016/S0925-8388(98)00005-X).
Weblinks
- Eintrag zu Perfluoroperoxide. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD
- Things I Won't Work With: Dioxygen Difluoride – Blogbeitrag (englisch) des Chemikers Derek Lowe über die verheerenden Eigenschaften von O2F2