Monarchfalter
Der Monarchfalter (Danaus plexippus) oder Amerikanische Monarch ist ein auffällig orange und schwarz gezeichneter Schmetterling (Tagfalter) aus der Familie der Edelfalter (Nymphalidae). Er ist in Amerika weit verbreitet und hat sich im 18. Jahrhundert über den Südpazifik bis nach Australien ausgebreitet. Der Monarchfalter ist der am besten erforschte Schmetterling Nordamerikas und ein berühmter Wanderfalter. Einzelne Tiere legen bei Wanderungen im Herbst in Nordamerika bis zu 3600 Kilometer zurück. Die östliche Population in Nordamerika überwintert mit mehreren 100 Millionen Tieren auf wenigen Hektar in der mexikanischen Sierra Nevada.
| Monarchfalter | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Monarchfalter (Danaus plexippus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Danaus plexippus | ||||||||||||
| (Linnaeus, 1758) |
In den Jahren ab etwa 2010 brachen die überwinternden Bestände drastisch ein, die in Anspruch genommene Fläche betrug ebenfalls nur noch einen Bruchteil; 2013/14 verzögerte sich die Ankunft der Falter in Mexiko zudem um drei Wochen.[1]
Eine deutlich kleinere westliche Population überwintert entlang der Pazifikküste in Kalifornien.
Merkmale
Falter


Die Monarchfalter haben Flügel mit oranger Grundfarbe und schwarz-weißer Zeichnung. Die Adern und Ränder der Flügel sind schwarz. An den schwarzen Flügelspitzen haben sie zwei Reihen weißer bis cremefarbener Punkte. Auf den schwarzen Binden am Flügelaußenrand verlaufen zwei Reihen kleiner weißer Punkte. Die Grundfarbe der Flügelunterseite ist heller, besonders auf den Hinterflügeln. Der schwarze Körper hat am Kopf und Thorax weiße Punkte und am Hinterleib drei bis vier dünne weiße Ringe. Die Größe der Falter variiert stark, die durchschnittliche Vorderflügellänge beträgt 47 bis 50 Millimeter.
 ♂
♂ ♀
♀
Die Männchen sind in der Regel kleiner als die Weibchen und haben an der zweiten Ader der Hinterflügel eine schwarze, mit Duftschuppen gefüllte Tasche, die nach dem Schlupf aus der Puppe gebildet wird. An dieser Stelle ist der Flügel und die daneben verlaufende Flügelader angeschwollen. Die Männchen haben auffällige graue Haarbüschel am Abdomen. Diese spielen bei der Paarung eine wichtige Rolle und bestehen jeweils aus etwa 400 2,1 Millimeter langen und 10 Mikrometer dicken Härchen, die aus dem letzten Drittel der ausstülpbaren Haarbüschelschäfte sprießen. Die Haarbüschel, mit nur einem Typ Haare, und die Duftschuppentaschen, ein typisches Merkmal für die Tribus Danaini, sind gegenüber anderen Arten der Gattung und der Tribus stark reduziert.[2][3]
Die weiblichen Falter haben insgesamt eine hellere Grundfarbe, wobei die Ränder entlang der Adern breiter und beide dunkler gefärbt sind. Bei der sehr seltenen Form D. plexippus f. nivosus, die autosomal rezessiv vererbt wird, sind alle Flügelbereiche gräulich-weiß, die normalerweise orange sind. Die Form wurde schon überall gesichtet (Amerika, Australien, Indonesien) und ist bis auf Hawaii sehr selten. Auf der Hawaii-Insel Oʻahu werden bis zu 10 Prozent der Falter in dieser Form angetroffen.[4]
Die Flügel und der gesamte Körper einschließlich der Beine sind bis auf die Facettenaugen mit Schuppen bedeckt. 900.000 bis 1,5 Millionen Schuppen unterschiedlicher Form, die von schmalen Schuppen unterschiedlicher Länge mit bis zu zwei Zacken bis zu ovalen Formen mit bis zu drei Zacken reichen, bedecken die Flügel. Die schmalen und langen Schuppen am Flügelrand ähneln Haaren und bilden die Flügelfransen. An Kopf und Thorax sind Schuppen unterschiedlicher Form von Haaren durchsetzt. Auf den Beinen haben alle Schuppen die gleiche längliche Form mit zwei Zacken.[5]
Ei
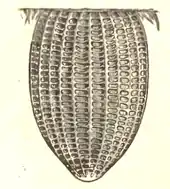
Frisch gelegte Eier sind cremig-weiß, innerhalb von drei bis vier Tagen verfärben sie sich dunkelgrau. Ein Ei wiegt im Schnitt 0,54 Milligramm, ist circa 1,2 Millimeter lang und hat einen Durchmesser von etwa 0,87 Millimeter (Durchschnittswerte gemessen an 55 Eiern). Längs der Oberfläche verlaufen etwa 22, teils verzweigte, Rippen. Quer dazu laufen etwa 32 kleinere Rippen, die mit den Längsrippen kleine Zellen bilden. An den Enden des Eis werden die durch die Rippen gebildeten Zellen unregelmäßig und immer kleiner, um schließlich oben in die Mikropyle überzugehen, durch die später die Eiraupe schlüpft.[6]
Raupe

Die Eiraupen haben einen schwarzen, glänzenden Kopf und einen hellen grau-weißen Körper. Nach der ersten Häutung nehmen die Raupen ihr typisches weiß – schwarz – gelbes Bandmuster aus Querstreifen an. Die Breite der einzelnen Farben kann je nach geografischer Region schwanken, auf den Antillen etwa sind die Raupen fast schwarz. Im zweiten Larvenstadium werden die für die Tribus Danani typischen fleischigen Fortsätze, zwei am Thorax (Segment 2) und zwei am Analsegment (Segment 11), sichtbar. Alle Larvenstadien können anhand von Merkmalen an Kopf und Metathorax unterschieden werden.
Puppe

Die Raupe verpuppt sich in einer gedrungen wirkenden Stürzpuppe, die anfangs hellgrün ist und später dunkelgrün wird. Die Haut der Puppe, die leicht transparent erscheint, erinnert an Jade. Auf der Puppe befinden sich mehrere kleine und wenige größere goldene Punkte, am Abdomen bilden die Punkte ein durchgehendes Band, das nach unten von einem schwarzen Band begleitet wird. Selten kommen gelbliche oder weißliche Formen vor, die eine Anpassung an eine andere Umgebungsfarbe sind.[7]
Mimikry und ähnliche Arten
Viele Arten der Gattung Danaus sind dem Monarchfalter ähnlich, mit einigen Arten bildet er Müllersche Mimikryringe. Müllersche und Bates’sche Mimikry sind auch zusammen mit Arten anderer Gattungen bekannt.
- Danaus erippus ist die Geschwisterart von D. plexippus und ist südlich des Amazonas in Südamerika verbreitet. Sie wurde früher als Unterart betrachtet und ist heute aufgrund genetischer Untersuchungen als Art akzeptiert. Der Falter ist dunkler als D. plexippus und hat einen weißen Fleck auf dem braunen Grund von Zelle 3 am Rand zum schwarzen Außenrandband. Dieser weiße Fleck tritt bei D. plexippus nur ganz selten auf.[8] D. erippus hat ein ähnliches Wanderverhalten wie D. plexippus, das aber nur schlecht erforscht ist. In den Monaten März bis April, dem Herbst auf der Südhalbkugel, wurden in Argentinien nordwärts gerichtete Wanderungen beobachtet und Überwinterungsquartiere sind aus der Provinz Chaco im Norden des Landes bekannt. Die geographische Breite des nordargentinischen Überwinterungsgebietes von D. erippus entspricht jener von D. plexippus auf der Nordhalbkugel.[9]
- Danaus gilippus wird im englischen als Queen (Königin) bezeichnet und ersetzt den Monarchfalter größtenteils in Florida (D. gilippus berenice) und im Südwesten der USA (D. gilippus strigosus). Im Südosten ist er bräunlicher und im Südwesten heller gefärbt. Die Art ist dem Afrikanischen Monarch (Danaus chrysippus) sehr ähnlich und kann entweder als Schwester- oder als deren Unterart in der neuen Welt betrachtet werden.[10] Die Gesamtverbreitung erstreckt sich über weite Teile Südamerikas.
- Danaus cleophile hat ein kleines Verbreitungsgebiet auf Hispaniola und Jamaika, wo er zusammen mit dem Monarchfalter vorkommt. Er unterscheidet sich vom Monarchfalter durch gelbe statt weiße Flecken in der Apikal- und Subapikalregion.
- Limenitis archippus (Cramer 1775) wird im englischen als Viceroy (Vizekönig) bezeichnet und ist ein ebenfalls manchmal giftiger Falter aus der Unterfamilie der Eisvögel (Limenitidinae) in der Familie der Edelfalter. Er ist in Nordamerika verbreitet, von der Ostküste der USA bis zu den Nordwest-Territorien Kanadas im Nordwesten, entlang dem Ostrand der Kaskadenkette und der Sierra Nevada nach Süden bis nach Zentralmexiko. Die orange Unterart Limenitis archippus archippus entwickelte im nördlichen Verbreitungsgebiet eine Signalnormierung (Müllersche Mimikry) mit Danaus plexippus. In Gebieten, wo der Monarch nur selten vorkommt, im Südwesten und Südosten (Georgia und Florida) entwickelte die braune Unterart Limenitis archippus floridensis mit Danaus gilippus berenice eine Signalnormierung.[11] L. archippus gleicht dem Monarchfalter in Größe und Farbe sehr, kann aber anhand eines zusätzlichen schwarzen Streifens in der Postdiskalregion auf dem Hinterflügel von diesem unterschieden werden.
- Danaus genutia (Cramer 1779) kommt in Südostasien, von Indien über die Philippinen bis nach Nordwestaustralien vor und bildet zusammen mit dem Monarch Müllersche Mimikry aus.[12]
.jpg.webp) Danaus gilippus berenice
Danaus gilippus berenice Limenitis archippus
Limenitis archippus Danaus genutia
Danaus genutia
Vorkommen
Lebensraum
Die typischen Lebensräume des Monarchfalters sind offene Ödland- und Ruderalflächen, auf denen die Nahrungspflanzen der Raupen im Überfluss gedeihen. Die größte Populationsdichte hat der Monarchfalter in Nordamerika im Bereich der Großen Seen, wo sehr viele Seidenpflanzen (Asclepias) wachsen. Obwohl der Falter eher ein Bewohner der Täler ist, steigt er in Guyana bis 1500 Meter und in Mittelamerika bis auf 2000 Meter.[13]
Verbreitung und Ausbreitung
Der Falter ist ursprünglich in Nordamerika und dem nördlichen Südamerika verbreitet. Die nördliche Verbreitung endet etwa am 50. Breitengrad im Süden Kanadas, das auch in etwa der nördlichen Verbreitungsgrenze der Seidenpflanzen entspricht. Die Verbreitung erstreckt sich durch die gesamten USA, Mexiko, die Karibik und Mittelamerika bis zum nördlichen Rand des Amazonas (Venezuela, Peru, Kolumbien, Ecuador einschließlich Galapagosinseln, Brasilien, Guyana, Surinam und Französisch-Guayana). Weiter südlich lebt die Art D. erippus, die früher als Unterart eingestuft wurde.
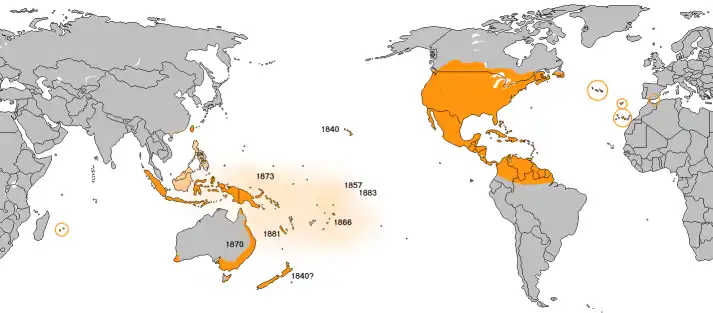
Im 18. Jahrhundert erweiterte der Falter sein Verbreitungsgebiet kontinuierlich und wurde 1840 auf Hawaii heimisch. In den folgenden drei Jahrzehnten verbreitete er sich über die Inseln des Südpazifiks (Karolinen (1857), Tahiti, Tonga (1868) und Samoa (1876)). 1870 wurde er auf der Lord-Howe-Insel gesehen, ein Jahr später auch in Australien (Queensland 1870, Melbourne 1872). In Ostaustralien ist der Monarchfalter häufig, in anderen Teilen des Kontinents und auf Tasmanien wird er gelegentlich beobachtet. Von den Inseln des Südpazifiks hat er sich nach Osten über die Salomonen, Neuguinea, Java, Borneo und Sumatra ausgebreitet.
Die ersten Sichtungen von Monarchfaltern in Neuseeland sollen 1840 stattgefunden haben, was aber erst 38 Jahre später dokumentiert wurde. Die damals angeblich gefangenen und präparierten Falter lassen sich heute nicht mehr auffinden. Damals glaubte man, dass die Falter endemisch in Neuseeland seien, da die Māori angeblich einen traditionellen Namen für die Falter haben (kâkãhu). Es wird heute jedoch vermutet, dass damit ein ähnlich aussehender Falter bezeichnet wurde. Die erste verlässliche Meldung von Monarchfaltern geht auf das Jahr 1868 zurück.[14]
Bis heute wurden in Asien und Ozeanien außerdem Neukaledonien (1881), Marquesas (1883) Fidschi, Mikronesien, Melanesien, Réunion, Polynesien, Sulawesi (1873, 1981) die Norfolkinsel, die Molukken, die Philippinen, Taiwan, das südliche China und Mauritius besiedelt, wobei er auf Borneo, den Philippinen und im südlichen China wieder verschwunden ist.[15]
Die Ausbreitung im pazifischen Raum wurde wahrscheinlich vom Menschen gefördert. Weiße Siedler haben Seidenpflanzen, besonders die Indianer-Seidenpflanze (Asclepias curassavica), auf die Inseln des Südpazifik gebracht, auf denen sie vorher nicht heimisch waren. Sie pflanzten sie in ihren Gärten an, und es gibt Berichte, dass Kissen und Matratzen mit getrockneten Seidenpflanzen gefüllt wurden. Daraus könnten einige Samen den Weg in die Natur gefunden haben. Nachdem die Nahrungspflanzen vorhanden waren, konnten die Tiere auf den Inseln überleben und sich ausbreiten. Ob die Tiere, die mehrere 1000 Kilometer weit fliegen können, sich an Bord von Schiffen befanden, oder selbst auf die Inseln flogen, ist nicht bekannt. In der Bucht von San Francisco ist es allerdings nicht unüblich, dass sich kleine Gruppen überwinternder Falter auf Schiffen versammeln. Ebenso wurde beobachtet, wie Falter auf fahrenden Schiffen landen. Die lange Diapause ermöglicht ebenfalls eine weite Verbreitung.
Inzwischen ist der Monarchfalter auch auf den Azoren, Madeira und den Kanaren heimisch. Erste Sichtungen auf den Azoren, wo die Falter „Feiticeiras“ (kleine Hexen) heißen, reichen bis 1864 (auf den Inseln Flores und Ilha do Faial) zurück. Die Falter tauchen immer wieder auf, meist nur für kurze Zeit im Jahr und sind stark abgeflogen, das heißt ausgeblichen und mit beschädigten Flügeln, was auf eine Einwanderung aus Nordamerika hindeutet. Einen nachweislichen Bruterfolg gab es erst 1999. Auf den Azoren dient die nur an wenigen Standorten und in kleiner Zahl vorkommende Art Gomphocarpus fruticosus als Nahrungspflanze, was – solange keine weiteren Pflanzen hinzukommen, wie etwa auf den Kanaren und Madeira – die Populationsgröße stark beschränkt. Das andere auf den Azoren vorkommende Seidenpflanzengewächs, Araujia sericifera, wurde bis jetzt nicht angenommen.[16] Auf den Kanaren sind die Inseln Teneriffa, Gran Canaria, La Palma, La Gomera, El Hierro, Lanzarote und Fuerteventura besiedelt. Die Raupe frisst hier hauptsächlich an Asclepias curassavica, aber zudem auch an Gomphocarpus fruticosus.[17]
In Europa war der Monarchfalter in den 1980er Jahren über mehrere Jahre hinweg im südlichen Spanien (Málaga) zusammen mit dem Afrikanischen Monarch (Danaus chrysippus) bodenständig. In den 1990er Jahren verschwand er wahrscheinlich aufgrund eines ungünstigen Klimas zusammen mit der verwandten Art. Seit 1997 ist der Monarchfalter entlang der Küste Andalusiens wieder bodenständig, oft an denselben Pflanzen wie der Afrikanische Monarch, der einige Jahre zuvor wieder bodenständig wurde.[18] Obwohl oft mehrere Eier beider Arten an einer Pflanze abgelegt werden, konnte keine Konkurrenz um die Nahrungspflanzen festgestellt werden.[7] In Portugal, Südfrankreich und Korsika tritt der Monarchfalter gelegentlich als Wanderfalter auf.
Wenn Monarchfalter mit starken Winden von Nordamerika verdriftet werden, sind sie manchmal an den Küsten der Britischen Inseln und Norwegens anzutreffen.[13][19] Von Stürmen über das Meer gewehte Falter werden immer wieder von Schiffen aus beobachtet, wie der folgende Bericht zeigt:[20]
I was a deck boy on the MV Laguna on a voyage from Liverpool to New York during September 1944. It was a convoy seven days out of Liverpool when order was given to scatter and make for New York without escort. This was due to the imminence of a hurricane in the path of the convoy. We encountered the edge of the hurricane and soon afterwards steamed into fair weather and blue skies. We were then 5 days or 1000 miles from New York when we ran through a massive swarm of monarch butterflies. I remember standing on deck watching this mass of colourful creatures fluttering around the ship's rigging. On arrival in New York I learned that the hurricane had turned westward, crossing Long Island, N.Y.
„Ich war Decksjunge auf der MV Laguna bei einer Reise von Liverpool nach New York im September 1944. Sieben Tage nach dem Auslaufen in Liverpool wurde der Konvoi angewiesen sich zu verteilen und alleine nach New York weiter zu fahren. Der Grund war ein riesiger Hurrikan auf der Route des Konvois. Wir begegneten dem Rand des Hurrikans und dampften bald danach in gutes Wetter mit blauem Himmel. Als wir dann auf einen riesigen Schwarm Monarchfalter stießen waren wir 5 Tage oder 1000 Meilen von New York entfernt. Ich erinnere mich, wie ich auf Deck stand und die Unmenge bunter Tiere beobachtet, die um die Takelage flogen. Bei der Ankunft in New York erfuhr ich, dass der Hurrikan sich westwärts gedreht hatte und über Long Island zog.“
Kolumbus-Hypothese
Der Lepidopterologe Richard Irwin Vane-Wright veröffentlichte 1993 die Kolumbus-Hypothese, in der er vermutete, dass sich der Monarchfalter in Nordamerika erst nach der Besiedlung Amerikas durch die europäischen Siedler stark vermehrte und ausbreitete. Die starken Abholzungen sollen die Voraussetzungen für die Wanderbewegungen der Falter geschaffen haben, da viele gerodete Flächen entstanden, auf denen sich die Nahrungspflanzen der Raupen sehr stark ausbreiten konnten. Dies soll zu einem so starken Wachstum der Falterpopulation geführt haben, dass sich die Tiere in weiten Bereichen der gemäßigten Zonen ausgebreitet haben. Da die Falter in anderen Teilen der Welt nicht oder nur sehr wenig wandern, soll sich ihr Wanderverhalten erst nach der starken Ausbreitung über den Pazifik entwickelt haben. Außerdem führt er an, dass es keine Berichte über die Wanderungen aus der Zeit vor 1865 gibt.
Die Hypothese spielt heute in der Forschung keine Rolle mehr. Gegen sie spricht unter anderem, dass sich der Orientierungssinn anhand der Sonne und des Erdmagnetfelds innerhalb von 200 Jahren hätte entwickeln müssen, was äußerst unwahrscheinlich ist. Außerdem haben die Schmetterlingsforscher Zalucki und Clarke nachgewiesen, dass für die Ausbreitung im pazifischen Raum nur die Ansiedlung an drei Stellen notwendig war, damit sich der Monarchfalter über die Inselgruppen verbreiten konnte. Dies konnte leicht unbemerkt und unbeabsichtigt durch menschliche Aktivitäten geschehen.[21]
Lebensweise



Larven
Vor dem Schlüpfen aus dem Ei wird der schwarze Kopf der Eiraupe hinter der halbtransparenten Eihülle sichtbar. Die Raupe beißt innerhalb weniger Stunden eine Öffnung in die Mikropyle. Dabei legt sie immer wieder Ruhepausen ein und verlässt die Eihülle, nachdem die Öffnung die Größe ihres Kopfes erreicht hat. Der größte Teil der Raupen frisst nur Teile der Eihülle, wenige fressen die komplette Eihülle auf oder knabbern nur die zum Schlüpfen nötige Öffnung ab und wendet sich direkt der Nahrungspflanze zu. Die kleinen Raupen ernähren sich als erstes von feinen Härchen, mit denen die Blätter der Seidenpflanzen überzogen sind. Danach krabbeln die Raupen umher, wobei die Härchen den Räupchen Probleme bereiten, um anschließend in die Nähe des Eis zurückzukehren und kleine Löcher in das Blatt zu fressen. Diese kleinen Löcher sind charakteristische Spuren der jungen Monarchfalterraupen. Nach der ersten Häutung wenden sich die Raupen den Blatträndern zu.
Wenn die Raupe auf ihrer Nahrungspflanze gestört wird, lässt sie sich zu Boden fallen, rollt sich zusammen und verharrt mehrere Minuten bewegungslos. Erfolgt die Störung mehrfach kurz hintereinander, dann verkürzt sich die Zeit der Bewegungslosigkeit auf etwa 50 Sekunden, bis sie sich schließlich nach etwa 15 Störungen nicht mehr tot stellt und gleich davon krabbelt. Wenn sich die Raupen von der Pflanze fallen lassen, müssen sie anschließend zu dieser oder einer anderen finden. Die Raupen sind nicht in der Lage, ihre Nahrungspflanzen zu riechen oder visuell von anderen Pflanzen zu unterscheiden. Deshalb krabbeln sie auf dem Boden in unregelmäßigen Wegen umher und suchen eine passende Pflanze. Mit Sinneszellen auf den Maxillarpalpen können die Raupen ertasten, ob es sich um eine geeignete Pflanze handelt. Wenn es nur wenige geeignete Pflanzen gibt, kann es passieren, dass sie keine findet und verhungert.
Die Warnfarbe der Raupen erlaubt es ihnen, auf der Oberseite der Nahrungspflanzen zu sitzen und sich ungestört zu sonnen.
Einige Monarchfalterraupen im letzten Larvenstadium nagen an den Blattstielen eine kleine Kerbe und krabbeln an die Blattspitze, um das Blatt abzuknicken. Danach krabbeln sie auf die Blattunterseite und fressen weiter. Die Zufuhr von Herzglykosiden und Milchsaft in das Blatt wird dadurch unterbrochen. Damit wird die Gefahr, dass die Raupe sich vergiftet oder ihre Mandibeln durch den Milchsaft verkleben, vermindert.
Bei der Zucht von vielen Raupen auf engem Raum kann es zu Kannibalismus kommen. Die angreifende Raupe beginnt, den gerade ausgeschiedenen Kot einer anderen Raupe zu fressen und geht dann dazu über, diese von hinten aufzufressen. In der freien Natur ist so ein Verhalten sehr unwahrscheinlich, da die Weibchen die Eier fast immer einzeln an Blätter der Nahrungspflanze ablegen und die Raupen somit nicht in großer Zahl zusammen leben. Die einzige Ausnahme sind Freilandbeobachtungen in Spanien, bei denen Puppen von Raupen angefressen wurden, als viele Raupen auf einer Pflanze lebten.[7]
Falter
Wandernde Falter sind an ihrem Flugverhalten zu erkennen, bei dem Hindernisse überflogen werden. Die Wanderungen der Falter werden stark vom Wind beeinflusst. Bei Rückenwind segeln die Falter oft und fliegen mehrere 100 Meter hoch, um den für sie günstigen Wind zu nutzen, während sie bei Gegenwind niedrig über dem Boden fliegen, wo der Wind am schwächsten ist. Bei den Wanderflügen legen die Falter immer wieder sogenannte „soziale Flüge“ ein, bei dem sich die Falter in etwa 30 Meter Höhe in einem großen Kreis verfolgen, wobei der Flug aus Flattern und Gleiten besteht. Oft werden sie dabei vom Wind weitergetragen, das Flugbild gleicht kreisenden Seevögeln an der Küste.
Nicht wandernde Falter, die umherfliegen, Blüten besuchen oder geeignete Pflanzen für die Eiablage suchen, haben einen eher ziellosen Flug und umfliegen Hindernisse. Männliche Falter fliegen höher im Gelände und besuchen auch Blüten auf Bäumen während die Weibchen meist dicht über der Bodenvegetation fliegen und geeignete Pflanzen für die Eiablage suchen. Bei diesem ziellosen Flug durchlaufen ihre Flügel beim Flügelschlag etwa 30 Bogengrad und die Flügelschläge werden von kurzen Gleitphasen unterbrochen. Die Falter erreichen dabei eine Geschwindigkeit von etwa 17 km/h. Wenn sich die Falter bedroht fühlen und fliehen, schlagen sie heftig mit den Flügeln, die dann 120° durchlaufen und senkrecht über ihrem Körper zusammenschlagen. Dabei erreichen die Falter eine Geschwindigkeit von über 30 km/h.[22][23] Bei Wanderflügen fliegen die Falter manchmal sehr hoch, sie wurden mit dem Fernglas bis zu 500 Meter hoch über dem Boden beobachtet und Drachenflieger-Piloten trafen sie bis in 1250 Meter über dem Grund an.[24]
Die Lebenserwartung der Falter liegt bei etwa einem Monat. Wenn die Falter wandern und eine Diapause einlegen, leben sie jedoch acht bis zehn Monate lang, wobei die Falter auch nur noch einen Monat leben, sobald sie fruchtbar geworden sind.[25][26]
Das Spektrum der Blütenpflanzen, die von den Faltern besucht werden, ist vielfältig. Es wurden Besuche an Blüten der folgenden Pflanzenfamilien beobachtet: Doldenblütler (Apiaceae), Seidenpflanzengewächse (Asclepiadaceae), Kreuzblütengewächse (Brassicaceae), Geißblattgewächse (Caprifoliaceae), Dickblattgewächse (Crassulaceae), Kardengewächse (Dipsacaceae), Heidekrautgewächse (Ericaceae), Wolfsmilchgewächse (Euphorbiaceae), Hülsenfrüchtler (Fabaceae), Hortensiengewächse (Hydrangeaceae) Malvengewächse (Malvaceae), Myrtengewächse (Myrtaceae), Wunderblumengewächse (Nyctaginaceae), Nachtkerzengewächse (Onagraceae), Orchideen (Orchidaceae); Rosengewächse (Rosaceae), Hahnenfußgewächse (Ranunculaceae), Weidengewächse (Salicaceae), Nachtschattengewächse (Solanaceae), Eisenkrautgewächse (Verbenaceae) und Grasbäume (Xanthorrhoeaceae) .
Die Falter nehmen von vertrockneten Pflanzen verschiedener Arten der Raublattgewächse (Boraginaceae), Korbblütler (Asteraceae) und Hülsenfrüchtler (Fabaceae) Pyrrolizidinalkaloide auf, die sie giftiger machen.[27] Die Männchen benötigen sie im Gegensatz zu anderen Arten der Danaini nicht für die Produktion von Pheromonen.[3]
Fortpflanzung
Die Männchen zeigen ein Revierverhalten und patrouillieren in ihrem Gebiet auf der Suche nach Weibchen. Wird ein Männchen auf ein Weibchen aufmerksam, dann verfolgt es dieses mit schnellem Flug. Wenn das Weibchen nicht paarungsbereit ist, flieht es in einem schnellen Zick-Zack-Flug und weicht dem Männchen aus. Paarungsbereite Weibchen beginnen einen wendelförmigen Flug nach oben, bei dem sie vom Männchen verfolgt werden. Zwischendurch brechen sie aus und fliegen schnell davon. Dieses Schauspiel wiederholt sich mehrfach und das Männchen überholt das Weibchen und stülpt dabei seine Haarbüschel am Abdomen aus. Später setzen sich beide auf ein Blatt oder einen Zweig. Das Männchen fächelt mit sanften Flügelschlägen zum hinter ihm sitzenden Weibchen, das seine Flügel geschlossen hält. Danach zieht das Männchen seine Haarbüschel ein und biegt sein Abdomen zum Abdomen des Weibchens und beide vereinen sich. Anschließend fliegt das Männchen kurze Strecken mit dem an ihm heftenden Weibchen, das weiterhin seine Flügel geschlossen hält. Außer Sperma werden auch Nährstoffe und Herzglykoside übertragen. Die Nährstoffe nutzt das Weibchen bei der Eiproduktion, welche besonders nach der Überwinterung wichtig sind, wenn die Fettreserven fast verbraucht sind. Die Herzglykoside verstärken die Giftigkeit.
Im Gegensatz zu anderen Danaini sind die Haarbüschel für eine erfolgreiche Paarung beim Monarchfalter nicht erforderlich. Die Falter tauchen manchmal das Abdomen mit den Büscheln in die Flügeltaschen, übertragen aber keine Duftstoffe, da sie im Gegensatz zu anderen Arten der Gattung keine Pheromone produzieren. Dieses Verhalten scheint ein Relikt aus der Zeit zu sein, als Pheromone bei der Art noch eine wichtige Rolle bei der Paarung spielten. Statt um das Weibchen mit Düften im Flug zu werben, gibt es beim Monarchfalter oft eine rabiate Methode, um die Paarung zu erzwingen. Im Flug stürzt sich das Männchen von oben auf das Weibchen und hält sich an ihm mit seinen Beinen an Kopf, Thorax und Abdomen fest und zwingt sie in einem Gleitflug zur Landung. Dieses Verhalten ist nur vom Monarchfalter und dem Afrikanischen Monarch bekannt. Speziell geformte Tarsen helfen den Männchen sich an den Weibchen festzuhalten. Die weit verbreitete Partnerwahl durch weibliche Schmetterlinge gibt es damit beim Monarchfalter nicht. Dieses Verhalten veranlasste Miriam Rothschild 1978 zu folgender, oft zitierten, Äußerung:[3]
“The monarch butterfly could well be designated nature's prime example of the male chauvinistc pig.”
„Der Monarchfalter kann als bestes Beispiel der Natur für das männliche Chauvinisten-Schwein bezeichnet werden.“
In den Überwinterungskolonien werden die Weibchen bevorzugt von Männchen begattet, die kleiner und abgeflogener sind und den Rückflug nicht überstehen können. Größere Männchen in gutem Zustand treten den Rückflug an und paaren sich erst später nahe an den Eiablagestellen. Die Weibchen werden bis zu 11 Mal begattet und legen über einen Zeitraum von zwei bis fünf Wochen etwa 300 bis 400 Eier einzeln auf die Blattunterseite der Nahrungspflanze ab. Bei gezüchteten Faltern mit idealer Nahrungsversorgung werden etwa doppelt so viele Eier produziert, Spitzenwerte können sogar bei über 1000 Eiern liegen.[28]
Die Männchen verlieren bald nach der Paarung Gewicht in Form von Wasser und werden spröde, sie bleichen aus und sterben. Nach der Paarung entwickeln sich langsam die ersten Eier, deshalb legen die wandernden Weibchen gegen Ende ihrer Wanderung die meisten Eier ab. Danach ereilt sie dasselbe Schicksal wie die Männchen.
Orientierung
Die Monarchfalter orientieren sich bei ihren Wanderungen am Sonnenstand und korrigieren den Azimut während des Tages um den Kurs zu halten. Durch die Wahrnehmung polarisierter Ultraviolettstrahlung ist diese Navigation auch bei bedecktem Himmel möglich. Zusätzlich haben sie im Kopf Magnetit eingelagert und können sich dadurch mit Hilfe des Erdmagnetfelds und ihres Magnetsinns orientieren.[29] Bei ihren Wanderungen nutzen sie außerdem Landmarken wie etwa die Sierra Madre Oriental, der sie im Herbst entlang nach Süden mit leichter Ostausrichtung folgen, nachdem sie zuvor eine südwestliche Richtung durch Nordamerika flogen. Ebenso dienen Gewässer wie große Flüsse oder Seen und die Meeresküsten der Orientierung.[30][31]
Entwicklung
Die Eiraupe schlüpft etwa vier bis fünf Tage nach der Eiablage. Die Entwicklungszeit verringert sich mit steigender Temperatur. Bei 17 °C dauert es gute 5 Tage, während sich die Entwicklungszeit ab 25,5 °C auf unter 4½ Tage verkürzt. Unter günstigen Bedingungen erreichen die Raupen nach etwa 16 Tagen das Vorpuppenstadium. In dieser Zeit häuten sie sich vier Mal; aus der 0,54 Milligramm leichten Eiraupe wird eine etwa 1,5 Gramm schwere und sechs Zentimeter lange Raupe. Die Gewichtszunahme über die Zeit ähnelt einer quadratischen Funktion. Die Entwicklungsgeschwindigkeit hängt stark von der Temperatur ab, bei feuchtem und kühlem Wetter kann die Entwicklung stark verzögert ablaufen, während höhere Temperaturen und Sonnenschein die Entwicklung beschleunigen. Vor jeder Häutung wird die Raupe träge, sie wandert umher und sucht einen ruhigen Platz, an dem sie innerhalb einiger Stunden die Häutung vollzieht. Dabei wirkt ihr Körper verkrampft, hin und wieder bewegt sie sich ruckartig vor und zurück oder schlägt nach links und rechts. Die alte Haut reißt hinter dem Kopf auf. Mit Kontraktionen wird sie nach hinten abgestoßen. Die Raupe ruht noch eine Weile bis die neue weiche Haut, besonders die Kopfkapsel und die Mundwerkzeuge, ausgehärtet sind.
Die Raupen ernähren sich hauptsächlich von verschiedenen Seidenpflanzen, in Nordamerika sind 27 Arten als Nahrungspflanzen nachgewiesen. Seltener werden Arten anderer Gattungen aus der Unterfamilie der Seidenpflanzengewächse angenommen. Die Eier für die erste Generation werden vorwiegend an Asclepias oenotheroides, Asclepias viridis und Asclepias asperula abgelegt, während die Eier für die zweite bevorzugt an Gewöhnlicher- (Asclepias syriaca) und Sumpf-Seidenpflanze (Asclepias incarnata) abgelegt werden. Sehr selten legen die Falter Eier an dem invasiven Neophyten Vincetoxicum rossicum ab, an dem sich die Raupen nicht entwickeln können.[32]
In neu besiedelten Gebieten haben die Raupen teilweise auf andere Pflanzenfamilien gewechselt. Auf den Kanaren und Madeira fressen sie an dem Wolfsmilchgewächs Euphorbia mauretanica und in Andalusien an dem zu den Hundsgiftgewächsen zählenden Cynanchum acutum.[7]

- Hundsgiftgewächse (Apocynaceae)
- Hundsgift (Apocynum): A. androsaemifolium
- Seidenpflanzengewächse (Asclepiadoideae)
- Acerales: Acerales sp.
- Araujia: A. hortorum, A. sericifera
- Asclepias: A. amplexicaulis, A. asperula, A. cordifolia, Indianer-Seidenpflanze (A. curassavica), A. eriocarpa, A. exaltata, A. fascicularis, A. fruticosa, A. grandiflora, A. humistrala, Sumpf-Seidenpflanze (A. incarnata), A. lanceolatum, A. mexicana, A. nitida, A. nivea, A. oenotheroides A. phytotaccoides, A. purpurascens, A. rotundifolia, A. rubra, A. semilunata, A. speciosus, A. sullivanti, Gewöhnliche Seidenpflanze (A. syriaca), A. tomentosa, Knollige Seidenpflanze (A. tuberosa), A. verticillata, A. viridis
- Calotropis: Kronenblume (C. gigantea) (Hawaii), Oscher (C. procera) (Barbados)
- Cynanchum: C. acutum (Spanien)
- Gomphocarpus: G. arborescens, Baumwoll-Seidenpflanze (G. fruticosus) (Azoren, Neuseeland), G. physocarpus (Neuseeland)
- Gonolobus: G. laevis, G. rostratus
- Marsdenia: (Marsdenia sp.)
- Matelea: M. reliculata
- Oxypetalum: O. coeruleum
- Stapelien: Stapelia variegata, S. grandiflora
- Windengewächse (Convolvulaceae)
- Prunkwinden (Ipomoea sp.)
- Rautengewächse (Rutaceae)
- Zitruspflanzen (Citrus sp.)
Die verpuppungsreife Raupe verlässt die Nahrungspflanze und sucht sich viele Meter weit entfernt einen geschützten, schattigen Platz für die Verpuppung. Wenn sie einen solchen gefunden hat spinnt sie ein kleines Polster aus Fäden, die Drüsen an ihrem Kopf produzieren. Danach spinnt sie in der Mitte der Matte einen Strang, der bis zu vier Millimeter lang sein kann. Beides dauert etwa drei Stunden. An dem Strang befestigt sie sich mit gebogenen Dornen, die ringförmig um die analen Bauchbeine angeordnet sind. Die hängende Raupe hat die Form eines „J“, der Kopf ist zum Thorax hochgezogen. Nach wenigen Minuten bricht die Raupenhaut hinter dem Kopf auf und die Haut der Stürzpuppe kommt zum Vorschein. Die Puppe ist anfangs weich und beweglich, sie härtet mit der Zeit aus. Nach 9 bis 12 Tagen Puppenruhe schlüpft der Schmetterling innerhalb von drei Minuten. Er pumpt Hämolymphe in die Flügel um sie zu entfalten und wartet, bis sie ausgehärtet sind.[34]
Monarchfalterraupen auf Barbados
Auf Barbados gibt es ein bemerkenswertes Zusammenspiel mit Käfern der Seidenpflanzen. Die Monarchraupen ernähren sich auf der Insel hauptsächlich von Oscher (Calotropis procera), da die Indianer-Seidenpflanze (Asclepias curassavica) aufgrund der Topologie der Insel nur selten Fuß fassen kann. Siedelt sie sich jedoch einmal zusammen mit Wanzen der Gattung Oncopeltus an, so werden die Pflanzen von den Raupen so schnell kahl gefressen, dass die Wanzen verhungern.[35]
Die Populationen und ihre Wanderungen

Die ausgedehntesten Wanderungen unternehmen die Falter der östlichen Population in Nordamerika, gefolgt von der westlichen Population. Die beiden Populationen sind durch die trennenden Rocky Mountains nicht ganz geographisch isoliert. In Tälern in Idaho und Montana, besonders an den Nebenflüssen des Snake River, ziehen die Falter beider Populationen umher und es findet Genfluss statt. In Australien und Neuseeland wandern die Falter nur über kurze Strecken.
Östliche Population
Die östliche Population in Nordamerika lebt zwischen den östlichen Rocky Mountains und der Atlantikküste. Der Großteil der Population überwintert in einer Diapause in den Vulkanbergen der Sierra Nevada Mexikos auf etwa 3000 Höhenmetern. Nur ein sehr kleiner Teil überwintert im milden Süden Floridas und pflanzt sich teilweise auch im Winter fort. Im Frühjahr wandern die Falter von ihren Überwinterungsplätzen über mehrere Generationen nach Norden und Osten. Sie legen unterwegs immer wieder Eier ab, aus denen sich die nachfolgenden Generationen entwickeln.
Erste Generation
Die letztjährigen Falter erreichen nach der Überwinterung in Mexiko bei ihrer Nordwanderung bis Ende April Texas, Oklahoma, Arkansas, Louisiana, Mississippi, Alabama, Georgia, South Carolina, North Carolina und den Süden von Missouri und Kansas. Es scheint, dass die Falter wieder zu dem Ort zurückkehren wollen, in dem sie als Raupe gelebt haben. Nur sehr wenige ziehen weiter nach Norden bis zu den Großen Seen, da nur wenige Tiere die Wanderungen in beide Richtungen über die große Entfernung überstehen.[36] Die Weibchen legen nur wenige Eier in Mexiko, die meisten legen sie gegen Ende ihrer Wanderung in den südlichen USA.[37] Die daraus entstehende erste Generation schlüpft Ende April bis Anfang Juni. Die wandernden Falter erreichen Ende Mai North Dakota, Minnesota und das Gebiet um die Großen Seen und legen in diesen Gebieten ebenfalls Eier ab. Die Falter dieser Generation sind von Südtexas und der Golfküste bis nördlich der Großen Seen anzutreffen. Da nur wenige Überwinterer aus Südflorida nach Norden ziehen und in Zentral- und Nord-Florida Eier ablegen, fliegen auch nur sehr wenige Falter der ersten und letztjährigen Generation östlich der Appalachen nach Norden.[24] Die Entwicklung ist aufgrund der oft niedrigen Temperaturen langsam und es dauert 40 bis 50 Tage, bis sich aus den Eiern Falter entwickelt haben.
Zweite Generation
Die Falter der zweiten Generation schlüpfen im Juni und Juli und wandern nur noch wenig weiter nach Norden und erreichen etwa am 50. Breitengrad die nördliche Verbreitungsgrenze im Süden Kanadas. Sie wandern stärker Richtung Nordosten und besiedeln den Raum zwischen Sankt-Lorenz-Strom und dem Atlantik und fliegen bis New Brunswick, Nova Scotia und dem Osten von Neufundland. Die Nahrungspflanzen im Süden der USA vertrocknen im Sommer. Deshalb wandern die dortigen Falter nach Norden und südlich des 33. Breitengrads sind danach fast keine Falter mehr anzutreffen.
Weitere Generationen
Durch unterschiedlich schnelle Entwicklung in den verschiedenen Regionen fliegt Ende August/Anfang September eine dritte und vierte Generation gemeinsam und bildet die individuenstarke Spätsommerpopulation, die wenig später nach Süden wandert. Während die vorherigen Generationen wenige Tage nach dem Schlüpfen fruchtbar wurden, bleiben viele dieser Tiere bis nach der Diapause unfruchtbar. Einige Weibchen, die fruchtbar sind, legen auf dem Weg nach Süden weitere Eier und es kann stellenweise eine fünfte Generation entstehen.[38] Ausgelöst wird die Dormanz durch die kurzen Tage, die niedrigeren Temperaturen und die absterbenden Nahrungspflanzen.[39]
Migration
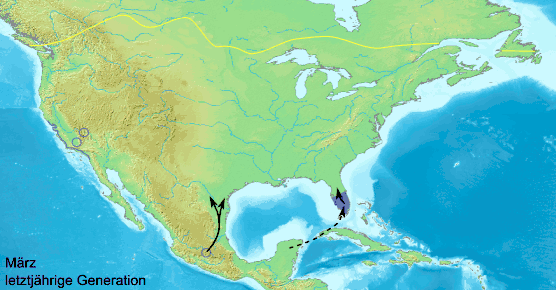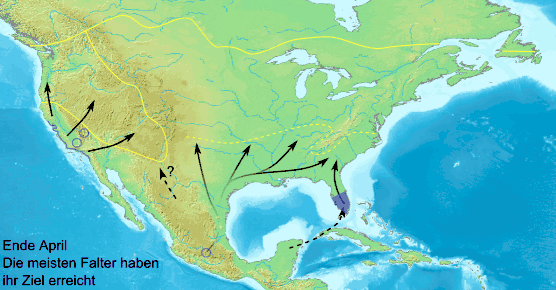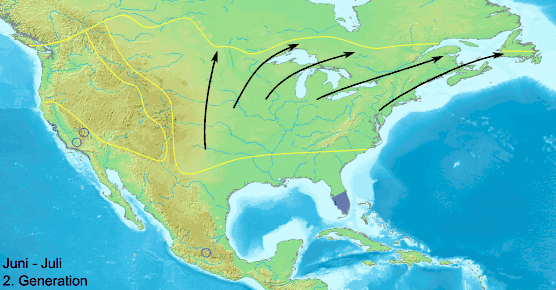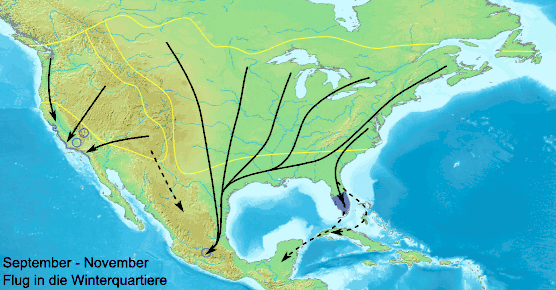

Die Tiere wandern aus ihrem über 100 Millionen Hektar großen Lebensraum von September bis November in die mexikanische Sierra Nevada und versammeln sich auf weniger als 20 Hektar. Auf ihrer Wanderung finden sie sich jährlich immer wieder an den gleichen Rastplätzen ein und bilden über die Nacht teilweise große Kolonien. Die Falter sitzen bei niedrigen Temperaturen und starkem Wind dichter beisammen und bilden noch größere Kolonien. Bei Temperaturen unter 10 °C können die Falter nicht fliegen und ruhen bei entsprechendem Wetter auch tagsüber. Bei Sonnenschein und über 13 °C können sie ihre Wanderung fortsetzen. Für die Wanderung von Kanada bis Mexiko benötigen die Falter acht bis zehn, aus den südlicheren Gebieten vier bis sechs Wochen. Durchschnittlich legen sie etwa 50 Kilometer am Tag zurück. Während der Wanderung sterben viele Falter in den Gewässern und auf den Straßen. An manchen Stellen sind die Ufer der großen Seen mit angeschwemmten toten Faltern übersät. Die Falter wandern in einer südwestlichen Richtung, starten östlich des Huronsees, dann erreichen sie in der Regel nicht direkt Mexiko, sondern stoßen auf den Golf von Mexiko und wandern in großen Schwärmen an der Küste entlang. Die Falter von der Ostküste wandern anfangs nach Süden und stoßen auf die Atlantikküste, an der sie entlang ziehen, bevor sie ihre Flugrichtung nach Westen zur Golfküste ändern.
Etwa im Oktober durchqueren sie Texas um in Mexiko der Sierra Madre Oriental nach Süden zu folgen, danach wenden sie sich nach Westen und erreichen die Vulkanberge der Sierra Nevada.
Die Herkunft der Falter spiegelt sich im Winterquartier nieder. Die Falter der Great Plains fliegen die westlichsten Plätze an, die der Großen Seen, die nicht die Golfküste erreichen, etwa die mittleren. Falter, die die Golfküste erreichen, besetzen die östlichen Plätze.
Ein kleiner Teil der östlichen Falter fliegt nach Florida, davon verbringt der größte Teil den Winter dort, oft ohne Diapause, und der Rest fliegt über Kuba nach Yucatán. Andere ziehen über Nordflorida, Jamaika und Kuba nach Yucatán. Aus Yucatán sind große Schlafkolonien wandernder Falter bekannt. Ob es sich hierbei nur um die Nominatform Danaus plexippus plexippus oder auch um die in der Karibik verbreitete Unterart Danaus plexippus megalippe handelt, ist nicht geklärt. Ein sehr kleiner Teil der Falter, der auf die Atlantikküste stößt, fliegt manchmal nach Bermuda.[40]
Überwinterung in Mexiko

Die Überwinterungsquartiere befinden sich im Süden Mexikos in den Bundesstaaten México und Michoacán in der Sierra Nevada, einem Hochplateau vulkanischen Ursprungs. Die etwa 30 Überwinterungskolonien verteilen sich auf neun getrennte Vulkanmassive, die zwischen 70 und 170 Kilometer von Mexiko-Stadt entfernt sind. In den Bergen herrschen die Madrean Pine-Oak Woodlands vor, es wachsen hauptsächlich Eichen bis auf 2900 Meter, Kiefern zwischen 1500 und 3000 Meter und Tannen (Abies religiosa) zwischen 2400 und 3600 Meter über N.N. Weniger stark verbreitet sind Zypressenwälder (Cupressus lindleyi), die zwischen 2400 und 2600 Meter wachsen, Wacholderheiden und Grasflächen mit Fingerkräutern (Potentilla candicans). Stellenweise gibt es Agrarflächen und Buschland.[24][41]
Wenn die Falter in den Bergen angekommen sind, fliegen sie umher, beobachten die Windrichtung und suchen sich windgeschützte Stellen an Bäumen, bevorzugt auf Abies religiosa. Wenn sich die zuerst eingetroffenen Falter niedergelassen haben, gesellen sich die nachfolgenden ohne Beachtung der Windrichtung hinzu und es bilden sich dichte Trauben aus Faltern, die ganze Bäume bedecken können. Wenn sich der Wind dreht, sind die Falter, die sich vorher im Lee befanden, dem kalten Wind ausgesetzt. Da sie bei den niedrigen Temperaturen im Winter nicht fliegen können, fallen sie zu Boden, wenn sich die Bäume im Sturm mit Regen- oder Schneefall biegen, welche häufig Ende Dezember bis Anfang Januar auftreten. Ganze Trauben von Faltern werden dabei von den Baumspitzen geschüttelt und sterben am Boden. Mitte Januar und im Februar lösen sich die großen Trauben auf den Gipfeln auf und die Falter wandern talwärts und bilden kleinere und lockere Trauben. Die Falter verlassen dann immer wieder die Bäume um am Rand kleiner Pfützen und an Matsch zu saugen. Gegen Ende Februar, wenn es wieder wärmer wird, verlassen sie die Berge und wandern nach Norden. Nur ein sehr kleiner Teil bleibt in Mexiko zurück.[42]
Westliche Population

Die westliche Population in Nordamerika lebt den Sommer über in den Tälern der westlichen Rocky Mountains und der Kaskadenkette. Sie macht etwa fünf Prozent der Gesamtpopulation aus und überwintert an der kalifornischen Küste auf Eukalyptusbäumen, Monterey-Kiefern (Pinus radiata) und Monterey-Zypressen (Cupressus macrocarpa). Auf Platanus racemosa überwinterten sie, bevor diese durch die weißen Siedler stark abgeholzt wurden.[43]
Auf den Kiefern bilden die Falter besonders dichte Trauben, wogegen sie auf den in den 1850er Jahren aus Australien eingeführten Eukalyptusbäumen lockerer beisammen sitzen. Die Eukalyptusbäume haben sich stark ausgebreitet und blühen im Winter, so dass sie den Faltern in dieser nektararmen Jahreszeit besonders wertvoll sind.[44] Die Tiere an den nördlichen Überwinterungsplätzen sind inaktiv und bleiben über den Winter am selben Ort. Die südlichen Falter sind oft aktiv und saugen zwischendurch Nektar. Manchmal wechseln sie den Überwinterungsplatz. Ab Mitte Februar werden die Tiere aktiver und ziehen wenige Wochen später nach Nordosten.
Die über 300 Überwinterungsplätze befinden sich fast ausschließlich in einem 1000 Kilometer langen Küstenstreifen von Marin County bis Ensenada, im Schnitt etwa 2,5 Kilometer von der Küste entfernt. Nur sechs Plätze im Landesinneren sind bekannt, wovon ein Überwinterungsplatz nördlich der Mojave-Wüste im trockenen Saline Valley, 320 Kilometer von der kalifornischen Küste entfernt, eine krasse Ausnahme darstellt. Die Ansammlungen der Falter erreichen nur selten mehr als 1000 Tiere, nur elf Orte sind bekannt, an denen die Ansammlungen über mehrere Jahre hinweg mehr als 50.000 Individuen hatten. Etwa 70 Prozent der gesamten westlichen Population überwintert zwischen Santa Cruz County und Santa Barbara County.
Besonders viele Falter überwintern bei Ventura, Carlsbad, Santa Cruz (Natural Bridges State Park), North Beach Campground in Pismo Beach (San Luis Obispo County) und der kleinen Stadt Pacific Grove im Monterey County.[45]
Es gibt Anzeichen, dass einige Falter aus dem Großen Becken südöstlich über Arizona nach Sonora wandern. Ob es sich hier um eine wirkliche Migration oder nur um die Verkleinerung des Verbreitungsgebietes über den Winter handelt, ist noch nicht geklärt.[39]
Australien
Seit den 1870er Jahren hat der Monarchfalter weite Teile des östlichen Australien und einen kleinen Teil im Westen besiedelt. Die saisonbedingte Ausbreitung hängt mit dem Vorhandensein von Seidenpflanzengewächsen zusammen, die empfindlich auf Trockenheit und Frost reagieren. In Queensland brütet der Großteil der Population das ganze Jahr über. Im Herbst ziehen sich die Falter aus New South Wales und dem südlichen Queensland zurück und wandern nach Norden. Regelmäßige Langstreckenwanderungen werden nicht beobachtet, obwohl die längste gemessene Wanderung eines Falters fast 400 Kilometer beträgt. Die Falter konzentrieren sich in drei Gebieten, einem Küstenstreifen im nördlichen New South Wales und südlichen Queensland, im Sydneybecken und Hunter Valley und in der Umgebung von Adelaide. Südlich des 34. südlichen Breitengrades sind die Tiere in der Regel ab Herbst nicht fruchtbar, wogegen ein Teil der Population in der Region von Sydney immer fruchtbar ist. Das Verhältnis von fruchtbaren zu unfruchtbaren Tieren hängt von der Temperatur ab.[46]
Neuseeland
In Neuseeland wird das Wander- und Überwinterungsverhalten des Monarchfalters etwa seit 1980 erforscht, Berichte über überwinternde Falter gehen bis in die 1950er Jahre zurück. Die Falter legen auf Neuseeland nur kurze Strecken zurück um zusammen zu überwintern, sehr selten sind es mehr als 20 Kilometer. Die Anzahl der Überwinterer schwankt wetterbedingt ebenso stark wie die Populationen in Neuseeland insgesamt.
Einige 100 Überwinterer wurden 1959 erstmals auf der Nordinsel in Northland, Hawke’s Bay und Nelson beobachtet, in den darauf folgenden Jahren ging ihre Anzahl teilweise auf einige Dutzend zurück und erreichte 1962 wieder über 100 Tiere. Kolonien mit einigen 1000 Tieren wurden auf der Nordinsel auf Stephenson’s Island, in der Bucht von Tauranga und im Norden von Auckland im Mai und Juni 1964 beobachtet.
Die Falter werden immer wieder in den Regionen Canterbury und Otago und gelegentlich in der Region Southland gesichtet. In Christchurch, an der Ostküste der Südinsel, versammeln sich die Falter in Parks und Gärten und sind damit zur Touristenattraktion geworden, eine größere Anzahl Überwinterer hat sich zum Beispiel 2003 versammelt. Nach einem Schneeeinbruch 1992 brach die Population auf der Südinsel stark ein.[14][47]
Populationsdynamik
Von den abgelegten Eiern entstehen aus etwa 90 Prozent keine Falter. Umweltbedingungen und besonders natürliche Feinde wie Ameisen und Parasitoide reduzieren die Population in jedem Stadium. Bis zu zehn Prozent der Raupen erreichen das Falterstadium durch Probleme bei der Häutung, bakterielle, virale oder fungizaile Infektion, Vergiftung durch die Herzglykoside und verklebte Mundwerkzeuge durch den Milchsaft der Nahrungspflanze nicht. Temperaturen über 35 °C sind für die Raupen, ebenso wie längere Frostperioden für alle Stadien tödlich. Geringe Luftfeuchtigkeit und längere Trockenheit, bei der die Nahrungspflanzen vertrocknen, wirken sich ebenfalls negativ aus.
Die Falter sind sehr frostempfindlich, schon wenige Grade unter Null lassen viele Tiere sterben. Werden die Tiere vor dem Frost angefeuchtet, etwa durch Nebel oder Regen, verringert sich ihre Frosthärte stark. Experimente zeigten, dass bei trockenen Bedingungen die Hälfte der Tiere −8,1 °C überlebten, bei −15 °C starben alle. Von befeuchteten Tieren starb die Hälfte schon bei −4,4 °C und bei −7,8 °C starben alle. Außerdem beschleunigt Feuchtigkeit das Erfrieren, bei −4 °C dauert es bei angefeuchteten Faltern nur drei Stunden, während trockene Falter auch nach 24 Stunden noch nicht erfroren sind.[48]
Die Stärke der westlichen Population unterliegt viel stärkeren Schwankungen als die östliche, da die Nahrungspflanzen weniger stark verbreitet sind und durch das an vielen Orten trockene Klima nicht jedes Jahr gut gedeihen. Die Populationsstärke korreliert stark mit dem Grad der Trockenheit eines Jahres. So wurden 1997 etwa über 1,2 Millionen Tiere gezählt und nach mehreren trockenen Jahren waren es 2002 nicht einmal mehr 100.000. Viele Überwinterungsplätze blieben 2002 verwaist, obwohl diese die gleichen Bedingungen boten, wie die Jahre zuvor. Es gab weder Abholzungen noch Baumaßnahmen.[49]
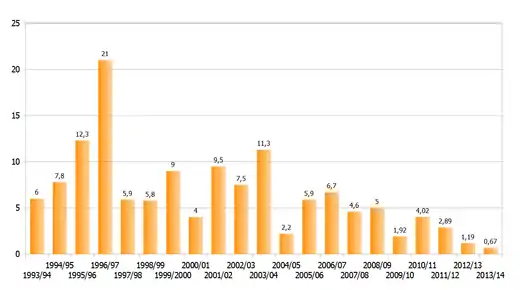
Die mehreren 100 Millionen Falter der östlichen Population, die sich je nach Jahr im Sommer entwickelt, erleidet bei ihren langen Migrationsflügen erste starke Verluste etwa durch Wettereinflüsse und den Straßenverkehr. Weitere kommen über die lange Diapause durch das kalte Wetter und Prädatoren hinzu. Die Wettereinflüsse in der Sierra Nevada treffen die Tiere seit einigen Jahrzehnten durch illegalen Holzeinschlag stärker. Schon der Einschlag weniger Bäume kann dazu führen, dass mehr Falter absterben, da sie einerseits leichter nass werden und stärker kalten Winden in der Nacht ausgesetzt sind, sodass die frostempfindlichen Tiere sterben. Andererseits sind sie am Tag stärkerer Sonneneinstrahlung ausgesetzt, was zu einem höheren Energieverbrauch führt und sie damit ihre Fettreserven aufzehren. Kälteeinbrüche töten immer wieder Millionen Tiere, wie etwa 1981 als circa 2,7 Millionen Falter starben. Der längste beobachtete Sturm 1981 dauerte vom 12. bis 23. Januar und tötete etwa 42 Prozent der Population. Im Januar 1992 tötete lang anhaltendes kaltes und feuchtes Wetter 90 Prozent der Falter in der Kolonie Sierra Herrada, die auf 3164 Metern liegt. Ein verheerender Kälteeinbruch und Sturm vom 12. bis 16. Januar 2002, bei dem die Falter vorher durch Regen nass wurden, tötete mit etwa 500 Millionen Tieren 75 Prozent der Population. An den Überwinterungsstellen wurden etwa 5000 tote Falter pro Quadratmeter gezählt.[48] Zwei Jahre später töteten zwei Stürme am 18. und 31. Januar etwa 70 Prozent der Falter. Der folgende Sommer war der kühlste seit 1992 und die Sommerpopulation hatte nur ein geringes Wachstum. Im darauffolgenden Winter 2004/2005 wurde die bis dahin geringste Zahl überwinternder Monarchfalter in Mexiko registriert. Die Kolonien beanspruchten nur 2,2 ha, der niedrigste Wert seit mindestens 12 Jahren, wahrscheinlich sogar seit Beginn der Beobachtungen der Plätze Ende der 1970er Jahre. Die größte Ausdehnung hatten die Kolonien 1996/1997 mit fast 22 ha. In den folgenden Jahren gab es eine leichte Erholung, jedoch haben die Bestände in den folgenden Jahren wieder abgenommen und im Winter 2013/14 einen neuen Tiefstand mit nur 0,67 ha erreicht.[50] Als Hauptursachen für die Rückgänge der letzten Jahre gilt neben Wetterextremen der starke Rückgang an geeigneten Nahrungspflanzen in den USA und Kanada durch den Anbau von pestizidresistenten Pflanzen in großen Maßstab und die Verdrängung der Nahrungspflanzen durch eingeschleppte Pflanzen.[51]
Infektionen
Das Bakterium Micrococcus flaccidifex danai tötet die Raupen vor der Verpuppung. Micrococcus flaccidifex ist als biologische Schädlingsbekämpfung patentiert.[52][53]
Parasiten
Das Protozoon Ophryocystis elektroscirrha parasitiert die Falter in ihrem gesamten Verbreitungsgebiet. Der Parasit schwächt die Falter, die infizierten Tiere fliegen langsamer und können nicht so weite Flüge zurücklegen. Dadurch wird die Ausbreitung des Parasiten bei besonders weit wandernden Populationen stark gehemmt, da nur nicht bis schwach infizierte Tiere die weiten Strecken bis zu den Winterquartieren zurücklegen können. Der Parasitierungsgrad der östlichen Population ist im Westen (östlich der Rocky Mountains bis zu den Appalachen) geringer als bei Faltern im Osten des Verbreitungsgebiets, nahe der Atlantikküste. Die nach Florida ziehenden Falter oder die ortstreuen Falter in Florida haben einen geringeren Selektionsdruck, dagegen begünstigt die weite Wanderung nach Mexiko resistente Tiere. Unterschiede bei Flügelgröße und -form haben dagegen auf die Geschwindigkeit und Gesamtdistanzen keinen nennenswerten Einfluss.[54] Die Sporen von Ophryocystis elektroscirrhas werden von den Raupen gefressen, sodass sich die Art in ihrem Körper erst ungeschlechtlich und später geschlechtlich vermehren kann. In den letzten Tagen des Puppenstadiums werden neue Sporen gebildet, die sich beim Schlupf auf den Schuppen der Flügel wiederfinden. Die Sporen lagern sich auf den Nahrungspflanzen ab oder werden bei der Eiablage durch die Falter auf die Oberfläche der Eier gebracht. Die Eiraupen fressen die Sporen auf der Eihülle oder die Raupen nehmen die Sporen über die Nahrungspflanze auf und der Kreislauf beginnt von neuem. Bei der Paarung können die Sporen vom Männchen auf das Weibchen übertragen werden und dieses kann wiederum die Eier infizieren. Die Übertragung von Falter zu Falter ist ebenfalls möglich, wenn sich die Tiere nahe beieinander befinden, was häufig bei der Überwinterung in den großen Kolonien auftritt. Wie die Infektionsrate der Nachkommen dadurch beeinflusst wird, ist noch nicht erforscht. Bei sehr starker Infektion bekommt die Puppe graue Flecken und der Schlupf der Falter wird so stark erschwert, dass sie manchmal die Puppenhülle nicht ganz verlassen können.[55]
Parasitoide
Es sind über 20 verschiedene Parasitoide des Monarchfalters bekannt. In Nordamerika werden durchschnittlich 13 Prozent der Raupen parasitiert, fast ausschließlich von Fliegen der Art Lespesia archippivora. Die Rate schwankt stark von Jahr zu Jahr und von Region zu Region, so dass in einzelnen Fällen bis zu 90 Prozent parasitiert sind. Die Raupen werden in allen Stadien parasitiert, wobei Raupen im späten zweiten bis zum vierten Stadium bevorzugt werden. In den fortgeschrittenen Stadien kommt es vereinzelt zu Superparasitierung, das bedeutet, dass mehr als ein Fliegenweibchen seine Eier in eine Raupe legt. Im letzten Stadium geht die Rate zurück, da diese Raupen in der Lage sind, die Fliegen abzuschütteln. Aus den parasitierten Raupen entwickeln sich bis zu zehn Fliegen, wobei sich bei etwa 35 Prozent nur eine, und bei jeweils etwa 15 Prozent zwei bis drei Fliegen entwickeln.
Lespesia archippivora ist nicht auf den Monarchfalter spezialisiert und parasitiert mindestens 25 Schmetterlingsarten aus 14 Familien und einen Hautflügler. Die Dosis der durch die Nahrungspflanze aufgenommenen Cardenolide hat keinen Einfluss auf den Parasitierungsgrad. Lespesia archippivora wird von einer Erzwespen-Art aus der Familie der Perilampidae parasitiert. Deren Weibchen heften ihre Eier an Blätter. Nachdem die Larven geschlüpft sind, dringen sie in den Körper des Hauptwirts ein und suchen die Larve des Hauptparasiten. Sie entwickeln sich erst weiter, wenn sich dieser verpuppt.[56]
Weitere bekannte Parasitoide des Monarchfaltes sind:
- Zweiflügler (Diptera): Brachymeria obscurata, Buquetia obscura, Chaetogaedia monticola, Compsilura concinnata, Epicampocera obscura, Eusisyropa virilis, Exorisla mella, Lespesia archippivora, Lespesia schizurae, Madremyia saundersii, Phryxe pecosensis, Phryxe vulgaris, Paradrino laevicula, Sturmia convergens, Winthemia diversa
- Hautflügler (Hymenoptera): Trichogramma minutum, Trichogramma Intertmedium, Echthromorpha fuscator[13]
Insekten


Zu den Prädatoren der Eier und Raupen gehören Käfer, wie etwa Marienkäfer, die die Eier fressen, die räuberische Wanzenart Cermatulus nasalis, die die Raupen aussaugt und Florfliegen (Chrysopidae), die die jungen Raupen fressen.[47]
Ameisen schleppen die Eier in ihren Bau und töten die Raupen.[52] Die in den südlichen USA eingeschleppte Rote Feuerameise (Solenopsis invicta) stellt eine große Bedrohung für die Eier und Raupen dar und trägt zu einer recht geringen Populationsdichte und lückenhaften Verbreitung in den südlichen Staaten bei. Die Feuerameise verdrängt jedoch auch einheimische Ameisenarten, durch die es ebenfalls zu großen Verlusten bei den Eiern und den Raupen kommt, sodass sich die Verluste der Falter wahrscheinlich in der Waage halten.[57]
In Neuseeland verhindern Ameisen der Art Technornyrmex albipes die Ansiedlung von Monarchfalterraupen auf den Nahrungspflanzen. Ebenfalls in Neuseeland sind Cermatulus nasalis und Oechalia schellenbergii aus der Familie der Baumwanzen (Pentatomidae), Polistes chinensis und Polistes humilis humilis aus der Familie Faltenwespen (Vespidae) in der Unterfamilie der Feldwespen (Polistinae) und die Fangschrecke Miomantis caffra als Prädatoren nachgewiesen.[58] Ein weiterer bedeutender Feind des Monarchfalters ist die ursprünglich in Ostasien heimische und in den nordöstlichen Teilen der Vereinigten Staaten eingeführte sowie ebenfalls zu den Fangschrecken zählende Große Chinesen-Mantis (Tenodera sinensis), die sich sowohl von dem Glykosiden der ausgewachsenen Falter nicht abschrecken lässt und die von den Raupen aufgenommenen Giftstoffe umgeht, indem sie die Magenregion der Raupe aufbeißt und die Verdauungsorgane aus der Raupe während des Fressvorgangs rausfallen lässt.
Wirbeltiere


Durch die Herzglykoside, die die Mehrzahl der Monarchfalter für Wirbeltiere ungenießbar macht, ist der Jagddruck durch Echsen, Frösche, Mäuse und Vögel relativ gering. Einige Vögel haben sich dennoch angepasst und können giftige Raupen und Falter fressen. Der Cayenne-Tyrann (Myiarchus tyrannulus), der zur Familie der Tyrannen zählt, frisst überwinternde Falter in Mexiko. Er reißt die Flügel ab, bevor er die Falter frisst.[59] Icterus galbula abeillei aus der Gattung der Trupiale und der Schwarzkopf-Kernknacker (Pheucticus melanocephalus) aus der Gattung der Kernknacker (Familie der Kardinäle) fressen eine bedeutende Menge Falter am Tag, so dass ihnen bei einer durchschnittlichen Überwinterungsdauer von 135 Tagen, etwa neun Prozent der Population zum Opfer fallen. Daneben fressen noch der Diademhäher (Cyanocitta stelleri) und der Scott-Trupial (Icterus parisorum) eine geringere Anzahl Falter. Ungeklärt ist, ob die Vögel männliche Tiere ihres geringen Giftgehalts oder größeren Fettgehalts wegen bevorzugt fressen.[60][61]
Auf Neuseeland sind etwa der Bronzekuckuck (Chrysococcyx lucidus lucidus), der Falter frisst, und der Glanzfleckdrongo (Dicrurus hottentottus), der Raupen frisst, als Feinde nachgewiesen.[52]
Auf der Hawaii-Insel Oʻahu fressen der Rotohrbülbül (Pycnonotus jacosus) und Rotsteißbülbül (Pycnonotus cafer) verstärkt die nur schwach giftigen, normal gefärbten Falter, was die weiße Form nivosus begünstigt und deren starkes Auftreten dort erklärt.
Mäuse sind in den mexikanischen Überwinterungsquartieren neben den Vögeln weitere bedeutende Jäger der Falter, denen etwa fünf Prozent zum Opfer fallen. Die Hirschmaus (Peromyscus maniculatus), Peromyscus spicilegus und die Mexikanische Wühlmaus (Microtus mexicanus) nehmen die Gifte durch ihren Magen und Darm nur schwach auf und können dadurch jede Nacht zusammen tausende Monarchfalter fressen.[62]
Schutz vor Feinden
Die Raupen können über ihre Nahrungspflanzen Herzglykoside, etwa Calactin, Calotropin und Eriocarpa, aufnehmen, die sie und die späteren Puppen und Falter für Wirbeltiere ungenießbar machen. Die auffällige Färbung von Raupen und Faltern darf also als Warntracht, als Aposematismus gedeutet werden. Vögel, die mit Herzglykosiden angereicherte Falter verzehren, erbrechen sich. Dieses Verhalten wurde beim Star (Sturnus vulgaris) und Blauhäher (Cyanocitta cristata bromia) beobachtet, der für etwa eine halbe Stunde ernsthaft krank wurde. Besonders viele Herzglykoside werden etwa über Asclepias curassavica (Calactin und Calotropin) und A. humistrata aufgenommen. Dagegen enthält Gonolobus rostratus keine Glykoside und die Falter sind für die Vögel genießbar, ebenso wie Falter deren Raupen an A. syriaca, A. tuberosa und A. incarnata fraßen, obwohl diese Pflanzen Glykoside enthalten. Die Raupen reichern einige der Glykoside, etwa Calactin, Calotropin und Eriocarpa, in ihrem Körper an und die Konzentration übersteigt die der Pflanzen deutlich. Dagegen werden die bedeutenden Glykoside Labriformadin und Labriformin von A. eriocarpa und Uscharidin von A. curassavica nicht angereichert, wobei Letzteres in Calactin und Calotropin umgewandelt wird.
Insgesamt reichern weibliche Falter mehr Glykoside an als männliche und die Konzentration nimmt von Süden nach Norden innerhalb der östlichen Sommerpopulation zu. Die Falter der westlichen Population weisen einen höheren Anteil genießbarer Falter auf als die der östlichen, sie erreichen aber höhere Spitzenwerte an Glykosiden.[63]
Forschung
1857 beschrieb der britische Naturforscher William Stewart Mitchell d’Urban, der zeitweise in Kanada lebte, zum ersten Mal wandernde Monarchfalter im Mississippital „such vast numbers as to darken the air by the clouds of them“ (in so großer Anzahl, dass sich die Luft durch ihre Wolken zu verdunkeln schien). Zehn Jahre später wurden zum ersten Mal große Ansammlungen auf Bäumen ruhender Monarchfalter beschrieben. Das Schauspiel in der Prärie des südwestlichen Iowa wurde von Allen mit den folgenden Worten beschrieben: „in such vast numbers, on the lee sides of trees, and particularly on the lower branches, as almost to hide the foliage, and give to the trees their own peculiar color“ (in so gewaltigen Mengen auf der Leeseite der Bäume, besonders auf den unteren Ästen, als ob sie das Laub verbergen und den Bäumen ihre eigene auffällige Farbe geben wollten). Dieses Verhalten wurde schon damals als Schutz vor dem Präriewind interpretiert und auch als Teil einer Südwanderung im Herbst.
Die US-amerikanischen Entomologen Benjamin Dann Walsh und Charles Valentine Riley veröffentlichten 1868 die ersten Beweise für die massiven Wanderungen der Monarchfalter. Riley beschrieb drei Jahre später die Biologie und Lebensweise des Monarchfalters und dessen Mimikry mit Limenitis archippus und begründete damit die Forschung über den Monarchfalter.
1881 wurden die Überwinterungsplätze der westlichen Population in Kalifornien entdeckt, die der Östlichen blieben noch fast 100 Jahre unentdeckt. Anfangs wurde vermutet, dass sie an der Golfküste überwintern, aber schon bald regten sich Zweifel. Heute steht fest, dass sie dort, aufgrund ihrer Frostempfindlichkeit bei den immer wieder auftretenden harten Frosten, nicht überleben können. Dies hatte der Amateur-Entomologe und Sekretär der Entomological Society of Ontario John Alston Moffat schon um die vorherige Jahrhundertwende richtig gefolgert.
Edward Bagnall Poulton, 1903–1904 Präsident der Royal Entomological Society of London, vermutete 1909, dass die Raupen des Monarchfalters sich von giftigen Seidenpflanzen ernähren, um sich damit vor Jägern zu schützen. Dies wurde erst 1965 von Parsons bestätigt, als er herausfand, dass die Cardenolide die Raupen und Falter giftig und bitter schmeckend machen.

Das Buch The Migration of Butterflies (1930) des britischen Entomologen Carrington Bonsor Williams spornte den Kanadier Frederick Urquhart an und 1937 markierte dieser die ersten Falter um mehr über ihre Wanderungen zu erfahren. Damals wurde vermutet, dass auch die Falter östlich der Rocky Mountains in Kalifornien überwintern, was er aber bezweifelte, da ihm deren Anzahl in Kalifornien zu gering erschien. Der Erfolg blieb zuerst aus. Er forschte weiter an verschiedenen Markierungsmethoden, bis er schließlich durch den Hinweis eines Freundes eine einfache und wetterbeständige Methode gefunden hatte. Die als Alar tag, vom lateinischen Alar für Flügel, bezeichneten, etwa 6 mal 12 Millimeter großen Aufkleber, waren ein Durchbruch für die Markierung von Schmetterlingen. Sie trugen die Aufschrift „Send to Zoology University of Toronto Canada“.
Seine Frau, mit der er zusammen ein Leben lang die Monarchfalter erforschte, schrieb 1952 einen Artikel über markierte Monarchfalter für ein Magazin. Dieser Beitrag enthielt einen Aufruf an Freiwillige, sie bei der Arbeit zu unterstützen. 12 Menschen antworteten und gründeten die International Migration Association. Die Urquharts lieferten die Materialien für die Kennzeichnung und schulten die Freiwilligen, 20 Jahre später zählte die Vereinigung schon über 600 Mitglieder mit tausenden Helfern. Diese markierten hunderttausende Falter und damit gelang es den Urquharts neue Erkenntnisse über diese zu erlangen. Es stellte sich heraus, dass die Falter an einem Tag bis zu 130 Kilometer weit flogen, aber nur bei Tageslicht, und dass sie Wind und offene Gewässer mieden. Die Flugrichtung der Falter ging vom Nordosten nach Südwesten und die Urquharts reisten nach Kalifornien und zum Golf von Mexiko, ohne jedoch die Überwinterungsquartiere zu finden.
1972 schrieb Nora mexikanische Zeitungen an und rief zur Mitarbeit bei der Suche nach den Faltern auf. Der amerikanische Ingenieur Ken Brugger aus Mexiko-Stadt fuhr daraufhin die nächsten Jahre in Mexiko auf der Suche nach Faltern umher. 1974 heiratete er Cathy und die beiden Schmetterlingsliebhaber suchten weiter. Sie fanden immer wieder tote Tiere und kamen den Überwinterungsquartieren immer näher. 1975 zeigten sie Holzfällern tote Tiere und diese zeigten ihnen schließlich den Weg zu den Quartieren der Monarchfalter am Cerro Pelón, 120 Kilometer westlich von Mexiko-Stadt. Danach riefen sie die Urquharts an und teilten ihnen mit, dass sie Millionen Falter gefunden hatten. Im folgenden Jahr reisten die Urquharts selbst nach Mexiko und besichtigten den Fundort. Der Boden war bedeckt mit Faltern und die Bäume hingen voll von ihnen. Ein Ast brach unter ihrem Gewicht ab, darunter befand sich ein Falter, der in Minnesota markiert wurde. Im selben Jahr veröffentlichte Frederick Urquhart einen Artikel im National Geographic und beschrieb die phänomenale Ansammlung überwinternder Monarchfalter.
Urquhart bezweifelte, dass die Falter den Flug über den Atlantik von Amerika nach Europa überleben könnten, da sie nur am Tag fliegen, nicht auf dem Wasser ruhen können, wie er nachwies, und die Strecke nicht an einem Tag bewältigt werden könnte. Er vermutete, dass die Falter, die immer wieder an Europas Küsten auftreten, als Raupen oder Puppen auf Schiffe kamen und in die Nähe der Küsten das Schiff verließen.[64] Es hat sich aber die Ansicht durchgesetzt, dass die Falter bei starken Stürmen tatsächlich über den Atlantik verdriftet werden können, da oft auch nordamerikanische Zugvögel zusammen mit den Faltern nach starken Stürmen an den europäischen Küsten gesichtet wurden.
Falter zu markieren ist sehr aufwendig und nur etwa ein Promille wird später gemeldet und ist über 100 Kilometer weit geflogen. Der US-amerikanische Zoologe Lincoln Pierson Brower untersuchte deshalb Anfang der 1980er Jahre Menge und Muster der Herzglykoside in den Faltern, die sie als Raupen aufgenommen hatten. Damit konnte er die Brutgebiete der Falter eingrenzen, da unterschiedliche Seidenpflanzengewächse durch verschiedene Glykoside in bestimmten Verhältnissen einen „Fingerabdruck“ haben und die Verbreitungsgebiete der einzelnen Arten unterschiedlich sind.[24]
Andere Forscher untersuchten den Orientierungssinn der Falter anhand des ihnen eigenen Sonnenkompasses und ihres Magnetsinns.[65]
Zahlreiche Initiativen zeichnen Daten über wandernde Monarchfalter auf, um noch mehr über ihre Lebensweise zu erfahren. Teilweise markieren sie Falter, wie etwa Monarch Watch (University of Kansas) und das Monarch Monitoring Project in New Jersey. Journey North beobachtet wandernde Tiere in Nordamerika, darunter auch den Monarchfalter.
Systematik
Nach der Erstbeschreibung 1758 als Papilio plexippus durch Linné anhand eines Falter aus Kendall, New York, USA, hat der Monarchfalter viele verschiedene taxonomische Einordnungen und Umgruppierungen erfahren. Dies führte zu einer Reihe von Gattungsnamen und Art … .Seitz ordnete ihn 1908 der Gattung Danais zu. Zwei Jahre später wurde er von Fruhstorfer Danaida (Anosia) archippux (Fabricius) genannt, während der Name plexippus lange für die heute als Danaus genutia benannte Art verwendet wurde. Zu dieser Zeit ist der Monarchfalter oft als archippus in der Literatur zu finden. 1939 ordnete Forbes den Falter der Gattung Danaus als D. (Danaus) erippus menippe (Hübner) und D. (Danaus) erippus megalippe (Hübner) zu, während im selben Jahr d’Almeida ihn als Diogas curassavicae (Fabricius) einordnete. Talbot verkürzte zwei Jahre später Talbots den Namen auf Danaus menippe (Hübner). Seit 1971 wird der noch heute gültige Name Danaus plexippus (L.) verwendet.[13]
Das Artepitheton leitet sich von Plexippos dem Sohn des Phineus und der Kleopatra ab und der Gattungsname kommt von Danaos (lateinisch Danaus), König von Argos im Peloponnes, der Vater der 50 Danaiden. Beide sind Teil der griechischen Mythologie.
Neben der wandernden Nominatform Danaus plexippus plexippus sind die folgenden Unterarten beschrieben:
- D. p. nigrippus (Haensch, 1909), verbreitet im nördlichen Südamerika über Mittelamerika bis Nicaragua.
- D. p. tobagi Clark 1941, verbreitet in Nordbrasilien, Guyana, Suriname, Französisch-Guayana und Trinidad und Tobago.
Auf den Antillen kommen drei Unterarten vor:
- D. p. megalippe (Hübner, 1826) dunkle Unterart, Antillen, Hybriden mit D. p. plexippus gibt es auf Espaniola, Puerto Rico. Die Raupen sind ebenfalls sehr dunkel, da das dunkle Band viel breiter ist als bei D. p. plexippus und fast den gesamten Platz des gelben Bandes einnimmt.
- D. p. portoricensis Clark 1941, die Unterart ist an den reduzierten oder fehlenden weißen Punkten an der Vorderflügelspitze zu erkennen.
- D. p. leucogyne (Butler, 1884)
Der Status der Unterarten ist nicht geklärt, teilweise leben sie in den gleichen Gebieten. Von keiner der Unterarten ist ein Wanderverhalten oder die Bildung von Kolonien bekannt.
Gefährdung und Schutz
Die Raupen sind primär an Seidenpflanzengewächse und davon besonders an die Gattung Seidenpflanzen als Nahrungsquelle gebunden. Wenn diese bekämpft werden, hat dies negative Auswirkungen auf die Populationsstärke. In den USA und Kanada werden die Seidenpflanzen teilweise als Unkraut betrachtet und mit Herbiziden, etwa am Straßenrand und auf landwirtschaftlichen Flächen, bekämpft. Für den Erhalt der natürlichen Vorkommen der Seidenpflanzen in Kanada und den USA setzte sich Fred Urquhart zusammen mit seiner Frau über viele Jahre ein, in einigen kanadischen Provinzen und den USA wurden und werden die Seidenpflanzen von Behörden noch immer als gesundheitsschädlich eingestuft. Trotzdem werden in vielen Blumengärten die Pflanzen wegen ihres Aussehens und Dufts angepflanzt.
In Mexiko und der Karibik gibt es teilweise den Aberglauben, dass Kühe durch Seidenpflanzen vergiftet werden. In Trinidad und Tobago werden die Seidenpflanzen deshalb als beklopptes Kraut bezeichnet. Tatsächlich ignorieren die Kühe die Pflanzen auf den Weiden und nehmen keinen Schaden. Trotzdem werden sie stellenweise bekämpft.[66]
Die Weltnaturschutzunion (IUCN) hat den Monarchfalter in ihr Wirbellosen-Rotbuch aufgenommen. Allerdings nicht als gefährdete Tierart, sondern als bedrohtes Naturphänomen – eine eigens hierfür geschaffene Kategorie.[67] Auch wenn noch viele Millionen Monarchfalter im östlichen Nordamerika leben, dienen die Schutzmaßnahmen dem Ziel, einen weiteren Verlust einer wandernden Tierart in Nordamerika zu verhindern, nachdem die Wandertaube (Ectopistes migratorius) und die Felsengebirgsschrecke (Melanoplus spretus) seit über 100 Jahren ausgestorben sind.[50]
Kanada
Der Monarchfalter steht in Kanada unter dem Schutz des Federal Species at Risk Act (SARA) und The Committee on the Status of Endangered Wildlife in Canada (COSEWIC), jeweils in der Kategorie Special Concern. Long Point und Prince Edward Point im Prince Edward County (Ontario) und der Point-Pelee-Nationalpark in Essex County, Ontario, sind als Schutzgebiete des Monarchfalters ausgezeichnet, Letzteres ist außerdem seit 1995 durch den Canada National Parks Act geschützt.[68]
USA
Einige Überwinterungsplätze in Kalifornien sind durch den Landverbrauch gefährdet, andere im Staat, den Countys und öffentlichen Parks sind geschützt. In Pacific Grove etwa schon seit 1938. Der Parasit Ophryocystis elektroscirrhas wurde erst bei Versuchen mit Faltern aus dem Osten in die westliche Population eingeschleppt und stellt eine relativ neue Bedrohung dar.
Die Gefahr, die von Transgenem Mais ausgeht, ist entgegen ersten Befürchtungen sehr gering. Ab 1000 Pollen/cm² setzt eine toxische Wirkung bei den Raupen ein. Die Pollenkonzentration auf den Seidenpflanzen liegt selbst zur Hauptblütezeit des Getreides in unmittelbarer Nähe der Felder nur zwischen 50 und 170 Pollen/cm².[69]
Eine große Gefahr stellt eine Umstellung der Landwirtschaft von Getreide zu Soja, die die Bedingungen für die Seidenpflanzen verschlechtert. Der Einsatz von Herbiziden vernichtet im Frühjahr die jungen Seidenpflanzen in den Hauptbrutgebieten am Rand der Felder. Zusätzlich werden Nektarquellen für die Falter vernichtet.[50]
Die Organisationen, die Daten über Monarchfalter sammeln, setzen sich auch für seinen Schutz ein. Die Xerces Society, die keine Daten über die Wanderungen sammelt, setzt sich besonders für den Schutz der westlichen Population ein.
2016 gab der WWF bekannt, dass sich die Population des amerikanischen Monarchfalters „spürbar erholt“ habe. Im Winterquartier in Zentralmexiko seien fast vier Mal so viele Schmetterlinge wie im Jahr zuvor angekommen. Allerdings zeige der Trend für den Monarchfalter global trotzdem nach unten.[70]
Mexiko
Besonders gefährdet ist der Falter durch die Konzentration der östlichen nordamerikanischen Population während der Wintermonate auf wenige Hektar in Mexiko.[71] Diese Überwinterungsgebiete sind durch illegalen Holzeinschlag stark bedroht. In Mexiko wurden 1980 alle Überwinterungsstellen per präsidialem Erlass geschützt, ohne jedoch die Gebiete zu definieren. 1986 wurde ein über 16.000 Hektar großes Schutzgebiet ausgewiesen. Ende 2000 wurde das Monarch Butterfly Biosphere Reserve (MBBR) auf über 56.000 Hektar vergrößert, wovon über 13.000 Hektar auf den Kernbereich entfallen. Das Land im Schutzgebiet gehört 59 Ejidos, 13 indigenen Gemeinden und 21 Privatbesitzern. Die von der Vergrößerung betroffenen Gemeinden werden durch den im selben Jahr gegründeten Monarch Butterfly Conservation Fund (MBCF) wirtschaftlich unterstützt, für entfallene Holzeinschlagrechte werden Entschädigungen gezahlt. Der Fund wird von privaten Spenden aus den USA, durch die mexikanische Bundesregierung und die Regierungen der Bundesstaaten México und Michoacán finanziert. Der World Wildlife Fund und der Mexican Fund for Nature Conservancy verwalten den MBCF zusammen. Die größte Gefahr für das MBBR ist die illegale Abholzung, allein zwischen 2001 und 2003 wurden 370 Hektar in der Pufferzone (Francisco Serrato y Emiliano Zapata ejido) und 140 Hektar im Kernbereich gefällt. Von staatlicher Seite erfahren die vom illegalen Holzeinschlag betroffenen Gemeinden fast keine Unterstützung. Sie versuchen in Eigeninitiative Gräben auszuheben, um den Abtransport von Holz zu verhindern, wobei nur mit schwerem Gerät angelegte große Gräben mit mehreren Metern Breite und Tiefe eine etwas längerfristige Wirkung zeigen. Kleine Gräben, die mit Hacke und Schaufel angelegt werden, sind bald wieder zugeschüttet.
Das Schutzgebiet umfasst den Cerro Altamirano (3320 Meter über N.N.), den Cerro Pelón (3500 m), die Sierra Chincua und die Sierra el Campanario (3640 m) und den Cerros Chivatí-Huacal (3180 m) in der Sierra Chivati in Michoacán. Außerhalb des Schutzgebiets befinden sich Palomas, Piedra Herrada und San Francisco Oxtotilpan im Bundesstaat México und San Andres, Pizcuaro, Puerto Morillo und Puerto Bermeo in Michoacán. In Chivatí-Huacal überwintern seit den starken Abholzungen Ende der 1980er Jahre keine Monarchfalter mehr, am Cerro Pelón wurden alle Hänge bis auf einige Südhänge innerhalb von zehn Jahren so stark abgeholzt, dass nur noch wenige Falter überwintern.[41][72]
Anfang 2020 wurden innert weniger Tage zwei Umweltschützer ermordet, welche sich für die Monarchen-Schutzgebiete engagiert hatten.[73]
Eine weitere Gefahr für die Falter ergibt sich durch den zunehmenden Straßenverkehr. Untersuchungen an den mexikanischen Autobahnen Mex-057 und Mex-40D, über die die Wanderroute der Falter führt, ergaben eine große Anzahl an toten Exemplaren am Straßenrand. Nach Hochrechnungen im Herbst 2018 sind dort 196.500 Falter dem Verkehr zum Opfer gefallen. Da die wandernden Falter etliche weitere Straßen passieren und bei schlechter Wetterlage sehr niedrig fliegen, dürfte die Todesrate dann weiter ansteigen.[74]
Kulturgeschichte
Die Ankunft der Monarchfalter in Michoacán fällt mit dem Día de Muertos (Tag der Toten) zusammen, an dem traditionell in Mexiko der Verstorbenen gedacht wird. Schon vor der Ankunft der Europäer in Amerika symbolisierten die in Massen auftretenden Falter für die Ureinwohner die Rückkehr der Seelen ihrer Vorfahren.[75]
Der Monarchfalter wurde im 17. Jahrhundert nach Wilhelm III. (1650–1702), König von England, Schottland und Irland benannt. Dieser war gebürtiger Prinz des Fürstentum Orange in Frankreich. Die frühen Siedler nannten den Falter King Billy. Er hatte im Laufe der Zeit noch viele andere Namen, etwa Milkweed Butterfly, Storm King und The Wanderer, Letzterer ist in Australien heute noch gebräuchlich.
Der Monarch ist Staatsinsekt in Alabama, Idaho, Illinois, und Texas, und der Staatsschmetterling von Minnesota, Vermont und West Virginia. 1989 war er für das nationale Insekt der Vereinigten Staaten von Amerika nominiert und er ist das nationale Insekt von Kanada.
An den Überwinterungsplätzen in Kalifornien und deutlich später in Mexiko hat sich der Tourismus entwickelt. In Kalifornien gibt es Motels mit Namen wie etwa Butterfly Trees Lodge und Monarch Lodge. Souvenirs mit Schmetterlingen, etwa Broschen und Anstecknadeln, ebenso wie präparierte Falter, werden angeboten. In Pacific Grove gibt es zur Ankunft der Falter im Herbst ein Fest mit einem Umzug mit Kindern in bunten Kostümen, die Schmetterlinge symbolisieren sollen. Der touristisch erschlossene Überwinterungsplatz Rosario in der Sierra Campanario leidet unter dem illegalen Holzeinschlag in seiner Umgebung. Das Gebiet war 2001/202 nur schwach besucht und 2003/2004 und 2004/2005 ganz verlassen.[50]
Neben zahlreichen Initiativen zur Beobachtung und zum Schutz der Falter gibt es etwa das Monarch Lab der University of Minnesota, das Schüler und Lehrer mit ihrer Initiative Monarchs in the Classroom (Monarchfalter im Klassenzimmer) anspricht. Es versucht Wissen über die Ökologie, die Lebensweise und die Entwicklung der Monarchfalter zu vermitteln und Schüler für das Thema zu begeistern.
Francisco „Vico“ Gutiérrez begleitete im Jahr 2005 72 Tage lang Monarchfalter auf ihrem Zug von Kanada nach Mexiko mit seinem Ultraleichtflugzeug Papalotzin (von Nahuatl (Aztekisch) Papalotl für Schmetterling und tzin für königlich). Auf seinem 4375 Meilen langen Flug wurde er von Fotografen und Filmemachern begleitet. Sie filmten die gesamte vom World Wildlife Fund, Telcel und dem Bundesstaat Michoacán finanzierte Reise und planten daraus eine einstündige Dokumentation zu machen. Auf der Reise machten sie immer wieder Halt und sprachen mit bekannten Lepidopterologen und Biologen über die Gefahren für die Monarchfalter.[76] Der Film ist 2007 unter dem Titel Papalotzin – The Journey of The Monarch Butterfly auf DVD in englischer und spanischer Sprache erschienen.[77][78]
Über den Monarchfalter wurden viele populärwissenschaftliche Bücher veröffentlicht und er ist auch das Thema zahlreicher Kinderbücher, wie etwa das zweisprachige Buch (englisch und spanisch) Madalynn the Monarch Butterfly and Her Quest to Michoacan / Madalynn La Mariposa Monarca y Su Aventura Por Michoacan oder Hurry and the Monarch, ein Kinderbuch mit einer Schildkröte, die sich in Texas mit einem Monarchfalter anfreundet und mehr über dessen Leben erfährt.
Der Film Son of Monarchs (2020) schildert einen mit dem Monarch befassten Entomologen.
Literatur
Verwendete Literatur
- Urquhart, Frederick Albert: The Monarch Butterfly: International Traveler. Nelson Hall Publishers, Chicago, USA 1987, ISBN 978-0-8304-1039-2, S. 232.
- Karen S. Oberhauser, Michelle J. Solensky (Hrsg.): The Monarch Butterfly: Biology and Conservation. Cornell University Press, Ithaca and London 2004, ISBN 0-8014-4188-9, S. 248.
- Richard Irwin Vane-Wright & P. R. Ackery (Hrsg.): Milkweed Butterflies. Their Cladistics and Biology. Cornell University Press, Ithaca and London 1984, ISBN 978-0-8014-1688-0, S. 425.
- Williams, Carrington Bonsor: Die Wanderflüge der Insekten: Einführung in das Problem des Zugverhaltens der Insekten unter besonderer Berücksichtigung der Schmetterlinge. Paul Parey, Hamburg, Berlin 1961, S. 232.
Weiterführende Literatur
- Anurag A. Agrawal: Monarchs and Milkweed. A Migrating Butterfly, a Poisonous Plant, and their Remarkable Story of Coevolution. Princeton University Press, Princeton, New Jersey, USA 2017, ISBN 978-0-691166353.
- Stephen B. Malcolm, Myron P. Zalucki (Hrsg.): Biology and Conservation of the Monarch Butterfly. Natural History Museum of Los Angeles County, 1993, ISBN 978-99940-0-921-3.
- A field guide to monarch caterpillars (Danaus plexippus). In: Karen Oberhauser (Hrsg.): Evolution and Behavior. Department of Ecology, University of Minnesota, 1997.
- Williams, Carrington Bonsor: The Migration of Butterflies. Oliver & Boyd, Edinburgh, UK 1930, S. 473.
- Williams, Carrington Bonsor: Insect Migration. In: The New Naturalist. Band 36. Collins, London, UK 1958, S. 237.
Weblinks
- Monarch Lab – Biologie und Wanderverhalten (englisch)
- Butterflies and Moths of North America – Monarch
- Monarch Larva Monitoring Project (englisch)
- Monarch Watch (englisch)
- The Journey North (englisch)
- Bericht über die Ernährung von Monarchfaltern seitens der Großen Chinesen-Mantis aus der Seite von National Geographic (Link)
- Spektrum.de: Gefangene Monarchfalter verlieren ihren Kompass 25. Juni 2019
Einzelnachweise
- Badische Zeitung, 11. Februar 2014, Sandra Weiss: badische-zeitung.de: Die Population der mexikanischen Monarchfalter schrumpft (20. Februar 2014)
- Vane-Wright & Ackery (1984), S. 77
- Michael Boppré: The American Monarch: Courtship and chemical communication of a peculiar Danaine butterfly. In: S. B. Malcom & M. P. Zalucki (Hrsg.): Biology and Conservation of the Monarch Butterfly. Natural History Museum of Los Angeles County, Los Angeles 1993 (fzi.uni-freiburg.de [PDF; 3,0 MB; abgerufen am 26. September 2008]).
- Lawrence Gibbs and Orley R. Taylor: Reading Room - Articles : The White Monarch. monarchwatch.org, Juni 1998, abgerufen am 2. März 2008 (englisch).
- Urquhart (1987), S. 64ff
- Urquhart (1987), S. 15ff
- Felipe Gil-T.: A new hostplant for Danaus plexippus (LINNAEUS, 1758) in Europe. A study of cryptic preimaginal polymorphism within Danaus chrysippus (LINNAEUS, 1758) in southern Spain (Andalusia). In: Atalanta. Band 37, Nr. 1, 2006, ISSN 0171-0079, S. 143–149 (researchgate.net [PDF; 317 kB; abgerufen am 21. September 2008]).
- Smith, David A. S.; Lushai, Gugs & Allen, John A.: A classification of Danaus butterflies (Lepidoptera: Nymphalidae) based upon data from morphology and DNA. In: Zoological Journal of the Linnean Society. Band 144, Nr. 2, 2005, S. 191–212, doi:10.1111/j.1096-3642.2005.00169.x.
- Williams (1961), S. 26
- Vane-Wright & Ackery (1984), S. 46
- David B. Ritland: Mimicry-Related Predation on Two Viceroy Butterfly (Limenitis archippus) Phenotypes. In: University of Notre Dame (Hrsg.): American Midland Naturalist. Band 140, Nr. 1. Notre Dame Juli 1998, S. 1–20, JSTOR:2426983.
- Tree of life
- Vane-Wright & Ackery (1984), S. 202
- Stephen Pawson & Lisa Berndt: Observations of Monarch butterfly overwintering behaviour in Christchurch. In: New Zealand Entomologist (Hrsg.): The Weta. Band 27, Nr. 1, 2004, S. 22 (ento.org.nz [PDF; 200 kB; abgerufen am 2. März 2008]).
- R.I. Vane-Wright & R. de Jong: The butterflies of Sulawesi: annotated checklist for a critical island fauna. In: Zool. Verh. Band 343. Leiden 2003, ISBN 90-73239-87-7, S. 1–16 (Online [PDF; 3,6 MB; abgerufen am 28. Februar 2008]).
- V.C. Neves, J.C. Fraga, H. Schäfer, V. Viera, A. Bívar de Sousa & P.V. Borges: The occurence of the Monarch butterfly, Danaus plexippus L. in the Azores, with a brief review of its biology. In: Universität der Azoren (Hrsg.): Arquipélago – Life and Marine Sciences. 18a, 2001, ISSN 0873-4704, S. 17–24 (horta.uac.pt [PDF; abgerufen am 28. Februar 2008]).
- M. Wiemers: The butterflies of the Canary Islands. - A survey on their distribution, biology and ecology (Lepidoptera: Papilionoidea and Hesperioidea). In: Linn. belg. Band 15, 1995, S. 63–84, 87–118 (researchgate.net [abgerufen am 14. Oktober 2012]).
- J. Fernández Haeger, D. Jordano & M. León Meléndez: Status and conservation of Asclepiadaceae and Danaus in southern Spain. In: J. Insect Conserv. Band 15, 2011, S. 361–365, doi:10.1007/s10841-010-9354-7.
- Urquhart (1987), S. 107ff
- Urquhart (1987), S. 140ff
- Zalucki, Myron P. and Clarke, Anthony R.: Monarchs across the Pacific: the Columbus hypothesis revisited. In: The Linnean Society of London (Hrsg.): Biological Journal of the Linnean Society. Band 82, Nr. 1. Blackwell Publishing, 2004, S. 111–121, doi:10.1111/j.1095-8312.2004.00322.x.
- Urquhart (1987), S. 70
- Oberhauser & Solensky (2004), S. 90
- Lincoln P. Brower: Monarch Butterfly Orientation: Missing Pieces Of A Magnificent Puzzle. In: The Journal of Experimental Biology. Band 199. The Company of Biologists Limited, 1996, S. 93–103 (jeb.biologists.org [PDF; 280 kB; abgerufen am 19. September 2008]).
- Urquhart (1987), S. 74
- Vane-Wright & Ackery (1984), S. 75ff
- Vane-Wright & Ackery (1984), S. 78
- Oberhauser & Solensky (2004), Kapitel 1, S. 3ff
- Steven M. Reppert und Jacobus C. de Roode: Demystifying Monarch Butterfly Migration. In: Current Biology. Band 28, Nr. 17, S. R1009–R1022, 2018, doi:10.1016/j.cub.2018.02.067.
- I. Sauman, A. D. Briscoe, H. Zhu, D. Shi, O. Froy, J. Stalleicken, Q. Yuan, A. Casselman, S. M. Reppert: Connecting the navigational clock to sun compass input in monarch butterfly brain. In: Neuron. Band 46, Nummer 3, Mai 2005, S. 457–467, ISSN 0896-6273. doi:10.1016/j.neuron.2005.03.014. PMID 15882645.
- Jason A. Etheredge, Sandra M. Perez, Orley R. Taylor & Rudolf Jander: Monarch butterflies (Danaus plexippus L.) use a magnetic compass for navigation. In: Proceedings of the National Academy of Sciences (PNAS). Band 96, Nr. 24, 1999, S. 13845–13846 (pnas.org [PDF; 60 kB; abgerufen am 27. September 2008]).
- Heather R. Mattila & Gard W. Otis: A comparison of the host preference of monarch butterflies (Danaus plexippus) for milkweed (Asclepias syriaca) over dog-strangler vine (Vincetoxicum rossicum). In: Entomologia Experimentalis et Applicata. Band 107. Blackwell Publishing, 2003, S. 193–199, doi:10.1046/j.1570-7458.2003.00049.x (HTML [PDF; abgerufen am 21. September 2008]).
- Caterpillar Food Sources. Monarch Butterfly NZ Trust, abgerufen am 19. Februar 2008 (englisch).
- Urquhart (1987), S. 41
- Vane-Wright & Ackery (1984), S. 98
- Urquhart (1987), S. 161
- Urquhart (1987), S. 169f
- Urquhart (1987), S. 92
- Oberhauser & Solensky (2004), S. 79
- Urquhart (1987), S. 138
- WWF Mexico (Hrsg.): Illegal logging and its impact in the Monarch butterfly Biosphere Reserve. 2004 (eco-index.org [PDF; abgerufen am 1. März 2008]). www.eco-index.org (Memento vom 10. Juli 2007 im Internet Archive)
- Urquhart (1987), S. 163ff
- Migration & Tagging. monarchwatch.org, abgerufen am 2. März 2008 (englisch).
- Monarch Grove Sanctuary – Every Year, Over 25,000 Monarchs Overwinter in Pacific Grove. (Nicht mehr online verfügbar.) City of Pacific Grove, 1998, archiviert vom Original am 28. Februar 2008; abgerufen am 19. Februar 2008 (englisch).
- Oberhauser & Solensky (2004), Kapitel 22, S. 177ff
- Oberhauser & Solensky (2004), Kapitel 26, S. 219
- G. W. Ramsay: Overwintering swarms of the Monarch butterfly (Danaus plexippus (L.)) in New Zealand. In: New Zealand Entomologist (Hrsg.): New Zealand Entomologist. Band 3, Nr. 3, 1964, S. 10–16 (ento.org.nz [PDF; abgerufen am 2. März 2008]). www.ento.org.nz (Memento vom 23. Oktober 2007 im Internet Archive)
- Oberhauser & Solensky (2004), Kapitel 20, S. 151ff
- Shawna Stevens, Dennis Frey: How The Other Half Lives – Monarch Population Trends West Of The Great Divide. (PDF; 137 kB) Biological Sciences Department, California Polytechnic State University, 23. Juli 2004, S. 3, abgerufen am 14. August 2008 (englisch).
- Reduced numbers of monarch butterflies overwintering in Mexico during the 2004-2005 season: evidence, possible causes and recommendations. (PDF; 130 kB) Informally Constituted Monarch Butterfly Scientific Advisory Committee (ICMBSAC), abgerufen am 11. September 2008 (englisch).
- La migración de la mariposa Monarca en riesgo de desaparecer. WWF Mexico, abgerufen am 14. Januar 2014 (spanisch).
- Milkweed Butterflies, S. 97
- Patent US4425331A: Biological control. Angemeldet am 13. Oktober 1981, veröffentlicht am 10. Januar 1984, Erfinder: Joseph N. Concannon.
- Catherine A. Bradley, Sonia Altizer: Parasites hinder monarch butterfly flight: implications for disease spread in migratory hosts. In: Ecology Letters. Band 8, Nr. 3. Blackwell Publishing, März 2005, ISSN 1461-023X, S. 290–300.
- Karen Oberhauser, O. R. Taylor, Sonia Altizer, Danel Vickerman: Biology / Parasite Control : Ophryocystis elektroscirrha. monarchwatch.org, abgerufen am 2. März 2008 (englisch).
- Karen Oberhauser, Ilse Gebhard, Charles Cameron & Suzanne Oberhauser: Parasitism of Monarch Butterflies (Danaus Plexippus) by Lespesia Archippivora (Diptera: Tachinidae). In: University of Notre Dame (Hrsg.): The American Midland Naturalist. Band 157, Nr. 2, April 2007, ISSN 0003-0031, S. 312–328 (mlmp.org [PDF; abgerufen am 3. März 2008]).
- Oberhauser & Solensky (2004), Kapitel 6, S. 47ff
- Corinne H. Watts: Predation of monarch butterfly larvae by ants. In: New Zealand Entomologist (Hrsg.): The Weta. Band 22, Nr. 1, 1999, S. 21–21 (web.archive.org [PDF; 356 kB; abgerufen am 7. Oktober 2021]).
- Urquhart (1987), S. 165
- Lincoln P. Brower & William H. Calvert: Foraging Dynamics of Bird Predators on Overwintering Monarch Butterflies in Mexico. (GIF) In: Evolution. 1985, S. 852, abgerufen am 5. September 2008 (englisch).
- Linda S. Fink, Lincoln P. Brower, Robert B. Waide & Paul R. Spitzer: Overwintering Monarch Butterflies as Food for Insectivorous Birds in Mexico. (GIF) In: Biotropica. 1983, S. 151, abgerufen am 5. September 2008 (englisch).
- Lincoln P. Brower, B. Elizabeth Horner, Melanie A. Marty, Christine M. Moffitt & Bernardo Villa-R.: Mice (Peromyscus maniculatus, P. spicilegus, and Microtus mexicanus) as Predators of Overwintering Monarch Butterflies (Danaus plexippus) in Mexico. (GIF) In: Biotropica. 1985, S. 89, abgerufen am 5. September 2008 (englisch).
- Milkweed butterflies, S. 81
- Urquhart (1987), S. 145
- Steven M. Reppert und Jacobus C. de Roode: Demystifying Monarch Butterfly Migration. In: Current Biology. Band 28, Nr. 17, S. R1009–R1022, 2018, doi:10.1016/j.cub.2018.02.067.
- Urquhart (1987), S. 5f
- Markus Kappeler: Monarchfalter – Danaus plexippus. 1998, abgerufen am 19. Februar 2008.
- Monarch. (Nicht mehr online verfügbar.) In: Species at risk. Canadian Wildlife Service, 2. März 2008, archiviert vom Original am 7. April 2006; abgerufen am 2. März 2008 (englisch).
- Q&A: Bt Corn and Monarch Butterflies. United States Department of Agriculture – Agricultural Research Service, 29. April 2004, abgerufen am 10. September 2008 (englisch).
- Flatterhafter Aufschwung. WWF Deutschland, 1. März 2016, abgerufen am 30. Juni 2016.
- Mexiko: Forscher bangen um Monarchfalter. In: Spiegel Online. Abgerufen am 30. Juni 2016.
- More Than Monarchs (Memento vom 9. Januar 2010 im Internet Archive)
- Mexiko: Zweiter Schmetterlings-Schützer ermordet, AFP, 4. Februar 2020: https://www.afp.com/en/news/826/second-mexican-butterfly-conservationist-found-dead-doc-1op2012
- Blanca Xiomara Mora Alvarez, Rogelio Carrera-Treviño & Keith A. Hobson: Mortality of Monarch Butterflies (Danaus plexippus) at Two Highway Crossing “Hotspots” During Autumn Migration in Northeast Mexico In: Frontiers Ecology and Evolution, 2019 doi:10.3389/fevo.2019.00273
- Clare Brown, Karen Brown, Jane Stevenson Day: Karen Brown’s Mexico. Karen Brown’s Guides, 2006, ISBN 978-1-933810-10-2, S. 190.
- WWF: Monarch butterflies arrive in Mexico for winter hibernation vom 3. November 2005
- http://www.indieflix.com/Films/PapalotzinFlightoftheMonarchButterfly
- http://www.whosyourmama.org/Films2008.htm