Transgener Mais
Als Transgener Mais (Genmais, Gv-Mais) wird gentechnisch veränderter Mais bezeichnet.
Bei transgenen Maissorten werden bestimmte Gene aus anderen Organismen in das Mais-Genom eingeschleust, mit dem Ziel, bei Bt-Mais die Bekämpfung von Schadinsekten zu verbessern sowie bei herbizidresistentem Mais oder herbizidtolerantem Mais die Unkrautkontrolle zu erleichtern.
Wie andere Anwendungen der Grünen Gentechnik ist auch transgener Mais vor allem in der europäischen Öffentlichkeit umstritten. Teile der Wissenschaft sowie Vertreter aus Politik und Industrie weisen auf Ertrags- und Einkommenssteigerungen, Verminderung von Pestizideinsätzen und damit verbunden geringere Umweltbelastungen hin. Vertreter aus Umwelt- und Verbrauchergruppen, politischen Parteien sowie einige Fachleute gehen von ökologischen und gesundheitlichen Risiken aus. Mögliche Gesundheits- und Umweltrisiken sind insbesondere in der EU und in Deutschland Gegenstand jahrelanger Kontroversen. In mehreren EU-Staaten, darunter Deutschland, ist der Anbau von transgenem Mais verboten. Als Begründung wurden von politischen Entscheidungsträgern insbesondere potenzielle Umweltrisiken genannt.
Es ist allerdings weitgehender wissenschaftlicher Konsens, dass transgener Mais nicht mit höheren Gesundheitsrisiken behaftet ist als Mais aus konventioneller Züchtung.[1][2][3]
Gentechnische Ziele
Je nach gewünschter Eigenschaft können die Pflanzen folgende Merkmale (auch in Kombination) aufweisen:
- Resistenz gegen Breitbandherbizide (wie z. B. Roundup), um die Unkrautbekämpfung zu erleichtern.
- Insektenresistenz (z. B. gegenüber dem Maiswurzelbohrer oder Maiszünsler)
- Resistenz gegen verschiedene Schadinsekten durch Einbringen von Bt-Toxinen, die für bestimmte Insektenarten tödlich sind (Bt-Mais).
- Als erster Vertreter dieser Zielgruppe von Gv-Pflanzen überhaupt wird Trockentoleranter Mais gezüchtet.
- Das Ziel der Forschung hierbei ist zum Beispiel ein besserer Aufschluss der Maisstärke und damit mehr Effektivität bei der Herstellung von Bioethanol oder verbesserte Futtereigenschaften.
Überblick zu gentechnisch veränderten Maissorten
Es gibt weltweit hunderte gentechnisch veränderte Maissorten. Die Non-Profit-Organisation International Service for the Acquisition of Agri-Biotech Applications (ISAAA) klassifiziert sie nach dem Transformationsereignis (Event) und registriert, in welchen Ländern sie zugelassen sind. Diese Datei[4] nennt (Stand März 2021) 148 Events für Maize - Zea mays L. Im März 2018 nannte die Datei für Mais insgesamt 231 Events; häufig waren mehrere Eigenschaften in einem Event kombiniert (Stacked Events). Unter den kommerziellen Sorten betrafen am meisten Events Herbizidtoleranz mit 203 Events, gefolgt von Insektenresistenz (202), veränderter Produktqualität (12), Trockentoleranz (6), Bestäubungskontrolle (6) und vergrößerter Kolben (1).[5]
| Markenname | Event | Herbizidtoleranz | Herbizidtoleranz | Insektenresistenz-Gene |
|---|---|---|---|---|
| Glyphosat | Glufosinat | |||
| Agrisure GT | GA21 | + | ||
| RoundUp Ready 2 | NK603 | + | ||
| Liberty Link | T25 | + | ||
| Herculex | TC1507 | + | Cry1F | |
| Agrisure RW | MON810* | Cry1Ab | ||
| YieldGard™ Rootworm RW | MON863 | Cry3Bb1 | ||
| Agrisure CB/LL | Bt11 | + | Cry1Ab | |
| Maximizer™ | Bt176 | + | Cry1Ab | |
| Agrisure GT/CB/LL | Bt11 + GA21 | + | + | Cry1Ab |
| SmartStax | MON88017+MON89034+DAS59122-7+TC1507 | + | + | Cry3Bb1+Cry1A.105+Cry2Ab2+Cry34Ab1+Cry35Ab1+Cry1F |
| Agrisure Viptera 3220 | Bt11 + GA21 + MIR162 + TC1507 | + | + | Cry1Ab+Vip3Aa20+Cry1F |
Herbizidtoleranter Mais
Um die Unkrautbekämpfung beim Anbau von Mais zu erleichtern, wurden Resistenzgene gegen Herbizide in das Genom des Mais integriert. Zunächst wurde von der Firma Monsanto die Glyphosatresistenz eingebracht, so dass der Gv-Mais RoundUp Ready 2 (Event NK603) gegen Glyphosat (Markenname Roundup) resistent ist. Die Firma Bayer AG setzte das Resistenzgen gegen Glufosinat ein, um eine Resistenz gegen Glufosinat (Markenname Liberty) zu erreichen. Dieser transgene Mais wird als Liberty Link (Event T25) vermarktet.
Da nach einigen Jahren gewisse Unkräuter gegen diese Herbizide resistent wurden, sind einzelne Maissorten entwickelt worden, die gleichzeitig Resistenzen gegen Glyphosat und Glufosinat enthalten. Da teilweise auch Unkräuter auftauchten, die sowohl gegen Glyphosat als auch Glufosinat resistent sind, wurden auch andere Resistenzgene in Maispflanzen eingebracht. Im Jahr 2017 sind die Maissorten Optimum™ GAT™ und Enlist™ zum Anbau zugelassen, die resistent gegen die Herbizide Sulfonylharnstoffe bzw. 2,4-Dichlorphenoxyessigsäure sind.[8]
Bt-Mais

Um Fraßschäden durch Insekten am Mais zu vermeiden, wurde Gv-Mais entwickelt, der insektenresistent ist. Hierzu wurden Gene des Bakteriums Bacillus thuringiensis eingeschleust. B. thuringiensis ist ein weltweit verbreitetes Bodenbakterium, dessen Unterarten über 200 verschiedene Proteine (Bt-Toxine) produzieren, die jeweils spezifisch auf die Larven bestimmter Insektenarten der Ordnungen Käfer, Schmetterlinge, Zweiflügler und Hautflügler sowie Nematoden tödlich wirken.[9] Hierunter fallen wichtige Mais-Schädlinge wie der Maiszünsler (Ostrinia nubilalis), der westliche Maiswurzelbohrer (Diabrotica virgifera) und die Ypsiloneule (Agrotis ipsilon). In Nord- und Südamerika treten zusätzlich der Herbst-Heerwurm (Spodoptera frugiperda), der Westliche Bohnenschneider (Striacosta albicosta, engl. Western Bean Cutworm) und der Stalk Borer (Papaipema nebris) auf. Die genveränderte Pflanze bildet eine zunächst ungiftige Vorstufe des Toxins (Protoxin). Erst im Darm bestimmter Insekten wird es in die aktive Form umgewandelt. Dieses Toxin bindet an bestimmte Rezeptoren der Darmwand des Insekts und beginnt diese zu zersetzen, was zum Hungertod führt. Bt-Toxine gelten als harmlos für Menschen, Wirbeltiere und Pflanzen. Sie sind biologisch abbaubar, werden aber über die Wurzel in den Boden abgegeben. Studien kamen zu unterschiedlichen Ergebnissen hinsichtlich der Abbaugeschwindigkeit (wenige Tage bis mehrere Monate), die in erster Linie von verschiedenen Bodeneigenschaften abhängt.[10] B-Toxine werden als Präparate (Suspensionen) seit Jahrzehnten im biologischen Pflanzenschutz eingesetzt und sind auch im Ökolandbau zugelassen, zum Beispiel gegen den Maiszünsler unter dem Handelsnamen Dipel ES.[11]
Die konstante Präsenz des Protoxins in der Pflanze unterscheidet sich von der periodischen Anwendung von biologischen oder chemischen Insektiziden dahingehend, dass die Schadinsekten dem Gift ständig ausgesetzt sind. Ein weiterer Unterschied gegenüber der Verwendung von Bt-Suspensionen besteht darin, dass Schädlinge das Gift direkt mit ihrer Nahrung (Maispflanze) fressen, anstatt dass sie die Suspension separat aufnehmen. Bt-Mais besitzt somit im Vergleich zu konventionellem Mais, der mit chemischen Insektiziden besprüht wird, eine erhöhte Präzision, da Schädlinge gezielter bekämpft werden und Nichtzielorganismen, die sich nicht vom Mais ernähren, nicht betroffen sind.[9]
Bekannte Anbieter von Bt-Mais sind Monsanto, Syngenta, Pioneer Hi-Bred und Corteva.
Im Jahr 2002 sind erste Daten zu Resistenzen gegen Bacillus thuringiensis-Toxine aufgetaucht und 2016 waren schon zwölf unabhängige Fälle beschrieben, bei denen Maisschädlingen gegen bestimmte Bt-Toxine resistent waren.[12] Um die Resistenzentwicklung gegen die Bt-Toxine zu überspielen, wurden zunächst mehrere Bt-Toxine gleichzeitig eingesetzt.[13] So enthält SmartStax von Monsanto sechs verschiedene Bt-Toxine. Da dieser Ansatz nur teilweise erfolgreich war, wurden auch ganz andersartige Toxine aus Bacillus thuringiensis, die sogenannte Vip-Proteine, eingesetzt, die über einen anderen Rezeptor der Darmwand der Insekten wirken.[14] Auch diese Bt-Toxine werden häufig mit mehreren anderen Bt-Toxinen kombiniert, beispielsweise in der Maissorte Agrisure Viptera 3220.
RNA-Interferenz
Ein ganz anderer Ansatz, um die Resistenzentwicklung gegen Bt-Toxine zu umgehen, besteht darin, durch stabiles Einbringen kurzer DNA-Stücke aus Genen der Schadinsekten den Schädling durch RNA-Interferenz zu bekämpfen. Da die RNA-Interferenz eine Sequenzähnlichkeit zwischen dem eingebrachten DNA-Stück und dem Gen im Zielorganismus erfordert, ist bei einer geeigneten Wahl der Sequenz eine hohe Spezifität möglich.[15] So zeigt eine 240 Basenpaar lange DNA-Sequenz aus dem Sfn7 Gen des Westlichen Maiswurzelbohrers eine hohe Spezifität gegen den Westlichen Maiswurzelbohrer und wirkt nur gegen wenige nahverwandte Käferarten.[16] Mehrere Maissorten, die dieses 240 Basenpaar DNA-Stück des Snf7-Gens des Westlichen Maiswurzelbohrers enthalten, sind seit 2015 in mehreren Ländern für den kommerziellen Anbau zugelassen.[17]
Tierfutter-Mais (Phytase-Mais)
Ein hoher Anteil des Phosphats in Pflanzen ist in Phytat gebunden und kann von nicht-wiederkäuenden Nutztieren, wie Schweinen und Geflügel, nicht aufgenommen werden. Die Aufnahme von Phosphat kann durch Zusatz von Phytase im Tierfutter ermöglicht werden. Die chinesischen Behörden erteilten 2009 Phytase-Mais die Zulassung zum Anbau. Phytase-Mais wurde von chinesischen Forschungseinrichtungen entwickelt und bildet infolge eines eingeführten Gens das Enzym Phytase, wodurch Schweine und Geflügel den im Maisfutter enthaltenen Phosphoranteil des Phytats verwerten können.[18] Zugleich sinkt die Umweltbelastung, da Gülle und Stalldung weniger mit Phosphaten belastet sind.
Alternativ kann die endogene Phytatkonzentration in einer Nutzpflanze reduziert werden, indem man durch Genome Editing das IPK1-Gen inaktiviert, das für die Phytatsynthese verantwortlich ist. Der entsprechende Genome-editierte Mais wird in den USA nicht als gentechnisch veränderter Organismus eingestuft.[19]
Lagertoleranter-Mais (Avidin-Mais)
Mit dem Avidin-Mais wurde im Labor ein transgener Mais entwickelt, der das Hühnereiprotein Avidin in Konzentrationen über 100 ppm produziert. Avidin schüzt den Mais bei der Lagerung gegen Schädlingsbefall, da bei Aufnahme des Avidins das Biotin in den Schadinsekten gebunden wird und die Schädlinge an Biotinmangel sterben.[20] Die geringere Biotin-Verfügbarkeit durch die Anwesenheit von Avidin macht aber transgenen Mais als Nahrungspflanzen ungeeignet, so dass keine entsprechende Maissorte für den kommerziellen Anbau entwickelt wurde.[21]
Ethanol-Mais (Amylase-Mais)
Mais wird für die Herstellung von Ethanol angebaut (in den USA wurde er um 2015 auf ca. 40 % der Maisanbaufläche).[22] Hierbei wird die pflanzliche Stärke durch Zugabe von Amylasen in Zucker umgewandelt, der dann durch alkoholische Gärung in Bioalkohol umgesetzt wird. Die Firma Syngenta hat die Maissorte Enogen™ entwickelt, die eine hitzestabile bakterielle alpha-Amylase enthält und somit Stärke effizienter abbauen kann.[23] Da (Stand 2010/11) befürchtet wird, dass Enogen-Mais normale Maissorten verunreinigen könnte und so die Maisprodukte qualitativ beeinträchtigt sein könnten, sollen die Farmer mit Syngenta einen Vertrag abschließen, um eine sichere Ablieferung an die Verarbeitungsbetriebe zu gewährleisten.[24]
Mais mit erhöhtem Lysingehalt
Da Mais für die Ernährung von Mensch und Tier relativ wenig Lysin, eine essentielle Aminosäure, enthält, wird mit gentechnischen Methoden versucht, den Gehalt an Lysin zu steigern. In der transgenen Maissorte LY038 (Handelsname MaveraTM) wurde der Gehalt an freiem Lysin erhöht, indem die Lysinsynthese durch das Einbringen eines Gens aus dem Bakterium (Corynebacterium glutamicum) stimuliert wird.[25] MaveraTM ist in den USA seit 2006 für den kommerziellen Anbau als Futtermittel zugelassen,[26] hat sich aber auf dem Markt kaum durchgesetzt.
Mais mit vergrößerten Kolben
Bisher (Stand 2014) wurden kaum Gv-Pflanzen entwickelt, die eine größere Biomasse haben. Die Maissorte MON87403 von Monsanto ist die einzige Maissorte, die durch Einbringen eines Gens aus dem Acker-Schmalwand vergrößerte Kolben ausbildet.[27] Sie ist seit 2015 in den USA und Kanada zum Anbau zugelassen.[28]
Trockentoleranter Mais
Bei Bakterien der Art Bacillus subtilis, die extreme Kälte überleben, wurde das cspB-Gen identifiziert, das Pflanzen auch über Stresssituationen wie Trockenheit helfen kann.[29] Ein mit diesem cspB-Gen ausgestatteter, trockenresistenter Mais, der gemeinsam von BASF und Monsanto entwickelt wurde, wird als Genuity® DroughtGard™ seit 2011 kommerziell angebaut und ist in der Europäischen Union seit 2015 als Lebens- und Futtermittel zugelassen.[30] Freilandversuche von mehr als 2000 Farmern in dem sogenannten Maisgürtel der USA zeigen eine um etwa 7 % erhöhte Ertragssteigerung[31] und liegen damit gleichauf mit konventioneller Trockenzüchtung. Entsprechende Maissorten sollen lizenzfrei an Landwirte in Afrika abgegeben werden.[32]
Befruchtungskontrolle
Kommerzieller Mais ist vorwiegend eine Hybride aus zwei unterschiedlichen Inzuchtlinien, da diese Hybride aufgrund des Heterosis-Effekts wesentlich bessere Ertragseigenschaften haben. Um reine Hybride zu erhalten, werden männliche Pollenspender mit weiblichen Pollenspendern angepflanzt, wobei eine Selbstbestäubung verhindert werden muss. Da Mais eine einhäusige Pflanze mit weiblichen Kolben und männlichen rispigen Blütenständen ist, kann Selbstbestäubung durch das Entfernen der männlichen Blütenstände bei den Pollenempfängern verhindert werden. Um diese aufwendige manuelle Arbeit zu vermeiden, hat die Bayer AG männlich-sterilen Mais hergestellt (InVigor™ Maize), indem das Gen, das für eine bakterielle RNase codiert, im Tapetum der Pollensäcke aktiv ist und so die Pollenbildung unterdrückt.[33] Die entsprechenden Hybride sind transgen.
Als Alternative hat die Firma Pioneer ein System entwickelt, bei dem die Hybride nicht transgen sind. Hierzu wurde die SPT-maintainer-Linie 32138 hergestellt, die homozygot männlich-steril ist. In diese Linie wurden drei Genkonstrukte eingebracht, um die männliche Fertilität reversibel zu steuern.[34] Die resultierenden Hybridlinien enthalten kein Transgen und die SPT-maintainer-Linie ist in den USA seit 2011 zum Anbau zugelassen.[19]
Anbau
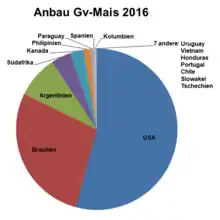
Gv-Mais wird im großen Stil angebaut und vorwiegend als Nahrungspflanzen für Nutztiere sowie zur Produktion von Bioethanol verwendet. Die Anbaufläche ist dabei seit 2011 beständig gestiegen, lediglich 2014 und 2015 gab es einen leichten Rückgang. Im Jahr 2016 wurden weltweit 60,6 Millionen ha Gv-Mais angepflanzt, was etwa 33 % der Gesamtfläche des Maisanbaus entspricht und transgenen Mais zur zweitgrößten transgenen Fruchtart nach Soja macht. Davon waren 6 Mio. ha insektenresistent, 7 Mio. ha herbizidresistent und der große Rest von 47,6 Mio. ha mit Mais, der gleichzeitig insekten- und herbizidresistent war (stacked Traits). Andere Traits sind kaum von kommerziellem Interesse.[35]
Die Anbaufelder liegen im Jahr 2016 zum Großteil in den USA und Brasilien. Der Rest verteilt sich auf 14 Länder. In der EU wird Gv-Mais seit 2015 nur noch in Spanien, Portugal, der Slowakei und Tschechien angebaut. Dies entspricht einem Anteil von weniger als 0,2 % der weltweiten Fläche.[35] Auf Gv-Sorten entfallen in Spanien etwa 35 Prozent der Maisproduktion. 2017 wurde außer in Spanien nur noch in Portugal Gv-Mais angebaut. Bezogen auf alle 28 EU-Mitgliedstaaten ist der Gv-Mais-Anteil mit 1,5 Prozent der Gesamtanbaufläche sehr gering.[36]
Für Bt-Mais bestehen bestimmte Anbauregeln, welche eine Resistenzentwicklung gegen Fraßinsekten vermeiden soll. Demnach müssen 20 % der Fläche (in einigen Gegenden sogar 50 %) als Rückzugsgebiete mit für die Insekten unschädlichen Sorten angebaut werden.[37]
Ökonomische Auswirkungen
In der Europäischen Union werden kaum gentechnisch veränderten Maissorten angebaut. Es sind aber 27 verschiedene gentechnisch veränderte Sorten zum Import als Nahrungs- und Futtermittel zugelassen.[38]
Für das Jahr 2015 wurde die globale Ertragssteigerung aufgrund erhöhter Erträge und reduzierter Produktionskosten für herbizidresistenten und insektenresistenten Mais auf 1,8 bzw. 4,46 Milliarden USD berechnet.[39] Die ökonomische Vorteile des Anbaus von Gv-Mais wird in einer umfassenden Analyse der veröffentlichten Daten durch die National Academies of Sciences, Engineering, and Medicine bestätigt. Dies gilt insbesondere für insektenresistenten Mais, während bei herbizidresistentem Mais eher der vereinfachte Anbau als vorteilhaft angesehen wird. Die Studie weist darauf hin, dass die Datenlage inbezug auf ein gesteigertes Einkommen im Einzelfall sehr stark variieren kann.[40] Eine 2019 erschienene Studie zeigt, dass in Spanien und Portugal, wo seit 1998 auf 30 bis 35 % der Maisflächen Bt-Mais angepflanzt wird, der Ertrag um 11,5 % angestiegen ist und damit zu einem pro Hektar um 173 Euro erhöhten Einkommen geführt hat.[41]
Zulassungsregelungen
Es gibt kein weltweit einheitliches Verfahren für die Zulassung von Gv-Pflanzen und damit auch nicht für Gv-Mais. Jedes Land hat seine eigenen Gesetze. Eine Übersicht findet sich in der Datenbank GM Approval Database, die fortlaufend von der internationalen nonprofit Organisation International Service for the Acquisition of Agri-biotech Applications (ISAAA) zusammengestellt wird.[42] In der Regel ist die Zulassung zum Anbau getrennt von der Zulassung als Lebens- und Futtermittel.
Richtlinien für die Zulassung in Europa
In der Europäischen Union liegen im Jahr 2018 Zulassungen als Futter- und Lebensmittel für 50 transgene Maislinien vor.[43] Zum Anbau ist 2018 nur die Maissorte MON810 mit Insektenresistenz zugelassen.[44] Seit 2015 besteht die Möglichkeit, dass jedes Land in der EU selbständig entscheiden kann, Gv-Pflanzen auf seinem Territorium zu verbieten.[45] Diese Ausstiegsklausel, die von 17 Mitgliedsländern, auch von Deutschland und Österreich, sowie von vier Regionen genutzt wird, verbietet in diesen Ländern den Anbau von MON810. Die Ausstiegsklausel wurde in der EU eingeführt, um die Zulassungsverfahren, die in unterschiedlichen Ländern teilweise heftig umstritten waren, zu vereinfachen. Sie hat aber die Problematik der GVO-Zulassung in der EU nicht wesentlich verbessert.[46]
Auf Grund der noch herrschenden Rechtsunsicherheit bei GVO-Beimischungen im Saatgut reagieren Behörden in Deutschland auf geringfügige Anteile von GVO-Saatgut in konventionellen Chargen uneinheitlich. 2009 wurden nach Angaben von Behörden in Maissaatgut geringfügige, an der Nachweisgrenze befindliche Spuren (0,1 %) der Linie NK603 gefunden, die zwar als Lebens- und Futtermittel zugelassen ist, aber nicht zum Anbau.[47]
Außerhalb der EU sind in der Schweiz die drei Gv-Maislinien Bt176, Bt11 und MON810 zum Import als Lebens- und Futtermittel zugelassen.[48] Daneben besteht in der Schweiz ein generelles Anbauverbot für Gv-Pflanzen bis 2025.[49] In Russland sind 12 Gv-Maissorten ausschließlich als Lebens- und Futtermittel zugelassen.[50]
Zulassungsregelung außerhalb Europas
In Nord- und Südamerika, insbesondere in Argentinien, Brasilien, Kanada, Kolumbien, Paraguay, Uruguay und den USA, liegen Zulassungen für die Verwendung verschiedenster Gv-Maissorten als Lebens- und Futtermittel sowie zum Anbau vor. Es bestehen aber teilweise erhebliche Unterschiede. In Mexiko, dem Ursprungsland der Maiskultur, besteht nur die Zulassungen als Lebens- und Futtermittel.[51]
In Afrika gibt es nur in Südafrika für verschiedene Gv-Maissorten Zulassungen als Futter- und Lebensmittel sowie zum Anbau. In Ägypten ist lediglich der Anbau bewilligt.[51]
In Asien und Ozeanien liegen Zulassungen zum Anbau in Australien, den Philippinen und Vietnam vor. Zulassungen ausschließlich als Futter- und Lebensmittel existieren in China, Japan, Indonesien, Malaysia und Südkorea, als Lebensmittel in Taiwan, Neuseeland und Thailand, und in der Türkei als Futtermittel.[51]
Kennzeichnungspflicht in der EU
In der EU muss gentechnisch veränderter Mais in Lebensmitteln kenntlich gemacht werden, beispielsweise mit dem Hinweis genetisch veränderter Mais oder aus genetisch verändertem Mais.[52] Chemisch modifizierte Lebensmittelzusatzstoffe (Zusatzstoffe der zweiten Generation) aus gentechnisch verändertem Mais, wie etwa modifizierte Maisstärke, müssen nicht gesondert gekennzeichnet werden. Nicht ausgezeichnet werden bisher zudem tierische Produkte, die durch Verfütterung von gentechnisch verändertem Mais gewonnen werden. Dieser kann seit August 2005 zu diesem Zwecke in die EU importiert werden.
Honig mit Spuren von gentechnisch verändertem Mais
Der Kaisheimer Hobby-Imker Karl Heinz Bablok hatte 2005 DNA von MON810 und genetisch veränderte Proteine im Maispollen in seinen Bienenstöcken sowie DNA von MON810 in seinem Honig gefunden. Da er den Honig nicht mehr für verkehrs- und gebrauchsfähig hielt, verklagte er den Freistaat Bayern, welcher MON810 zu Forschungszwecken in einer Entfernung von etwa 500 Metern von Babloks Grundstücken anbaute, auf Schadensersatz. Im Mai 2007 verpflichtete daraufhin das Verwaltungsgericht Augsburg den Betreiber einer der Äcker, MON810 am Blühen zu hindern – durch frühzeitige Ernte oder Abschneiden der einzelnen Blütenstände. Nur so könne verhindert werden, dass Bienenvölker in der Nähe des Maisackers auch transgene Maispollen einsammeln. Honig, der MON810-Pollen enthält, sei nicht als Lebensmittel zugelassen, argumentierte das Gericht. Einen Monat später wurde dieser Entscheid zunächst durch das Bayerische Verwaltungsgericht[53] aufgehoben. Im September 2011 entschied der Europäische Gerichtshof (EuGH), dass Pollen von Gv-Pflanzen nicht als GVO und Honig mit Pollengehalt von Gv-Pflanzen als Produkt mit Zutaten aus GVO anzusehen sind, und dass Honig mit Gv-Spuren im Pollen unter die Verordnung 1829/2003 fällt. Damit widerspricht der EuGH der bisherigen Rechtspraxis, nach der Pollen als natürlicher Bestandteil des Honigs angesehen wurde und damit irrelevant war, ob Gv-Spuren im Pollen waren. Honig galt außerdem bisher als tierisches Produkt (was nicht unter die Verordnung 1829/2003 fällt). Durch das Urteil muss die Honigzutat Pollen gekennzeichnet werden, wenn der Anteil von Pollen aus zugelassenen Gv-Pflanzen mehr als 0,9 % am Gesamtpollengehalt beträgt. Für Honig und Nahrungsergänzungsmittel, die Pollen aus nicht zugelassenen Gv-Pflanzen enthalten gilt ebenso wie für nicht zugelassene GVO ein Verbot des Inverkehrbringens. MON810 ist nicht unter 1829/2003 zugelassen, sondern unter der alten Verordnung 90/220; damit ist Honig mit Spuren von MON810 im Pollen ebenfalls nicht verkehrsfähig, obwohl er als Futter- und Lebensmittel unter 90/220 zugelassen ist. Das Urteil hat auch Auswirkungen auf importierten Honig aus Ländern Nord- und Südamerikas, in denen Gv-Pflanzen angebaut werden, die teilweise in der EU nicht als Futter- und Lebensmittel zugelassen sind. Weitreichende Folgen könnte das Urteil auch für Freisetzungen zu Forschungszwecken mit Gv-Pflanzen haben. Sollte die Möglichkeit, dass einzelne Gv-Pollenkörner in Honig oder Spuren von gentechnisch verändertem Saatgut und gentechnisch veränderte Proteine in Pollen gelangen könnten, ausreichen, um gegen die Betreiber von Freilandversuchen gerichtlich vorzugehen, könnten Freilandversuche nicht mehr möglich sein.[54][55][56][57][58]
Erfahrungen mit transgenem Mais
Aus dem Anbau von Gv-Mais in Nord- und Südamerika können einige Erfahrungen abgeleitet werden, wobei diese aber lediglich auf herbizid- und insektenresistente Maissorten zutreffen, da die anderen Sorten in zu kleinen Mengen angebaut werden.
Auswirkung der Herbizide auf die Umwelt
Die Umweltbelastung durch Herbizide bei Einsatz von herbizidresistentem Mais ist geringer als bei konventionellem Anbau, der auch mit Herbiziden durchgeführt wird. So lag im Jahr 2014 weltweit der Eintrag von Herbiziden aufs Gewicht bezogen um 6 % tiefer und, da die für herbizidresistenten Maissorten umweltverträglichere Chemikalien eingesetzt werden, wird die reduzierte Belastung der Umwelt, die mit dem Environmental Impact Quotient gemessen wird[59], mit 12,1 % angegeben. Dieser positive Effekt wurde in allen untersuchten Ländern festgestellt, wobei aber erhebliche Unterschiede bestehen.[60]
Es ist unklar, ob diese Befunde in Zukunft noch zutreffen, da der großflächige Einsatz von Herbiziden zum Auftreten herbizidresistenter Unkräuter geführt hat, so dass umweltschädlichere Herbizide mit entsprechenden herbizidresistenten Maissorten, wie Optimum™ GAT™ und Enlist™, eingesetzt werden, was nicht nur zu vermehrten Kosten, sondern auch zu einer erhöhten Umweltbelastung führen kann.[61] Es wird auch darauf hingewiesen, dass der einseitige Einsatz von Herbiziden zur Unkrautbekämpfung zu Monokulturen führen und die traditionelle Fruchtfolge vernachlässigt kann, was die Bodenfruchtbarkeit negativ beeinflusst.[62]
Auswirkung der Bt-Maissorten auf die Umwelt
An der University of Illinois at Urbana-Champaign durchgeführte Experimente gaben Hinweise, dass Bt-Mais unter bestimmten Umweltbedingungen eine höhere Stickstoffnutzungseffizienz und eine größere Toleranz gegenüber niedrigen Stickstoffgaben aufweist als Mais ohne Bt-Gene. In den Experimenten benötigte Bt-Mais im Durchschnitt 38 % weniger Stickstoff als konventioneller Mais, um den Ertrag zu maximieren. Dies kann den Einsatz von Stickstoffdünger eindämmen.[63]
Der Einsatz von insektenresistenten Gv-Maissorten hat zu einer reduzierten Umweltbelastung durch Spritzung von Insektiziden geführt. So hat sich weltweit zwischen 1996 und 2014 beim Anbau von Bt-Mais ein um 52 % erniedrigter Verbrauch an Insektiziden ergeben. Da im Wesentlichen die Art der eingesetzten Insektiziden unverändert ist, entspricht auf Grund des Environmental Impact Quotients[59] die ausgebrachte Menge auch einer um 56 % erniedrigten Belastung der Umwelt.[64] Auch in Spanien und Portugal, wo seit 1998 auf 30 bis 35 % der Maisflächen Bt-Mais angepflanzt wird, hat sich die Menge an gespritzten Insektiziden auf mit gentechnisch veränderten Maisfeldern um 37 % verringert.[41]
Längerfristige Beobachtungen von Schädlingspopulationen in den USA haben ergeben, dass die Verwendung von Bt-Pflanzen nicht nur zu einem geringeren Schädlingsbefall in den Bt-Feldern, sondern auch zu einem geringeren Schädlingsbefall in konventionellen Feldern geführt hat (Positive Externalität). US-amerikanische Maisbauern, die keinen Bt-Mais anbauten, haben auf diese Weise vom Anbau des Bt-Mais durch andere Bauern profitiert.[65] Dieser reduzierte Schädlingsbefall betrifft auch andere Kulturen, wie Zuckermais, Paprika und Gartenbohnen, und beeinflusst selbst den biologischen Landbau positiv.[66]
Eine Metaanalyse mehrerer Freilanduntersuchungen hat gezeigt, dass Bt-Toxine von Gv-Maissorten spezifisch wirken und Nützlinge, wie Blumenwanzen, Röhrenblattläuse, Webspinnen, Laufkäfer und Marienkäfer nicht beeinträchtigen. Eine Ausnahme ist die Brackwespe Macrocentrus cingulum, die den Maiszünsler parasitiert, und somit wohl indirekt betroffen ist, da ihre bevorzugte Nahrung fehlt.[67]
Problematik der Koexistenz
In Mexiko, dem Ursprungsland des Maises, ist der Anbau von Gv-Maissorten verboten, um ein Auskreuzen mit Landrassen des Mais zu vermeiden. Trotz dieses Verbots wurden in verschiedenen Landrassen Bt-Toxin- und Herbizidresistenzgene nachwiesen und man nimmt an, dass dies vorwiegend durch illegal importiertes Saatgut und Futtermais aus den Vereinigten Staaten von Amerika zurückzuführen ist. Es wird befürchtet, dass wertvolle Eigenschaften der Ursprungsrassen unwiederbringlich verlorengehen könnten.[68]
In den letzten Jahren ist Teosinte, die Ursprungspflanze des Kulturmais, als invasive Art in Spanien aufgetaucht. Molekularbiologische Untersuchungen haben gezeigt, dass der Spanische Teosinte ein Hybride zwischen Teosinte und einem nicht näher identifizierbaren Kulturmais darstellt.[69] Da der Spanische Teosinte ein hartnäckiges Unkraut in einigen Maiskulturen ist, wird davor gewarnt, herbizidtolerante Maissorten in Anwesenheit des Spanischen Teosinte über längere Zeit mit dem entsprechenden Herbizid zu behandeln, da durch diesen Selektionsdruck auch bei seltenen Genübertragungen herbizidtoleranter Spanischer Teosinte entstehen und somit Spanischer Teosinte sich als herbizidresistentes Unkraut etablieren könnte.[70]
Resistenzentwicklung der Schädlinge
Der Einsatz von insektenresistenten Gv-Maissorten hat zur Resistenzentwicklung geführt, so dass die Wirkung auf verschiedene Schädlingsarten reduziert ist oder sogar weitgehend ausbleibt. Diese Resistenzentwicklung betrifft mehrere unterschiedliche Bt-Toxine und ist im Schnitt innerhalb von fünf Jahren erfolgt. Beim Westlichen Maiswurzelbohrer sind Resistenzen gegen sechs verschiedene Bt-Toxine beobachtet worden.[71] Das bewusste Anpflanzen von nicht Gv-Maissorten kann die Resistenzentwicklung verlangsamen, wobei aber auch die Anwendung anderer Bekämpfungsmaßnahmen, wie Fruchtfolge und gezielte Spritzung von Insektiziden wichtig ist.[72][73]
Weniger Befall mit Schimmelpilzen
Neben dem internen Schutz der Pflanzen vor spezifischen Schädlingen haben Studien in mehreren Ländern ergeben, dass der Bt-Mais weit weniger mit Schimmelpilzen und deren Giften (die meist krebserregend sind) belastet ist. Dies liegt an der verringerten Fraßschädigung. Die Fraßschädigung bewirkt ein Ansammeln von Wasser in den Fraßgängen und damit ein Wachstum der Pilze. Der reduzierte Gehalt an Toxinen trifft insbesondere für Fumonisine zu; der Effekt auf Aflatoxine ist (Stand 2013) umstritten.[74]
Sicherheit als Lebens- und Futtermittel
Wie andere transgene Pflanzen werden auch transgene Maissorten nur als Lebens- bzw. Futtermittel zugelassen, wenn anhand umfangreicher Untersuchungen gezeigt wurde, dass sie gesundheitlich ebenso unbedenklich ist wie die entsprechenden konventionellen Maissorten. So sind vergleichende Analysen der nutritiven, anti-nutritiven, toxischen und allergenen Inhaltsstoffe durchzuführen, um mögliche, durch die genetische Modifikation ausgelöste unbeabsichtigte Veränderungen feststellen zu können. Aktuelle Leitlinien für die Sicherheitsbewertung genetisch veränderter Pflanzen und daraus hergestellter Lebensmittel wurden 2004 von der Europäischen Behörde für Lebensmittelsicherheit (EFSA) und der für internationale Lebensmittelstandards zuständigen Codex Alimentarius Kommission im Juni 2003 herausgegeben. Sie basieren auf dem von einer Arbeitsgruppe der OECD im Jahr 1993 beschriebenen und von FAO und WHO in den folgenden Jahren weiterentwickelten Prinzip der Substanziellen Äquivalenz. In Deutschland ist das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit im Benehmen mit dem Robert Koch-Institut und dem Bundesinstitut für Risikobewertung (BfR) für die Sicherheitsbewertung genetisch veränderter Lebens- und Futtermittel zuständig.[75]
Die American Society for Microbiology legte in einem öffentlichen Statement aus dem Jahr 2000 dar, dass es keine überzeugenden Belege dafür gebe, dass mithilfe der Biotechnologie hergestellte und unter der Aufsicht der FDA stehende Pflanzen ein hohes Risiko darstellen oder unsicher seien. Sie böten vielmehr eine potenzielle Verbesserung von Ernährung, Geschmack und Haltbarkeit.[76]
Die Society of Toxicology veröffentlichte 2002 ein Positionspapier, in dem sie zu dem Schluss kommt, dass die Sicherheit gegenwärtiger Lebensmittel, die mithilfe biotechnologischer Methoden hergestellt wurden, der Sicherheit traditioneller Lebensmittel entspreche. Dies bedeute jedoch nicht, dass alle zukünftigen gentechnischen Veränderungen ebenso sicher seien.[77]
Die American Society of Plant Biologists vertritt die Ansicht, dass die Risiken gentechnischer Verfahren vergleichbar sind mit denen klassischer Züchtung.[78]
Die American Society for Cell Biology sieht in gentechnisch veränderten Pflanzen keine Bedrohung der öffentlichen Gesundheit, sondern vielmehr die Chance, diese zu verbessern.[79]
Der Internationale Wissenschaftsrat, der internationale Dachverband der wissenschaftlichen Gesellschaften und Akademien, stellte 2003 auf Basis von etwa 50 zwischen 2000 und 2003 veröffentlichten wissenschaftlichen Reviews fest, dass es keine Beweise für negative Effekte des Konsums von Lebensmitteln mit gentechnisch veränderten Zutaten gibt. Zukünftige gentechnisch veränderte Lebensmittel mit neuen Eigenschaften sollten jedoch auf einer Einzelfallbasis geprüft werden.[80]
Unerwartete und unbeabsichtigte Veränderungen der Zusammensetzung von Organismen treten laut einer gemeinsamen Veröffentlichung des Institute of Medicine und des National Research Council (2004) bei allen Formen der genetischen Modifikation auf, inklusive gentechnischer. Ob derartige Veränderungen zu Gesundheitseffekten führen, hänge von der Natur der veränderten Substanzen und ihren biologischen Konsequenzen ab. Bisher seien keine negativen Gesundheitseffekte bei Menschen dokumentiert, die auf Gentechnik zurückgehen.[81]
Die British Medical Association (2004) und die The Royal Society (2002) schlossen in ihren Reviews, dass es keine robusten Hinweise gebe, dass Gv-Lebensmittel unsicher seien, fordern aber weitere Forschung und Beobachtung.[82] Laut einer 2016 veröffentlichten Informationsbroschüre der Royal Society sind alle derzeit verfügbaren gv-Lebensmittel mindestens so sicher wie konventionelle Lebensmittel.[83]
2004 veröffentlichten 14 italienische Wissenschaftsorganisationen (inkl. der Accademia Nazionale delle Scienze) ein Konsensdokument zur Lebensmittelsicherheit von gentechnisch veränderten Organismen. Demnach seien die zugelassenen Gv-Organismen sicher für die menschliche und tierische Ernährung.[84]
Der Union der deutschen Akademien der Wissenschaften (2004) zufolge stellen Lebensmittel aus transgenen Pflanzen kein Risiko dar. Transgener Mais sei mehreren Untersuchungen gemäß bezogen auf einen Befall mit Fusarium weniger belastet als konventioneller Mais und in diesem Zusammenhang als gesünder zu bewerten.[85] Ein geringerer Befallsgrad von Bt-Mais mit Fusarien im Vergleich zu anderen Verfahren ist laut einer Veröffentlichung des österreichischen Umweltbundesamtes (2002) jedoch nur dann festzustellen, wenn absolut keine Maßnahmen gegen den Maiszünsler zur Anwendung kommen. Die Methode Abschlegeln des Maisstrohs und sauberes Unterpflügen senkt zum einen signifikant den Maiszünslerbefall und gilt zum anderen als wirkungsvolle Maßnahme, dem Fusarienbefall in der Folgekultur, häufig wieder Mais, vorzubeugen.[86] Eine 2010 erschienene Übersichtsarbeit stellte fest, dass in 19 von 23 in verschiedenen Ländern durchgeführten Studien der Mykotoxinbefall von Bt-Mais geringer war als bei konventionellem Mais.[87] Eine 2007 veröffentlichte Übersichtsarbeit kam zu dem Schluss, dass es unter Feldbedingungen weltweit eine starke Evidenz für eine signifikant niedrigere Belastung von Bt-Mais mit Fumonisinen gebe. Auch gebe es Hinweise auf geringere Belastung mit Deoxynivalenol und Zearalenon. Hinsichtlich der Aflatoxinbelastung fanden Studien gemischte Ergebnisse.[88] Im Vergleich zu anderen ackerbaulichen Verfahren wie Sortenwahl, Aussaatdatum, Fruchtfolge oder Pflügen ist transgener Mais laut Munkvold (2014) die effektivste Maßnahme zur Reduzierung der Mykotoxinbelastung.[89]
König u. a. (2004) schreiben, dass es keine Hinweise auf mögliche negative Effekte durch den Konsum transgener Pflanzen gebe. Alle zugelassenen transgenen Pflanzen seien auf Einzelfallbasis umfangreich getestet worden.[90]
Laut einem Review von Aumaitre (2004) wurden bei bis September 2003 veröffentlichten Fütterungsstudien mit als Futtermittel zugelassenen transgenen Maissorten keine toxischen oder sonstigen negativen Effekte gefunden.[91]
Flachowsky u. a. (2005) fassen in einem Review zusammen, dass viele Studien durchgeführt worden seien und diese keine signifikanten Unterschiede zwischen den bisher kommerzialisierten transgenen und konventionellen Pflanzen im Hinblick auf Sicherheit oder Nährwert von aus ihnen hergestellten Futtermitteln festgestellt hätten.[92]
Einer 2005 veröffentlichten Studie der WHO zufolge haben die auf dem internationalen Markt gehandelten Gv-Lebensmittel Risikountersuchungen in mehreren Ländern durchlaufen. Es sei nicht wahrscheinlich und wurde bisher nicht gezeigt, dass diese Lebensmittel Risiken für die menschliche Gesundheit darstellen.[93]
Domingo (2007) fand, dass die bis dato in Fachzeitschriften veröffentlichten Sicherheitsstudien mit transgenen Maissorten keine signifikanten Unterschiede zu konventionellen Sorten gefunden hätten. Die Zahl der veröffentlichten Studien sei jedoch sehr gering. Domingo forderte weitere und längere Untersuchungen und stellte das Prinzip der Substanziellen Äquivalenz in Frage.[94]
Die Australian Academy of Science befand 2007, dass Gv-Produkte seit vielen Jahren ohne nachgewiesene Gesundheitsschäden konsumiert worden seien, und dass ihre Sicherheit mit vielen begutachteten internationalen Studien bestätigt sei.[95]
Eine vom Gremium für genetisch veränderte Organismen der ESFA beauftragte Arbeitsgruppe zur Fütterungsstudien zur Sicherheit von transgenen Pflanzen als Futter- und Lebensmittel kam in ihrem 2008 veröffentlichten Review zu dem Schluss, dass viele subchronischen Fütterungsstudien mit transgenen Pflanzen an Nagetieren in den letzten 15 Jahren durchgeführt wurden. Diese Studien entsprächen international akzeptierten Vorgehensweisen und gaben keine Hinweise auf irgendwelche negativen Effekte. Zahlreiche Viehfütterungsstudien hätten zudem gezeigt, dass sich auf transgenen und konventionellen Pflanzen basierende Futtermittel im Hinblick auf Nährstoffaufnahme, Gesundheit und Leistung, Bruterfolg, Milchertrag und -qualität sowie anderen Indikatoren nicht voneinander unterscheiden.[96]
Key u. a. (2008) verweisen darauf, dass Gentechnisch veränderte Lebensmittel (Gv-Lebensmittel) seit mehr als 15 Jahren von Hunderten Millionen Menschen weltweit konsumiert werden, ohne dass ein negativer Gesundheitseffekt bekannt sei.[97]
Querci u. a. (2008) vom Institut für Gesundheit und Verbraucherschutz (IHCP) der Gemeinsamen Forschungsstelle glauben, dass es bereits umfangreiches gesammeltes Wissen zu Sicherheitsfragen um gentechnisch veränderte Produkte gebe und dass dieses Wissen ausreiche, um die Sicherheit derzeitiger Produkte zu evaluieren. Es lägen keinerlei Berichte über Beweise irgendwelcher Gesundheitseffekte von bisher in den Zulassungsprozess eingereichten gentechnisch veränderten Lebensmitteln vor. Gleichzeitig wisse man wenig über die Langzeitfolgen von Lebensmitteln allgemein. Die Sicherheit gentechnisch veränderter Lebensmittel ist dabei nicht absolut, sondern im Vergleich zu konventionellen Äquivalenten. Konventionelle Lebensmittel werden oft auf Basis des sicheren Konsums in der Vergangenheit evaluiert. Die gegenwärtige Erfahrung mit Langzeituntersuchungen im Rahmen von Zulassungsprozessen wiesen mit einem angemessenen Grad von Gewissheit auf einen Mangel an möglichen Gesundheitsfolgen gentechnisch veränderte Produkte hin.[98]
Lemaux (2008) kommt in ihrem Review zu dem Schluss, dass es keine wissenschaftlich validen Hinweise gebe, dass sich Gv-Lebensmittel hinsichtlich Lebensmittelsicherheit von konventionellen unterscheiden.[99]
Magaña-Gómez und Calderón de la Barca (2009) fanden in den meisten der zwischen 1998 und 2007 veröffentlichten Sicherheitsstudien mit transgenen Maissorten keine signifikanten Unterschiede zu konventionellen Maissorten, bei vier Studien seien hingegen Abweichungen festgestellt worden. Sie fordern eine stärkere Systematisierung der Sicherheitsforschung. Aufgrund der unterschiedlichen Resultate verschiedener Untersuchungen seien mehr wissenschaftliche Anstrengungen notwendig, um mehr Vertrauen in die Sicherheitsforschung und Akzeptanz von gentechnisch veränderten Lebensmitteln zu erreichen.[100]
Ein 2001 veröffentlichtes Review der Europäischen Kommission von 81 Studien aus 15 Jahren fand keine Hinweise auf Gesundheitsrisiken durch transgene Pflanzen. 2010 veröffentlichte die Europäische Kommission erneut ein Kompendium, in dem sie die Ergebnisse von EU-finanzierten Studien durch über 400 unabhängige Arbeitsgruppen aus dem Zeitraum 2001–2010 zusammentrug. Seit über 25 Jahren Forschung gebe es keine Hinweise dafür, dass gentechnisch veränderte Pflanzen mit höheren Risiken für die menschliche Gesundheit verbunden seien als konventionelle.[101]
Laut einem Review von Domingo und Bordonaba (2011) hat die Zahl der veröffentlichten Sicherheitsuntersuchungen seit 2006 deutlich zugenommen. Mehrere zwischen Oktober 2006 und August 2010 erschienene Studien zu verschiedenen transgenen Maissorten hätten gezeigt, dass diese genauso sicher wie konventionelle Maissorten seien. Lediglich die Studien von Seralinis Gruppe in Bezug auf drei transgene Maissorten hätten Bedenken geäußert (siehe Abschnitt Kontroversen).[102]
Eine 2012 erschienene systematische Übersichtsarbeit fasste die Ergebnisse aus 12 Langzeitfütterungsstudien (90 Tage bis 2 Jahre) sowie 12 Mehrgenerationenstudien (2 bis 5 Generationen) zusammen. Die 24 Studien zeigten keine von gentechnisch verändertem Mais, Kartoffeln, Sojabohnen, Reis und Triticale ausgehenden Gesundheitsgefährdungen. Auch seien 90 Tage generell ausreichend für Sicherheitsstudien.[103]
Im Rahmen des vom Schweizer Bundesrat beauftragten und 2012 abgeschlossenen Nationalen Forschungsprogramms NFP 59 „Nutzen und Risiken der Freisetzung gentechnisch veränderter Pflanzen“ führten Karoline Dorsch-Häsler und Karin Hoffmann-Sommergruber eine umfangreiche Literaturstudie durch, in der sie mehr als Tausend wissenschaftliche Publikationen aus den letzten 20 Jahren auswerteten. Die Literaturstudie kam zu dem Schluss, dass gentechnisch veränderte Pflanzen nach derzeitigem Stand des Wissens der menschlichen Gesundheit nicht schaden. Der Einsatz von Bt-Mais könne hingegen positive gesundheitliche Auswirkungen haben, da er zu einer geringeren Belastung von Lebens- und Futtermitteln durch neurotoxische oder krebserregende Mykotoxine führen kann. Als mögliche Risiken wurde die Aufnahme von Fremd-DNA und deren Einbau in Säugerzellen diskutiert. In Fütterungsstudien mit Ziegen wurden zum Beispiel Bt-Gen-Fragmente im Blut und auch in der Milch der Tiere festgestellt. Die Integration von DNA aus gentechnisch veränderten Pflanzen in das Genom eines Tieres wird als sehr unwahrscheinlich bewertet und wurde in Versuchen bisher nicht nachgewiesen.[104]
Die American Medical Association (AMA) vertritt laut einer Stellungnahme vom Juni 2012 die Ansicht, dass es keine Beweise für spezifische Risiken der Nutzung von rDNA-Techniken oder der Verschiebung von Genen zwischen nicht verwandten Organismen gebe, und dass die Risiken transgener Organismen sich qualitativ nicht von denen nicht oder mithilfe anderer Methoden modifizierter Organismen unterscheiden.[105] Die AMA verwies auf eine Veröffentlichung der National Academy of Sciences (NAS), die bereits 1987 zum selben Ergebnis gelangte.[106]
Eine 2013 erschienene Übersichtsarbeit (Nicolia u. a., 2013), in die über 1783 zwischen 2002 und 2012 veröffentlichte wissenschaftliche Sicherheitsstudien einflossen, kam dem Schluss, dass keine signifikanten Gefährdungen durch die direkte Verwendung von Gv-Pflanzen gefunden wurden.[107]
Eine 2014 erschienene Übersichtsarbeit fasst die wissenschaftliche Literatur bezüglich der Auswirkungen von gv-Futtermitteln auf die Leistung und Gesundheit von Nutztieren zusammen (Eenennaam & Young, 2014). Danach kommen zahlreiche experimentelle Studien zu dem konsistenten Ergebnis, dass kein Unterschied zwischen gv- und konventionellen Futtermitteln hinsichtlich dieser Auswirkungen auf Nutztiere besteht. Des Weiteren habe keine Studie signifikante Auswirkungen von gv-Futtermitteln auf das Nährstoffprofil der tierischen Endprodukte gefunden. Auch ließen sich gv-Komponenten in Milch, Fleisch und Eiern nicht nachweisen oder zuverlässig quantifizieren.[108]
Ein Komitee der National Academies (National Academy of Sciences, National Academy of Engineering, National Academy of Medicine) veröffentlichte im Mai 2016 eine umfangreiche Übersichtsarbeit, der zufolge es keine Belege für Gesundheitsrisiken durch gv-Pflanzen im Vergleich zu konventionell gezüchteten Pflanzen gibt.[109]
Kontroversen
Eine Gruppe um den französischen Biologen Gilles-Eric Séralini, die im Comité de Recherche et d’Information Indépendantes sur le Génie Génétique (CRIIGEN) verortet ist, veröffentlichte in der Vergangenheit mehrere Studien, die die gesundheitliche Unbedenklichkeit von mehreren transgenen Maissorten der Firma Monsanto (MON863, MON810, NK603) in Frage stellten. Die Veröffentlichungen der Gruppe lösten heftige Kontroversen aus. Im Januar 2011 gewann Séralini vor der 17. Kammer des tribunal correctionnel de Paris ein Verfahren wegen „übler Nachrede“ gegen Marc Fellous, Präsident der Association Française des Biotechnologies Végétales. Dieser hatte Seralinis Neutralität im Zusammenhang mit einer Studie zu gesundheitlichen Auswirkungen genetisch veränderter Maissorten angezweifelt, da Greenpeace die Studie mitfinanzierte.[110][111] Mehrere Forschergruppen und Behörden untersuchten die Veröffentlichungen und bezweifelten deren Aussagekraft.
Eine weitere Kontroverse entstand um ein Review von Dona und Arvanitoyannis (2009 in Critical Reviews in Food Science and Nutrition). Darin gehen die Autoren davon aus, dass viele Jahre weiterer Forschung notwendig seien, um die gesundheitlichen Auswirkungen zu erfassen. Die Resultate von Sicherheitsstudien zu transgenen Maissorten deuteten darauf hin, dass diese toxische (hepatische, renale, reproduktive) Effekte verursachen und hämatologische, biochemische und immunologische Parameter verändern können.[112] In derselben Fachzeitschrift behauptete Rickard von CropLife International, einer internationalen Vereinigung landwirtschaftlicher Biotechnologie-Unternehmen, in einem Brief an den Herausgeber (2010), der Artikel von Dona und Arvanitoyannis enthalte viele unbelegte Behauptungen. Die Autoren zeigten, dass sie über das Grundwissen zur Sicherheitsbewertung von transgenen Pflanzen nicht verfügten und würden viele relevante wissenschaftliche Erkenntnisse entweder nicht kennen oder bewusst ignorieren.[113] Klaus Ammann warf Dona und Arvanitoyannis ebenfalls vor, ihre Zitierungen extrem gefiltert zu haben mit dem Ziel, ein negatives Bild von transgenen Pflanzen zu zeichnen. Ihr mangele es zudem an Kenntnissen auf dem Gebiet der Lebensmittelsicherheit. Zudem enthalte ihr Artikel viele Plagiate, die zudem aus Publikationen mit negativen Verzerrungen stammten, deren Inhalte vor kurzem oder vor längerem von anerkannten Wissenschaftlern in angesehenen Fachzeitschriften widerlegt worden seien.[114]
Finamore u. a. (2008)[115] vom italienischen Forschungsinstitut für Ernährung und Lebensmittel kamen in einer Fütterungsstudie mit Mäusen zu dem Schluss, dass der Gentech-Mais MON810 signifikante Veränderungen im Immunsystem der Mäusen nach sich ziehen kann. Die Studie wurde neben anderen seitens Griechenland zur Rechtfertigung eines nationalen Anbauverbots von MON810 im Rahmen der Schutzklausel zitiert. Die EU-Kommission beauftragte daraufhin die EFSA mit einer wissenschaftlichen Einschätzung, die 2012 veröffentlicht wurde. Darin stellte EFSA fest, dass die Autoren Finamore u. a. (2008) selbst darauf hinweisen, dass ihre Studienergebnisse eine unklare Relevanz für die Futter- und Lebensmittelsicherheit von MON810 haben. Vor dem Hintergrund möglicher Verzerrungseffekte durch Mykotoxine, fehlende Angaben zur natürlichen Variabilität der untersuchten Parameter, sowie der biologischen Relevanz der gefundenen Unterschiede, forderte die EFSA weitere Daten. Gleichzeitig verwies EFSA auf mehrere Studien,[116][117][118][119] die keine Unterschiede zwischen MON810 und konventionellem Mais hinsichtlich Allergenität feststellen konnten, sowie auf ihre eigene wissenschaftliche Einschätzung von 2009, laut derer aufgrund nicht vorhandener biologisch relevanter Unterschiede in der Zusammensetzung von MON810 (mit Ausnahme des Bt-Gens) kein erhöhtes Allergenitätspotenzial erwartbar sei. Insgesamt kam EFSA zu dem Schluss, dass der Anbau von MON810 in Griechenland wahrscheinlich keine negativen Effekte auf tierische oder menschliche Gesundheit oder die Umwelt habe.[120]
Velimirov u. a. (2008) führten eine Mehrgenerationenstudie durch, die einen negativen Effekt auf die Fortpflanzungsfähigkeit bei Mäusen feststellte, die über mehrere Generationen mit NK603xMON810 gefüttert wurden.[121] Die Studie wurde neben anderen von Österreich zur Rechtfertigung eines Anbauverbots von MON810 im Rahmen der Schutzklausel zitiert. Die Kommission beauftragte EFSA daraufhin mit einer wissenschaftlichen Einschätzung, die im Dezember 2008 veröffentlicht wurde. Die EFSA konstatierte, dass mehrere Mängel hinsichtlich Datenangaben, Methoden und statistischen Berechnungen gefunden worden seien, die keinerlei Interpretation erlauben. Daher seien die in der Studie enthaltenen Daten ungeeignet, um die Sicherheit von MON810 in Frage zu stellen.[122]
Seralini u. a. (2007)
Die Bt-Maissorte MON863 der Firma Monsanto enthält das Gen Cry3Bb1.[123] Monsanto reichte den Zulassungsantrag für MON863 als Futter- und Lebensmittel in der EU 2002 beim RKI ein. Das RKI überprüfte den Antrag und stellte auf Basis der von Monsanto durchgeführten 90-tägigen Fütterungsstudie (deren Dokumentation mehr als tausend Seiten umfasst und die später als Kurzfassung[124] veröffentlicht wurde) mit Ratten keine schädlichen Effekte von MON863 fest. Die EFSA stufte im April 2004 auf Basis derselben Studie MON863 als unbedenklich für Mensch, Tier und Umwelt ein. In der Fütterungsstudie wurden männliche und weibliche Ratten mit MON863 in verschiedenen Dosierungen oder mit der konventionellen Ausgangslinie sowie weiteren konventionellen Maissorten gefüttert. Sowohl beim Wachstum der Tiere als auch bei verschiedenen biologischen Parametern gab es vereinzelt statistisch signifikante Abweichungen bei den mit MON863 gefütterten Tieren, die von der EFSA als „biologisch nicht relevant“ bewertet wurden.[123][125][126]
In der Öffentlichkeit und unter französischen Wissenschaftlern der Commission du génie biomoléculaire (CGB) wurden Zweifel geäußert, ob die beobachteten Abweichungen bei den Ratten, die mit MON863 gefüttert wurden, im Rahmen der üblichen „biologischen Streuung“ liegen oder ob sie als Indizien für gesundheitliche Gefahren zu werten sind. Weitere Gutachten wurden eingeholt. Neue Gewebe-, Zell- und Organuntersuchungen ergaben kein anderes Bild. Der Verdacht, die erhöhte Zahl von weißen Blutkörperchen bei einigen MON863-Ratten sei ein Indiz für „echte Entzündung“, bestätigte sich nicht. Daraufhin schlossen sich auch die Experten der CGB der Sicherheitsbewertung der EFSA an. Greenpeace und andere Kritikergruppen forderten weiterhin die Herausgabe der vollständigen Fütterungsstudie, was Monsanto zunächst verweigerte. Das Oberverwaltungsgericht Münster bestimmte auf Antrag von Greenpeace, dass Monsanto die vollständigen Unterlagen aus dem Zulassungsverfahren offenlegen muss. Auf einer Pressekonferenz am 22. Juni 2004 in Berlin forderte Greenpeace die Bundesregierung auf, gegen eine Zulassung zu stimmen. Seralini sagte dort, angesichts der auffälligen Ergebnisse sei es notwendig, die Versuche zu wiederholen. Im Oktober 2004 bekräftigte das EFSA-Expertengremium, dass die Fütterungsstudien keine Hinweise auf gesundheitliche Bedenklichkeit lieferten. Die EU-Zulassung erfolgte als Futtermittel im August 2005, als Lebensmittel im Januar 2006.[125][126][127]
Im März 2007 veröffentlichte Seralinis Gruppe die von Greenpeace Deutschland finanziell unterstützte Studie „New Analysis of a Rat Feeding Study with a Genetically Modified Maize Reveals Signs of Hepatorenal Toxicity“ auf Basis einer Neubewertung von Monsantos Fütterungsdaten.[128][126] Seralini u. a. kamen darin zu dem Schluss, dass Ratten, die mit MON863-Maiskörner gefüttert wurden, geringfügige, aber dosierungsabhängige Abweichungen im Wachstum bei beiden Geschlechtern zeigten. Außerdem könnten einige der statistisch signifikanten Abweichungen etwa bei den Blut- und Urinmessungen als Hinweise auf Leber- oder Nierentoxizität gedeutet werden.[126]
Eine Arbeitsgruppe der EFSA untersuchte daraufhin die Analyse von Seralini, traf sich mit den Autoren und nahm selbst eine erneute Auswertung der Daten vor. Zusätzlich wurde ein französisches Institut mit einer weiteren Analyse der statistischen Auswertung der Daten beauftragt. Die zuständigen Behörden der Mitgliedstaaten wurden ebenfalls um eine Stellungnahme gebeten. Laut EFSA gab es mal geringere, mal höhere Werte, die als isolierte zufällige Phänomene gedeutet werden könnten. Unterschiede in Blut- und Urinwerten konnten nicht in Gewebeschnitten bestätigt werden und weisen daher nicht auf Organschädigungen hin. Die Hypothese von Seralini u. a., der Unterschied in der Gewichtszunahme basiere auf einer Störung des Hormonhaushalts, könne nicht durch die experimentellen Daten belegt werden. Im Unterschied zu Seralini habe EFSA die biologische Relevanz aller statistisch signifikanten Unterschiede zwischen den mit Gv-Mais gefütterten Tieren und der isogenen Kontroll-Gruppe eingeschätzt. Insgesamt gebe die Studie von Seralini u. a. keine neuen Hinweise auf toxikologische Effekte.[126]
Ein von Monsanto finanziell unterstütztes Expertengremium von 6 Wissenschaftlern aus den Vereinigten Staaten, Deutschland, Großbritannien und Kanada stellte kurz darauf fest, dass die von Seralini u. a. vorgebrachten Effekte sich nicht auf MON863 zurückführen ließen bzw. keinerlei Relevanz hätten, da Seralini u. a. weder eine Dosis-Wirkungs-Kurve, zeitliche Reproduzierbarkeit, eine Verbindung mit anderen Veränderungen (z. B. histopathologische), Effekte in beiden Geschlechtern, Unterschiede außerhalb der normalen Variation, noch einen biologisch plausiblen kausalen Mechanismus demonstrieren konnten.[129]
Die Geschäftsführerin der Kommission für Genetisch veränderte Lebens- und Futtermittel des BfR, Marianna Schauzu, hält die Unterschiede toxikologisch ebenfalls für nicht relevant. Die Unterschiede seien meist gering gewesen und lägen im Rahmen der historischen Kontrolldaten, die in früheren Studien mit Ratten desselben Stammes gewonnen wurden. Die Unterschiede zeigten keine Dosis-Abhängigkeit und sie seien nicht durch Unterschiede bei anderen Parametern, die auf einen Effekt im selben Organ hindeuten könnten, untermauert worden. Auch in den mikroskopischen Untersuchungen der Organe und Gewebe seien keine Effekte beobachtet worden, die auf eine toxikologische Relevanz der statistisch signifikanten Unterschiede bei den Laborparametern schließen ließen. Zudem hätten Untersuchungen der Zusammensetzung sowie des allergenen und toxikologischen Potenzials von MON863 keine Hinweise auf unbeabsichtigte Veränderungen ergeben.[130]
FSANZ, die in Australien und Neuseeland zuständige Zulassungsbehörde, begutachtete die ursprüngliche Fütterungsstudie 2005 und leitete daraus keine negativen Effekte durch MON863 ab. Die Veröffentlichung von Seralini u. a. würde laut einer unabhängig begutachteten Untersuchung durch FSANZ keine neuen Sicherheitsbedenken rechtfertigen. Alle statistischen Unterschiede zwischen den Fütterungsgruppen lägen innerhalb der normalen biologischen Variation. FSANZ verlangt keine Fütterungsstudien bei Zulassungsanträgen für gentechnisch verändere Lebensmittel, wenn die Pflanzen in ihrer Zusammensetzung zu konventionellen Pflanzen äquivalent sind (Substanzielle Äquivalenz). FSANZ hatte die von Monsanto im Rahmen des Zulassungsantrags in der EU durchgeführten 90-tägigen Fütterungsstudie an Ratten 2005 trotzdem evaluiert und keine Risiken aus ihr abgeleitet. FSANZ lagen zudem akute Toxizitätsuntersuchungen an Mäusen und eine Fütterungsstudie mit Hühnern vor, die alle keine Hinweise auf negative Effekte geliefert hätten.[131]
Vendomois u. a. (2009)
Im Dezember 2009 veröffentlichte Seralinis Gruppe erneut eine statistische Auswertung der Rohdaten von drei Fütterungsstudien mit MON863, MON810 und NK603.[132] Seralini u. a. sprechen aus verschiedenen Gründen den angestellten Fütterungsversuchen die statistische Aussagekraft ab und wollen bei ihrer eigenen Auswertung der Rohdaten zumindest Anzeichen für mögliche toxische Wirkungen erkannt haben.
Monsanto wies die Vorwürfe zurück und behauptete Vendomois u. a. verwänden ungeeignete statistische Methoden.[133] Laut EFSA sind die Schlussfolgerungen bezüglich möglicher Nieren- und Leberschäden durch die Maissorten nicht durch die in der Veröffentlichung präsentierten Daten gerechtfertigt. Mehrere der fundamentalen statischen Kritikpunkte an Seralini u. a. (2007) träfen bei Vendomois u. a. (2009) ebenfalls zu. Vendomois u. a. (2009) ermöglichten keinen toxikologischen Vergleich zwischen transgenen und konventionellen Sorten, da
(1) die Resultate ausschließlich in Form von prozentualen Unterschieden in den einzelnen Variablen wiedergeben worden seien und nicht in den gemessenen Einheiten,
(2) die berechneten Werte der getesteten toxikologischen Parameter in keinen Bezug zu der normalen Schwankungsbreite der Tierart gesetzt wurden,
(3) die berechneten Werte der getesteten toxikologischen Parameter nicht mit der Variabilität von mit anderen Sorten gefütterten Tieren verglichen wurden,
(4) die statistisch signifikanten Unterschiede keine Konsistenz über verschiedene Dosen aufweise,
(5) die rein statistischen Argumente der Autoren nicht mit den Ergebnissen der drei Fütterungsstudien bezüglich Organpathologie, Histopathologie und Histochemie konsistent seien. Bezüglich des Vorwurfs von Vendemois u. a., die drei Fütterungsstudien seien nicht adäquat, sagte das EFSA, dass sie allesamt gemäß international definierten OECD-Standards durchgeführt worden.[134] In einem im März 2010 veröffentlichten wissenschaftlichen Gutachten zu einem Neuantrag von MON863 unter geänderten Richtlinien bekräftigte die EFSA ihre bisherigen Erkenntnisse zur Sicherheit von MON863. Für die neue Sicherheitsbewertung wurden weitere Daten beim Antragsteller angefordert. Diese wurden bei der Sicherheitsbewertung ebenso berücksichtigt wie eine Reihe neuer wissenschaftlicher Veröffentlichungen, inklusive Seralini u. a. (2007).[135][136]
Laut FSANZ bieten Vendomois u. a. keine plausible wissenschaftliche Erklärung für ihre Hypothese. Sie verzerrten die toxikologische Signifikanz ihrer Ergebnisse, indem sie außer statistischen keine biologischen Aspekte berücksichtigen würden, was keiner robusten toxikologischen Analyse entspreche. FSANZ geht davon aus, dass die berichteten Unterschiede vor allem zufällig aufgetreten seien und äußerte sich bezüglich der Sicherheit der zugelassenen Sorte MON863 zuversichtlich.[137]
Der französische Haut Conseil des biotechnologies urteilte, dass Vendomois u. a. (2009) ebenso wenig wie Seralini u. a. (2007) zulässige wissenschaftliche Elemente enthalte, die auf hämatologische, hepatische oder renale Toxizität der drei Maissorten hindeute. Die Publikation sei lediglich eine Liste von statistischen Unterschieden ohne den Versuch, sie biologisch oder toxikologisch zu interpretieren. Wie von vielen Behörden bereits wiederholt betont wurde, bewiesen signifikante statistische Unterschiede nicht die Existenz biologischer Störungen. Daher sei das auf diesen Unterschieden vorgebrachte Argument nicht zulässig. Zudem seien die Unterschiede meist bei nur einem Geschlecht, einem Zeitpunkt oder einer Dosis aufgetreten und es fehle zudem komplett der Bezug zu der Dauer der Exposition und der Stärke der Dosis. Zuletzt seien einige der zitierten Unterschiede das Gegenteil eines üblicherweise als solchen betrachteten Hinweises auf toxische Effekte.[138]
Seralini u. a. (2012)
Am 19. September 2012 veröffentlichte Seralinis Team im Journal Food and Chemical Toxicology eine peer-reviewte, über zwei Jahre durchgeführte Langzeitstudie, in der 200 Ratten mit einer Kombination aus der herbizidtoleranten transgenen Maissorte NK603 und Roundup gefüttert wurden. Die Ratten wurden in insgesamt neun Gruppen zu je 20 Ratten eingeteilt, wobei drei Gruppen mit GVO in verschiedenen Konzentrationen, drei Gruppen mit GVO und Roundup und drei Gruppen mit konventionellem Mais, der mit Roundup besprüht wurde, gefüttert wurden. Als Kontrollgruppe dienten Ratten, denen konventioneller Mais ohne Herbizidbelastung verabreicht wurde.[139] Der Studie zufolge traten die auffälligsten Unterschiede zur Vergleichsgruppe nach etwa einem Jahr auf.[139] Gemäß der Studie starben 50 bis 70 % der behandelten Ratten vor Ablauf des zweijährigen Beobachtungszeitraums, in der Kontrollgruppe 30 %.[140] Bei den männlichen Ratten traten Leberstauung und Lebernekrose 2,5- bis 5,5-mal häufiger auf, schwere Nierenschäden waren 1,3- bis 2,3-mal häufiger festzustellen. Brusttumoren entwickelten sich bei allen behandelten Gruppen vermehrt, dies aber nicht immer in statistisch signifikanter Ausprägung.[139] Die Autoren führen diese Unterschiede auf Endokrine Disruptoren in Roundup sowie der Überexpression im Mais zurück.[140] Bisher wurden gentechnisch veränderte Pflanzen gewöhnlich nur über drei Monate hinweg hinsichtlich ihrer Auswirkungen auf die Gesundheit getestet. Die EU-Kommission gab deshalb eine Überprüfung der Studienergebnisse bei der Europäischen Behörde für Lebensmittelsicherheit (EFSA) in Auftrag.[141]
Die Studie wurde von der Stiftung Ceres finanziert, der etwa 50 Unternehmen angehören, darunter auch Firmen aus der Lebensmittelbranche, die auf gentechnisch veränderte Lebensmittel verzichten (u. a. Auchan und Carrefour).[142][143]
Die Veröffentlichung rief umgehend kritische Reaktionen mehrerer an der Studie unbeteiligter Wissenschaftler hervor, die sich skeptisch gegenüber der Methode und den gezogenen Schlussfolgerungen äußerten. Wesentliche Kritikpunkte an der Studie die von fast allen Kritiken geteilt werden, sind insbesondere statistische Schwächen der Studie, bedingt durch die zu kleine Anzahl an Versuchstieren in zu vielen unterschiedlichen Vergleichsgruppen, welche es schwierig macht statistisch signifikante Ergebnisse zu erlangen. Der zweite große Kritikpunkt an der Studie sei die Tatsache, dass die für die Studie gewählte Rattenart generell dazu neigt diese Art von Tumoren unabhängig von der Fütterung überdurchschnittlich oft zu entwickeln. Die Studie zeige also nur normale zu erwartende statistische Schwankungen, so zeigte z. B. eine der Vergleichsgruppen, die mit dem höchsten Anteil an genmodifizierten Mais gefüttert wurde, sogar die höchste Überlebensrate. Auch, dass Seralini bestimmte Daten, wie z. B. Wachstumsraten oder die Menge des verabreichten Futters, nicht veröffentlichte, wurde kritisiert.[144][145][146][147][148]
Professor Tom Sanders, Ernährungswissenschaftler am King’s College London, nannte die statistischen Methoden unkonventionell und gab u. a. weiteren Informationsbedarf zu Daten der Ernährungszusammensetzung an. Der Pflanzenphysiologe Mark Tester (Universität Adelaide) hinterfragte, falls die Effekte echt und auf den Menschen übertragbar seien, warum vorherige Studien nicht darauf gestoßen seien und warum Nordamerikaner nicht wie die Fliegen sterben würden. Der Statistiker David Spiegelhalter (Universität Cambridge) bezeichnete Methode, Statistik und Ergebnisdarstellung als nicht dem Standard I einer strengen Studie entsprechend. Er verwies darauf, dass die Kontrollgruppe sehr klein und ebenfalls Tumoren entwickelte. Wendy Harwood vom John Innes Centre gab an, dass es erforderlich sei, den gesamten Datensatz zu kennen. Sie sieht in den Ergebnissen Studie den Hinweis auf Bedenken hinsichtlich längerfristiger Aussetzung gegenüber Roundup und formuliert diesbezüglich weiteren Forschungsbedarf. Weitere Wissenschaftler (Rothamsted Research, University of Edinburgh, Sainsbury Laboratory, Imperial College London, University of California, Davis, Universität Melbourne, Walter and Eliza Hall Institute of Medical Research,[146] Universität Wien,[149] Wayne State University[150] University of Wyoming,[151] University of Florida,[152] Stanford University und University of Illinois,[153] Vlaams Instituut voor Biotechnologie,[154] Anses,[155] University of California, Riverside[156]) nannten ähnliche und zusätzliche Kritikpunkte an der Studie.[157][147][148] Gerd Gigerenzer und Walter Krämer erklärten die Studie von Seralini u. a. am 28. September zur „Unstatistik“ des Monats September. Aus statistischer Sicht sei die Meldung, dass genmodifizierter Mais Krebs erzeugen soll, nur als Unfug zu bezeichnen. Die beobachteten Unterschiede in der Krebsmortalität seien nicht signifikant, könnten also sehr leicht allein durch Zufall aufgetreten sein. Dies sei auch daran erkennbar, die die Gruppe von Ratten, welche mit dem höchsten Anteil an Gen-Mais gefüttert wurden, tatsächlich die höchste Überlebensrate hatte.[158] Michael Antoniou, Molekularbiologe am King’s College London und Berater von Seralinis Team sieht in den Ergebnissen der Studie zwei wesentliche Aspekte. Zum einen zeige sich die Notwendigkeit, Fütterungsstudien auf zwei Jahre auszudehnen, zum anderen sei bei Herbiziden und Pestiziden im Kontext einer Toxizitätsprüfung nicht nur der einzelne Wirkstoff zu testen, sondern die gesamte Formulierung in ihrem agrarwirtschaftlichen Zusammenhang.[145] Carl Zimmer[159] (Discover), Steven Novella[160] (Yale University), Thomas Lumley[161] (Universität Auckland) und weitere Kommentatoren[162][163][164][165][166][167] kritisierten, dass Seralini es Journalisten nicht gestattete, die Studie vor der Veröffentlichung anderen Wissenschaftlern zu zeigen, um unabhängige Einschätzungen zu erhalten. Laut Zimmer sollte so ein maximaler medialer Effekt ohne kritische Expertenstimmen erzielt werden und nannte dies eine „widerliche, korrupte Art, Wissenschaftskommunikation zu betreiben“.[168][169]
Monsanto schrieb in einer Reaktion am 20. September, die Studie von Seralinis Gruppe entspreche nicht den akzeptablen Mindeststandards für derartige wissenschaftliche Studien, die Ergebnisse würden durch die vorgelegten Daten nicht gestützt, und die Schlussfolgerungen besäßen für die Zwecke einer Sicherheitsbewertung keine Relevanz. Monsantos Toxikologen und Experten für öffentliche Gesundheit hätten mehrere grundlegende Probleme hinsichtlich der Anlage der Studie festgestellt. Abgesehen davon existiere kein plausibler Mechanismus, der die berichteten Ergebnisse erklären könnte, und die Ergebnisse wichen von vorhandenen extensiven Erfahrungen und wissenschaftlichen Studien ab.[170]
Im Nouvel Observateur nahm Joel Spiroux, Co-Autor der Studie, zu Kritikpunkten Stellung (20. September). Bezüglich der Kritik, dass die Menge der untersuchten Tiere zu gering gewesen sei, gab Spiroux an, dass die Gesamtzahl sowie die Anzahl von 20 pro Versuchsgruppe analog zu derjenigen sei, die Monsanto bei dreimonatigen Fütterungsstudien verwende. Zudem seien mehrere toxische Parameter untersucht worden. Ein Versuch mit einer höheren Grundmenge hätte den finanziellen Rahmen überfordert. Die im Versuch verwendete Rattenlinie würde aufgrund ihrer stabilen Merkmalsausprägung, z. B. bezüglich Gewicht u. ä. seit langem weltweit in der Forschung zu Toxizitätsprüfungen und Auswirkungen gentechnisch veränderter Pflanzen eingesetzt werden, auch von Firmen, die diese herstellen. Zur Kritik, dass die Zusammensetzung des Futters nicht detailliert bekannt gegeben worden sei, berief sich Spiroux auf gängige Standards bei diesen Studien. Des Weiteren sprach er sich für eine Gegenexpertise von unabhängigen Forschern aus.[171]
Der Verband Biologie, Biowissenschaften und Biomedizin in Deutschland (VBIO) erklärte am 21. September, dass die Studie erhebliche Mängel aufweise. Die Studie liefert nach Ansicht des VBIO keine neuen Anhaltspunkte, die aktionistische Schlussfolgerungen rechtfertigen.[144]
In einem Kommentar der Wirtschaftswoche (22. September) stellt Susanne Kutter dar, dass im Bereich Grüne Gentechnik eine sachliche Grundhaltung seitens der Wissenschaft selten ist. So sei es mittlerweile Usus, dass bei Erscheinen einer Studie zum Thema den Autoren von der Gegenseite Käuflichkeit entweder von der Agro-Industrie oder Greenpeace vorgeworfen werde. Die Reaktionen auf Séralinis Studie bildeten hier keine Ausnahme. Der US-Konzern Monsanto habe ein vier Seiten umfassendes Schreiben, das kritische Stimmen zu Seralinis Studie listenförmig aufzählt, als Reaktion auf die Studie herausgegeben, „damit vor allem Journalisten die kritischen Stimmen nicht übersehen sollten“. Séralini habe sich andrerseits geweigert, der EFSA seine Originaldaten zur Verfügung zu stellen, da er bei dieser Behörde, die die Maissorte NK 603 zugelassen hat, einen Interessenskonflikt sehe. Die Studie Séralinis sei so innerhalb kürzester Zeit zum „Gegenstand einer Schlammschlacht geworden“. Daher sei das Ergebnis und die Bedeutung von Seralinis Studie schwer zu evaluieren.[172] Hervé Kempf von Le Monde warf am 22. September die Frage auf, warum ein renommierter Universitätsprofessor wie Séralini zu einem Forschungsprojekt von öffentlichem Interesse Geld privater Stiftungen eruieren müsse, anstatt dass staatliche Stellen von sich aus staatlich verortete Forscher mit neutralen und vertiefenden Forschungen zum Thema beauftragt hätten. So hätten sich Institutionen wie das Centre national de la recherche scientifique oder das Institut national de la recherche agronomique wiederholt auf Studien – gesteuert durch Agrarkonzerne – gestützt, deren vollständiger Datensatz wegen des Geschäftsgeheimnisses oft nicht offengelegt worden sei. Séralini habe durch sein Agieren in den Medien dieses Problem öffentlich gemacht. Kempf sieht hinter den wissenschaftlichen Auseinandersetzungen zur Schädlichkeit des Produkts oder der Technologie auch ein Drama, das frei nach Shakespeare die Beziehung zwischen Geld und Wahrheit widerspiegele.[173]
Zahlreiche Wissenschaftler von INRA, CNRS und weiteren Forschungseinrichtungen kritisierten in einer am 27. September veröffentlichten Petition die Studie und ihre unkritische Medienrezeption und erinnerten an ein im selben Journal erschienenes Review von 24 Studien, die alle die Sicherheit transgener Lebensmittel bestätigten. Auch verwiesen sie darauf, dass keine Gesundheitsbehörde irgendwelche Gesundheitsbedenken für die Millionen von Nutztieren äußerte, die seit mehr als zehn Jahren gentechnisch veränderte Pflanzen fressen, inklusive NK603. Die Wissenschaftler fordern eine Wiederholung der Studie unter strenger Aufsicht von Anses.[174]
Das Bundesinstitut für Risikobewertung (BfR) veröffentlichte am 28. September eine Stellungnahme zu der Studie.[175] Die These, dass Ratten, die ihr Leben lang gentechnisch veränderten Mais erhalten, früher sterben als Tiere, die mit konventionellem Mais gefüttert werden, sei experimentell nicht ausreichend belegt. Reiner Wittkowski, Vizepräsident des Bundesinstituts, sagte: „Die Studie hat sowohl Schwächen im Design als auch in der statistischen Auswertung, so dass die Schlussfolgerungen der Autoren nicht nachvollziehbar sind“. Auch die Aussage, dass möglicherweise die Langzeitaufnahme des glyphosathaltigen Pflanzenschutzmittels Roundup zu schweren Gesundheitsschäden und früherem Versterben führen, sei nicht ausreichend belegt. Zu Glyphosat als herbizidem Wirkstoff lägen zahlreiche Langzeitstudien vor. Krebs, eine höhere Sterblichkeit oder Einflüsse auf das Hormonsystem der Versuchstiere, wie sie die Autoren in der Publikation berichten, seien in diesen Untersuchungen nicht beobachtet worden. Das BfR hat die Autoren deshalb gebeten, den gesamten Studienbericht inklusive der Daten zu den Versuchstieren einzureichen und einen Fragenkatalog zu einer weiterführenden Bewertung der Ergebnisse erstellt.[176]
Das Rijksinstituut voor Volksgezondheid en Milieu (RIVM) veröffentlichte am 1. Oktober eine Bewertung der Studie von Seralini u. a. RIVM kommt zu dem Schluss, dass die Studie zur Feststellung von Kanzerogenität nicht geeignet sei. Die Zahl der Ratten sei zu klein und es fehle eine statistische Analyse.[177]
FSANZ veröffentlichte Anfang Oktober eine vorläufige Stellungnahme zur Studie. FSANZ hält die Relevanz der Studie für begrenzt, vor allem aufgrund der kleinen Zahl der Versuchstiere, selektiver Datenberichterstattung und der Häufigkeit von Tumoren beim verwendeten Rattenstamm. Die angegebene Toxizität von Roundup sei nicht plausibel und widerspreche ordentlich angelegten und durchgeführten Langzeitstudien mit dem Wirkstoff Glyphosat in mehreren Tierarten, wo bei höheren Dosen keine Effekte beobachtet worden seien.[178]
Die EFSA veröffentlichte am 4. Oktober eine erste Auswertung der Seralini-Studie.[179] Die Behörde gelangte zu dem Schluss, dass die Studie nicht den wissenschaftlichen Ansprüchen genügt, um für eine Risikobewertung in Betracht gezogen zu werden. Die EFSA befand das Studiendesign sowie die Präsentation und Interpretation der Studienergebnisse als unzulänglich. Sie bat die Autoren Seralini u. a., wichtige zusätzliche Informationen zur Verfügung zu stellen.[180]
Das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) gelangte in einer ersten, am 5. Oktober veröffentlichten Bewertung der Studie zu dem Ergebnis, dass die Schlussfolgerungen der Autoren nicht gerechtfertigt sind. Gründe dafür seien Unzulänglichkeiten des Studiendesigns sowie die Art der Datenauswertung und der Datenpräsentation.[181]
Die von der französischen Regierung mit einer Bewertung beauftragte Lebensmittelbehörde Anses veröffentlichte am 22. Oktober ihre Ergebnisse. Anses zufolge zieht die Studie von Seralini u. a. vorherige Zulassungsstudien zu NK603 und Roundup nicht in Zweifel. Anses verweist jedoch auf eine kleine Zahl von Langzeitstudien und fordert die nationale und europäische Finanzierung groß angelegter Studien, um verbleibende Wissenslücken über Gesundheitsrisiken zu schließen.[182]
Am 28. November veröffentlichte EFSA eine abschließende Bewertung der Studie. Demnach erfülle die Studie akzeptable wissenschaftliche Standards nicht und könne frühere Sicherheitsbewertungen von NK603 nicht in Zweifel ziehen. EFSA berücksichtigte dabei auch unabhängige Bewertungen der Studie seitens Institutionen in Belgien (Belgian Biosafety Advisory Council), Dänemark (Dänemarks Technische Universität), Frankreich (Anses, HCB), Deutschland (BVL, BfR), Italien (Istituto Superiore di Sanità, Istituto Zooprofilattico Sperimentale delle Regioni Lazio e Tosca) und den Niederlanden (Nederlandse Voedsel- en Warenautoriteit).[183]
Die Studie wurde im November 2013 seitens der Fachzeitschrift zurückgezogen, da die „vorgelegten Ergebnisse keine Schlussfolgerung zulassen“.[184][185] Hiergegen verwahrten sich die Autoren nachdrücklich.[186] Im Juni 2014 wurde die Studie leicht modifiziert in Environmental Sciences Europe wiederveröffentlicht.[187]
Umweltrisiken
Eine Minderheit von Fachleuten, Umweltorganisationen und Behörden vertritt die Ansicht, dass beim Anbau von transgenem Mais verschiedene Umweltrisiken bestehen. Sie argumentieren,
- dass neben den Zielinsekten auch weitere Organismen geschädigt werden können,
- dass ein Anbau von transgenem Mais in Mexiko durch Auskreuzungen auf wilde Artverwandte die Biodiversität verringern könnte.
Ein 2007 veröffentlichtes Review von wissenschaftlicher Literatur und Studien internationaler Organisationen aus zehn Jahren kam zu dem Schluss, dass keine wissenschaftlichen Beweise für Umweltschäden durch die bisher kommerzialisierten transgenen Pflanzen existierten.[188] Vor der Zulassung einer neuen transgenen Sorte zum Anbau sind umfangreiche Sicherheitsstudien erforderlich, die in der Regel mehrere Jahre dauern. Eine neue Sorte darf nur dann zugelassen werden, wenn eine Unbedenklichkeit für die Umwelt bestätigt wurde. Nach dem Beginn des kommerziellen Anbaus einer neuen Sorte ist in der EU zudem ein anbaubegleitendes Monitoring vorgesehen.[189]
Das Bundesamt für Naturschutz (BfN) äußert bezüglich eines Anbaus von Mais 1507 Bedenken. Der Pollen dieser Maissorte enthalte circa 350-mal mehr Insektengift als derjenige der Sorte MON810. Dadurch sieht das BfN eine erhöhte Wahrscheinlichkeit negativer Auswirkungen auf Nichtzielorganismen. Da die giftige Substanz auch im Pollen enthalten ist, können Futterpflanzen geschützter Schmetterlinge eingestäubt werden. Das BfN konstatiert weiteren Forschungsbedarf, da im Zulassungsverfahren bis auf zwei Ausnahmen keine für den Naturschutz bedeutsamen Arten getestet worden seien. Freier Zugang zum Saatgut für unabhängige Forschung seitens der Hersteller wird zudem eingefordert.[190]
Die Bundesregierung förderte seit 1987 über 140 Projekte zur Sicherheitsbewertung von gv-Pflanzen (insbesondere Mais, Kartoffeln, Getreide, Raps), an der über 60 Hochschulen und außeruniversitäre Forschungseinrichtungen beteiligt waren. Neben Laborexperimenten wurden auch zahlreiche Freilandversuche durchgeführt. Das BMBF veröffentlichte nach 25 Förderjahren eine Bilanz. Die vorliegenden Ergebnisse zeigen für den Anbau gv-Pflanzen im Vergleich zu konventionell gezüchteten Pflanzen kein höheres Risiko für Umweltbeeinträchtigungen.[191]
Nichtzielorganismen
Das Bt-Toxin Cry1Ab ist für einige Arten der Gattung Schmetterlinge giftig. Anders als der Maiszünsler ernähren sich nur sehr wenige Schmetterlingsarten von Mais, könnten aber theoretisch indirekt über Bt-Maispollen geschädigt werden, die auf ihrer Nahrung landen. Eine 1999 veröffentlichte Laborstudie stellte eine Schädigung von Monarchfaltern fest, wenn sie mit Bt-Maispollen des Events 11 gefüttert wurden.[192] Daraus wurden in der Öffentlichkeit Befürchtungen abgeleitet, der Anbau von Bt-Mais könnte Populationen des Monarchfalters reduzieren. Weitere Laborexperimente fanden, dass Pollen des Events 176 Monarchfalterlarven schädigen, woraufhin das Event vom Markt genommen wurde. Feldstudien fanden keine Effekte auf Larven durch die verbreiteten Bt-Maisevents (MON810 und Bt 11), die 80-mal weniger Toxin produzieren als Event 176. Sie gaben an, dass die in Laborstudien verwendeten Pollenmengen unter Feldbedingungen unrealistisch hoch seien, und warfen die Frage auf, ob Pollen von Event 11 möglicherweise mit anderen Pflanzenteilen vermischt wurde. bei den derzeit zugelassenen Events seien extrem hohe Pollendichten notwendig, um eine Schädigung von Larven zu erreichen. Zudem fanden Felduntersuchungen, dass nur ein geringer Anteil von 0,8 % der Monarchfalterpopulation Bt-Maispollen ausgesetzt sei. Weiter zu berücksichtigende Faktoren sei die natürliche Mortalität von 80 % während der Larvenphase sowie Verluste durch Habitatzerstörung, Einsatz von Insektiziden und Kollisionen mit Autos.[188]
Das Argument, dass Insektizide den Monarchfalter und andere Nützlinge stärker schädigen als Bt-Mais wird von Jesse & Obrycki (2000) nicht anerkannt, da gemäß Berechnungen der Autoren lediglich 2 % der Maisfläche in Iowa mit Insektiziden behandelt wurden.[193] Die industrienahe Vereinigung „International Life Sciences Institute (ILSI)“ gibt 5–10 % der Flächen mit Insektizidausbringung an.[194]
Eine 2010 veröffentlichte Simulation, kam zu dem Schluss, dass selbst unter pessimistischen Annahmen ein flächendeckender Anbau von Bt-Mais in Europa kaum negative Effekte auf Schmetterlingsarten hätte. Die Autoren errechneten eine maximale Sterblichkeitsrate bei Tagpfauenauge und Admiral von weniger als einem von 1572 Schmetterlingen, bei der Kohlmotte eine von 392. Im Mittel aller Regionen setzten sie sie für Tagpfauenauge und Admiral bei einem von 5000, für die Kohlmotte bei einer auf 4367 an.[195]
Die Auswirkungen auf Nützlinge wie natürliche Feinde und Bestäuber wurde untersucht.
In Labor- und Gewächshausstudien waren natürliche Feinde wie Florfliegen dann negativ betroffen, wenn ihre Beute durch Bt-Toxine geschädigt war. Feldstudien zeigten, dass natürliche Feinde aufgrund der geringeren Beuteverfügbarkeit in Bt-Feldern seltener vorhanden waren. Diese Reduktion wurde als nicht relevant für die Populationsgröße beurteilt, da Florfliegen und andere natürliche Feinde sich polyphag ernähren und daher von der Reduktion bestimmter Beutearten nicht stark betroffen wären.[188]
Zudem würden auch andere Instrumente der Schädlingsbekämpfung das Nahrungsangebot von natürlichen Feinden beeinflussen, und die meisten gegenwärtig genutzten Insektizide (vor allem Breitbandinsektizide wie Pyrethroide und Organophosphate) hätten stärkere negative Auswirkungen auf natürliche Feinde als Bt-Toxine. Zudem zeigen viele Untersuchungen, dass Unterschiede zwischen verschiedenen konventionellen Maissorten im Hinblick auf Effekte auf Nichtzielorganismen größer sind als die Unterschiede zwischen einer Bt-Maissorte und ihrer konventionellen Entsprechung.[196]
Bei zahlreichen Untersuchungen konnten keine statistisch bedeutsamen Unterschiede zwischen Anbauflächen konventioneller Maissorten und Bt-Maissorten auf Bodenmakroorganismen (Fadenwürmer, Springschwänze, Landasseln, Milben und Regenwürmer) festgestellt werden. Die Forscher empfehlen jedoch weitere Studien, da abhängig vom Anbaugebiet unterschiedliche Regenwurmarten in Maisfeldern vorkommen können. Eine Gefährdung regionaler Arten durch Bt-Toxine sollte in Laboruntersuchungen vor einem Anbau geklärt werden.[188][197][198]
Eine 2007 erschienene Metaanalyse wertete 42 Feldexperimente mit Wirbellosen aus. Demnach sind Nichtzielorganismen generell zahlreicher vorhanden in Bt-Baumwoll- und Bt-Maisfeldern als in konventionellen Feldern, die mit Insektiziden behandelt wurden. Bestimmte Taxa kamen jedoch in konventionellen Feldern ohne Insektizidbehandlung häufiger vor als in Bt-Feldern.[199]
Eine 2008 veröffentlichte Übersichtsarbeit zu Auswirkungen von Cry-Proteinen in Bodenökosystemen kam zu dem Schluss, dass wenige oder keine toxischen Effekte von Cry-Proteinen auf Landasseln, Springschwänze, Milben, Regenwürmer, Nematoden, Protozoen, und die Aktivität verschiedener Enzyme im Boden gefunden wurden. Die meisten der wenigen gefundenen Effekte seien größtenteils durch Unterschiede von Standort, Temperatur, Pflanzensorte und Bodentyp bedingt und stünden nicht in Zusammenhang mit der Präsenz von Cry-Proteinen.[200]
Eine 2013 veröffentlichte Metaanalyse von 13 unabhängigen in Spanien durchgeführten Feldversuchen zu 26 Taxa von Gliederfüßern fand keine signifikanten Effekte (Comas u. a., 2013).[201]
Kontroverse um deutsches Anbauverbot von 2009 – Marienkäferlarven
Die deutsche Bundesregierung verhängte im April 2009 ein Anbauverbot von MON810, welches sie vor dem Hintergrund der Schutzklausel mit der Veröffentlichung zweier neuer Studien rechtfertigte. Diese beiden Studien untersuchten in Laborexperimente die Auswirkungen von Bt-Mais auf Daphnien (Bøhn u. a., 2008[202]) und Marienkäfer (Schmidt u. a., 2009[203]) und fanden jeweils negative Effekte. Die Zentrale Kommission für die Biologische Sicherheit konstatierte in einer 2009 veröffentlichten Prüfung der Studien, dass diese eine Reihe gravierender Mängel aufwiesen und nicht belegen, dass MON810 eine Gefährdung von Nicht-Zielorganismen unter Anbaubedingungen hervorrufe.[204] Ricroch u. a. (2010) untersuchten die Studienlage und insbesondere die beiden neuen Studien. Sie verwiesen auf 41 zwischen 2008 und 2009 veröffentlichte Studien, die fast alle keine negativen Effekte gefunden hätten, und 376 zwischen 1996 und 2008 erschienene Publikationen sowie jüngere Meta-Analysen, die ebenso wenig auf konsistente Effekte hingedeutet hätten. Ricroch u. a. (2010) kamen zu dem Schluss, dass die deutsche Regierung den Wissensstand ignoriert und stattdessen selektiv Einzelstudien herausgegriffen habe.[205] Rauschen (2010) attestierte Schmidt u. a. (2009) mehrere methodische Unzulänglichkeiten und Inkonsistenzen sowie ein Ignorieren der vorhandenen Literatur, und bezeichnete die Ergebnisse und Interpretationen von Schmidt u. a. (2009) und ihre Beanspruchung durch die deutsche Regierung als fehlgeleitet.[206] Álvarez-Alfageme u. a. (2011) führten unter Verweis auf Unzulänglichkeiten von Schmidt u. a. (2009) mehrere Experimente unter als realistischer betrachteten Expositionsszenarien durch, die im Ergebnis eine Empfindlichkeit von Marienkäferlarven gegenüber Cry1Ab und Cry3Bb1 nicht bestätigen konnten.[207] Die ZKBS bekräftigte 2011 unter Verweis auf Álvarez-Alfageme u. a. (2011) und Porcar u. a. (2010)[208], dass sie die zu erwartenden Risiken durch den Anbau von MON810 als vernachlässigbar einschätze.[209] Die Gruppe um Angelika Hilbeck, die Schmidt u. a. (2009) veröffentlichte, stellte in einer 2012 veröffentlichten Studie erneut fest, dass Cry1Ab zu einer erhöhten Sterblichkeit bei Marienkäferlarven führe. Hilbeck u. a. (2012) werfen der Romeis-Gruppe der staatlichen Forschungsanstalt Agroscope, Zürich, die 2010 unter Bezug auf die Hilbeck-Studie zu anderen Ergebnissen kam, vor, dass diese bei ihrer Studie die Larven einer zu geringen Menge an Bt-Protein ausgesetzt hätten und deshalb kein Effekt zustande gekommen sei. Der Fütterungsversuch der Hilbeck-Gruppe von 2009 lief kontinuierlich über zehn Tage, die Romeis-Gruppe gab die Bt-haltige Zuckerlösung den Larven nur viermal, immer zu Beginn eines neuen Larvenstadiums, über 24 Stunden. Um zu demonstrieren, dass diese Versuchsanordnung nicht ausreichend sei, führten Hilbeck u. a. 2012 einen Vergleichsversuch mit Maiszünslerlarven durch, gegen welche das Bt-Gen tödlich wirkt. Einer Gruppe wurde sieben Tage lang kontinuierlich Bt-Mais gegeben, der anderen einmalig über 24 Stunden. Bei der ersten Gruppe verstarben alle Larven, wohingegen in der zweiten nur ein Teil der Maiszünslerlarven verstarb.[210][211] Romeis u. a. (2012) betonten in einer Replik auf Hilbeck u. a. (2012), dass das von Cry1Ab ausgehende Risiko vernachlässigbar sei, weil es keine Belege für Schädigungen unter realistischen Expositionsmengen gebe.[212] 2012 warf die Gruppe um Bøhn Ricroch u. a. (2010) schwere wissenschaftliche Fehler, Inkonsistenzen und systematische Selektion von Studienergebnissen vor (Bøhn u. a., 2012)[213].
Honigbienen
Eine Verbindung zwischen Bt-Mais und Bienensterben wurde von Experimenten in Deutschland aufgeworfen.[214] Eine zwischen 2001 und 2004 durchgeführte Untersuchung der Universität Jena untersuchte Auswirkungen von Bt-Maispollen auf die Biene. Generell konnte eine chronisch toxische Wirkung von Bt-Mais der Sorten Bt176 und Mon810 auf gesunde Honigbienenvölker nicht nachgewiesen werden. Als im ersten Untersuchungsjahr die Bienenvölker mit Parasiten (Mikrosporidien) befallen wurden, starben signifikant mehr Bienen, die Pollen mit Bt-Toxinen als Nahrung erhielten. Eine Wechselwirkung des Toxins und Pathogens auf die Epithelzellen des Darms der Honigbiene wird angenommen. Wurde den Bienen ein prophylaktisches Antibiotikum verabreicht zeigten sich keine Unterschiede.[215][216]
Berücksichtigt man die extremen Versuchsbedingungen (Dauer von sechs Wochen, erhöhter Bt-Toxingehalt), dann könne eine toxische Wirkung auf gesunde Bienen unter natürlichen Bedingungen nach den erfolgten umfangreichen Untersuchungen mit großer Sicherheit ausgeschlossen werden. Dieses Ergebnis werde zusätzlich dadurch untermauert, dass Honigbienen selbst in den Agrarräumen mit großen Maisschlägen nur wenig Maispollen sammeln, wenn andere Pflanzen als Pollenquellen zur Verfügung stehen (weniger als drei Prozent).[188][217] Die Jenaer Studie wurde nicht in einer Fachzeitschrift publiziert und konnte nicht repliziert werden.[214]
Kanadische Wissenschaftler fanden keinen Effekt von Pollen des Bt-Mais auf die Bienensterblichkeit.[218] Mexikanische Wissenschaftler konnten keinen Effekt von verschiedenen Sirupen mit Cry1Ab-Protein auf Bienenkolonien feststellen.[219] Die tausendfache der in Pollen enthaltenen Dosis von Cry3b erzeugte keine toxischen Effekte bei Bienenlarven,[220] und die Fütterung von Honigbienen mit Pollen des Cry1Ab-Mais übte keinen Einfluss auf Überlebensrate, Darmflora, oder die Entwicklung der hypopharyngealen Drüsen, in denen die proteinreiche Nahrung für die Brut produziert wird.[221][222][223] Eine 2008 veröffentlichte Meta-Analyse[224] von 25 unabhängigen Studien zu den Auswirkungen von Bt-Toxinen auf die Mortalität von Honigbienen fand keine negativen Effekte der derzeit zugelassenen transgenen Pflanzen auf die Überlebensraten von Larven oder erwachsenen Bienen.[214]
Zudem besteht bei Bienen nur ein geringer Anteil der Proteinaufnahme aus Pollen. Letztlich gibt es auch einen Mangel an geographischer Korrelation zwischen dem Anbau von transgenen Pflanzen und dem Auftreten von Bienensterben. Beispielsweise kam es zu einem Bienensterben in der Schweiz, in der kein Anbau stattfindet.[214]
Laut einem 2007 erschienenen Review zeigten Fütterungsstudien von Larven und adulten Tieren mit Cry1Ab keine Effekte, und weitere Studien, inklusive Feldstudien, hätten dies bestätigt.[188]
Biodiversität
In Mexiko ist der Anbau von transgenem Mais seit 1998 verboten, um Landrassen und wilde Verwandte vor möglichen Auskreuzungen zu schützen. Nach Zeitungsberichten widersetzen sich mexikanische Bauern jedoch diesem Verbot und bauen Bt-Mais an. 2001 veröffentlichte Nature eine kontroverse Studie, die über einen Fund von Transgenen in mexikanischen Mais-Landrassen berichtete. Nature zog die Veröffentlichung wenige Monate später zurück, da „die Datenlage die Veröffentlichung nicht rechtfertige“.[225] Eine 2009 veröffentlichte Studie fand in 1 % von über 100 untersuchten Feldern in Mexiko Bt-Gene in Mais-Landrassen. Dabei ist unklar, ob eine gentechnische Einbringung des Bt-Gens in Landrassen illegalerweise vorgenommen wurde, oder ob die Gene von regulären, illegal angebauten Bt-Maissorten unbeabsichtigt ausgekreuzt wurden.[226] Nach einer Verknappung des Maisangebots Anfang 2007 forderte der mexikanische Bauernverband die Zulassung von transgenem Mais für den Anbau.[227] Im Oktober 2009 wurden zwei Genehmigungen für den Versuchsanbau von transgenem Mais auf knapp 13 ha erteilt. Thema der Untersuchungen ist unter anderem die Frage, ob Mexiko mit transgenen Sorten seine Abhängigkeit von Importen verringern kann.[228] Fast 2000 Wissenschaftler protestierten in einer Petition gegen die Genehmigungen, da ihrer Ansicht nach Auskreuzungen auf Landrassen nicht verhindert werden können.[229] Die Zulassungsbehörden hingegen betonen, dass ein Abstand von 500 m zu konventionellen Feldern eingehalten wird. Zudem soll die Aussaat zu unterschiedlichen Zeitpunkten stattfinden, und umliegende Bauern bezüglich möglicher Auskreuzung befragt werden.[229] Es gibt bisher keine wissenschaftlichen Hinweise dafür, dass eine mögliche Auskreuzung von Transgenen die Biodiversität des Mais verringern könnte. Der Genfluss, der Austausch von Genen zwischen Kultur- und Wildsorten, ist ein natürlicher Vorgang. Ob sich Gene aus konventionellen Hochleistungssorten oder transgenen Sorten in Landsorten dauerhaft etablieren und dadurch die Biodiversität verringern, hängt letztlich davon ab, ob sie den Nachkommen einen Selektionsvorteil verleihen. Laut dem internationalen Mais- und Weizenforschungsinstitut nimmt die Vielzahl der Maisrassen in Mexiko allein durch Einkreuzungen aus Kultursorten nicht ab.[230]
Weblinks
- Datenbank, transgen.de
- Biologische Sicherheitsforschung, transgen.de
Einzelnachweise
- A decade of EU-funded GMO research (2001–2010). Directorate-General for Research and Innovation. Biotechnologies, Agriculture, Food. European Union, 2010, ISBN 978-92-79-16344-9, doi:10.2777/97784 (europa.eu [PDF]): "The main conclusion to be drawn from the efforts of more than 130 research projects, covering a period of more than 25 years of research, and involving more than 500 independent research groups, is that biotechnology, and in particular GMOs, are not per se more risky than e.g. conventional plant breeding technologies." (S. 16)
- Food safety: 20 questions on genetically modified foods. World Health Organization, 2014, abgerufen am 8. März 2018.
- National Academies of Sciences, Engineering, and Medicine: Genetically Engineered Crops: Experiences and Prospects. The National Academies Press, Washington, DC 2016. doi:10.17226/23395. Kurzfassung:Report in Brief. Abgerufen am 8. März 2018.
- https://www.isaaa.org/gmapprovaldatabase/default.asp
- ISAAA GM Approval Database: Maize GM Events. Abgerufen am 8. März 2018.
- H. K. Abbas u. a.: Implications of Bt traits on mycotoxin contamination in maize: Overview and recent experimental results in southern United States. In: J Agric Food Chem. Band 61, Nr. 48, 2013, S. 11759–11770. doi:10.1021/jf400754g
- Canadian Food Inspection Agency: Determination of the Safety of Monsanto Canada Inc.'s Yieldgard™ Insect Resistant Corn (Zea mays L.) Line MON810. Abgerufen am 8. Mai 2018.
- ISAAA: Commercial GM Trait: Herbicide Tolerance. Abgerufen am 12. März 2018.
- A. Bravo u. a.: Mode of action of Bacillus thuringiensis Cry and Cyt toxins and their potential for insect control. In: Toxicon. Band 49, Nr. 4, 2007, S. 423–435. doi:10.1016/j.toxicon.2006.11.022
- I. Icoz, G. Stotzky: Fate and effects of insect-resistant Bt crops in soil ecosystems. In: Soil Biology & Biochemistry. Band 40, Nr. 3, 2008, S. 559–586. doi:10.1016/j.soilbio.2007.11.002
- BVL: Dipel ES. Abgerufen am 12. März 2018.
- B. E. Tabashnik, Y. Carriere: Surge in insect resistance to transgenic crops and prospects for sustainability. In: Nat Biotechnol. Band 35, Nr. 10, 2017, S. 926–935. doi:10.1038/nbt.3974
- Y. Carriere u. a.: Can Pyramids and Seed Mixtures Delay Resistance to Bt Crops? In: Trends Biotechnol. Band 34, Nr. 4, 2016, S. 291–302. doi:10.1016/j.tibtech.2015.12.011
- J. J. Estruch u. a.: Vip3A, a novel Bacillus thuringiensis vegetative insecticidal protein with a wide spectrum of activities against lepidopteran insects. In: Proc Natl Acad Sci USA. Band 93, Nr. 11, 1996, S. 5389–5394. PMID 8643585
- J. Zhang u. a.: Next-Generation Insect-Resistant Plants: RNAi-Mediated Crop Protection. In: Trends in Biotechnology. Band 35, Nr. 9, 2017, S. 871–882. doi:10.1016/j.tibtech.2017.04.009
- P. M. Bachman u. a.: Characterization of the spectrum of insecticidal activity of a double-stranded RNA with targeted activity against Western Corn Rootworm (Diabrotica virgifera virgifera LeConte). In: Transgenic Res. Band 22, Nr. 6, 2013, S. 1207–1222 (doi:10.1007/s11248-013-9716-5)
- ISAAA: Gene List, dvsfn7. Abgerufen am 17. März 2018.
- ISAAA: Event Name:BVLA430101. Abgerufen am 17. März 2018.
- E. Waltz: Tiptoeing around transgenics. In: Nat Biotechnol. Band 30, Nr. 3, 2012, S. 215–217. doi:10.1038/nbt.2143
- K. J. Kramer u. a.: Transgenic avidin maize is resistant to storage insect pests. In: Nat Biotechnol. Band 18, Nr. 6, 2000, S. 670–674. doi:10.1038/76531
- J. T. Christeller u. a.: The Use of Biotin-Binding Proteins for Insect Control. In: Journal of Economic Entomology. Band 103, Nr. 2, 2010, S. 497–508. doi:10.1603/EC09149
- E. Fraser u. a.: Biotechnology or organic? Extensive or intensive? Global or local? A critical review of potential pathways to resolve the global food crisis. In: Trends in Food Science & Technology. Band 48, 2016, S. 78–87. doi:10.1016/j.tifs.2015.11.006
- ISAAA: Event Name: 3272. Abgerufen am 19. März 2018.
- E. Waltz: Amylase corn sparks worries. In: Nature Biotechnology Band 29,Nr. 4, 2011, S. 294. doi:10.1038/nbt0411-294
- D. W. Ow: GM maize from site-specific recombination technology, what next? In: CurrOpinBiotechnol. Band 18, 2007, S. 115–120. doi:10.1016/j.copbio.2007.02.004
- ISAAA: Event Name: LY038. Abgerufen am 19. März 2018.
- E. A. Rice u. a.: Expression of a truncated ATHB17 protein in maize increases ear weight at silking. In: PLoS ONE. Band 9, Nr. 4, 2014, Artikel e94238. doi:10.1371/journal.pone.0094238
- ISAAA: GM Events with Increased Ear Biomass. Abgerufen am 18. März 2018.
- P. Castiglioni u. a.: Bacterial RNA chaperones confer abiotic stress tolerance in plants and improved grain yield in maize under water-limited conditions. In: Plant Physiol. Band 147, Nr. 2, 2008, S. 446–455. doi:10.1104/pp.108.118828
- ISAAA: GM Crop Event List/MON87460. Abgerufen am 17. März 2018.
- E. Waltz: Beating the heat. In: Nat Biotechnol. Band 32, Nr. 7, 2014, S. 610–613. doi:10.1038/nbt.2948
- M. Eisenstein: Plant breeding: Discovery in a dry spell. In: Nature. Band 501, Nr. 7468, 2013, S. 7–9. doi:10.1038/501S7a
- C. Mariani, M. De Beuckeleer, J. Truettner, J. Leemans, R. B. Goldberg: Induction of male sterility in plants by a chimaeric ribonuclease gene. In: Nature. Band 347, 1990, S. 737–741. doi:10.1038/347737a0
- Y. Wu u. a.: Development of a novel recessive genetic male sterility system for hybrid seed production in maize and other cross-pollinating crops. In: Plant Biotechnol J. Band 14, Nr. 3, S. 1046–1054 (doi:10.1111/pbi.12477)
- ISAAA: Global Status of Commercialized Biotech/GM Crops: 2016. ISAAA Brief No. 52. (PDF) Abgerufen am 20. März 2018.
- Anbau gentechnisch veränderter Pflanzen in der EU 2017. In: transgen.de, 15. Januar 2018, abgerufen am 15. April 2018.
- Y. Devos u. a.: Resistance evolution to the first generation of genetically modified Diabrotica-active Bt-maize events by western corn rootworm: management and monitoring considerations. In: Transgenic Res. Band 22, Nr. 2, 2013, S. 269–299. doi:10.1007/s11248-012-9657-4
- European Commission: EU register of authorised GMOs. Abgerufen am 20. März 2018.
- G. Brookes, P. Barfoot: Farm income and production impacts of using GM crop technology 1996–2015. In: GM Crops Food. Band 8, Nr. 3, 2017, S. 156–193. doi:10.1080/21645698.2017.1317919
- National Academies of Sciences, Engineering, and Medicine: Genetically Engineered Crops: Experiences and Prospects. The National Academies Press, Washington, DC 2016, Chapter 6 doi:10.17226/23395
- G. Brookes: Twenty-one years of using insect resistant (GM) maize in Spain and Portugal: farm-level economic and environmental contributions. In: GM Crops Food. Band 10, Nr. 2, 2019, S. 90–101. doi:10.1080/21645698.2019.1614393
- ISAAA: GM Approval Database. Abgerufen am 28. März 2018.
- ISAAA: GM Crop Events approved in European Union. Abgerufen am 28. März 2018.
- USDA Foreign Agricultural Service: EU-28 Agricultural Biotechnology Annual 2017. (PDF) Abgerufen am 22. März 2018.
- Richtlinie (EU) 2015/412 des Europäischen Parlaments und des Rates vom 11. März 2015 zur Änderung der Richtlinie 2001/18/EG zu der den Mitgliedstaaten eingeräumten Möglichkeit, den Anbau von gentechnisch veränderten Organismen (GVO) in ihrem Hoheitsgebiet zu beschränken oder zu untersagen, abgerufen am 22. März 2018
- D. Eriksson u. a.: Why the European Union needs a national GMO opt-in mechanism. In: Nature Biotechnology. Band 36, Nr. 1, 2018, S. 18–19. doi:10.1038/nbt.4051
- Umweltministerium und Ministerium Ländlicher Raum Baden-Württemberg: Ergebnisse von bundesweitem GVO-Saatgut-Monitoring liegen vor. Abgerufen am 22. März 2018.
- Bundesamt für Lebensmittelsicherheit und Veterinärwesen: GVO-Bewilligungsliste. (PDF) Abgerufen am 28. März 2018.
- Verlängerung Moratorium. Abgerufen am 26. Dezember 2021.
- ISAAA Database: GM Crop Events approved in Russian Federation. Abgerufen am 28. März 2018.
- ISAAA Database: Countries with GM Crop Approvals. Abgerufen am 28. März 2018.
- Europäische Regelungen zur Gentechnikkennzeichnung von Lebensmitteln. (Memento vom 21. Februar 2014 im Internet Archive) BMELV, abgerufen am 30. Juli 2012.
- Bayerischer Verwaltungsgerichtshof: Beschluss vom 21. Juni 2007 (Aktenzeichen: 22 CE 07.1294). (PDF; 69 kB), abgerufen am 30. Juli 2012.
- Honig vor Gericht: Sind Pollen aus gentechnisch veränderten Pflanzen im Honig erlaubt oder verboten? Transgen.de, 28. März 2012, abgerufen am 30. Juli 2012.
- Honig mit Pollen aus gentechnisch veränderten Pflanzen: Zulassung erforderlich. Transgen.de, 6. September 2011, abgerufen am 30. Juli 2012.
- Honig und Nahrungsergänzungsmittel, die den Pollen eines GVO enthalten, sind aus GVO hergestellte Lebensmittel, die nicht ohne vorherige Zulassung in den Verkehr gebracht werden dürfen. (PDF; 84 kB), Pressemitteilung 79/11. Urteil in der Rechtssache C-442/09, Karl Heinz Bablok u. a. / Freistaat Bayern. EuGH, 6. September 2011, abgerufen am 30. Juli 2012.
- Urteil: Honig mit gv-Pollen braucht Zulassung. (Memento vom 22. Juni 2015 im Internet Archive) Biotechnologie.de, 7. September 2011, abgerufen am 30. Juli 2012.
- Lebensmitteldatenbank: Honig. Transgen.de, 3. Januar 2012, abgerufen am 30. Juli 2012.
- Cornell, CALS: A Method to Measure the Environmental Impact of Pesticide. Abgerufen am 12. April 2018.
- G. Brookes, P. Barfoot: Environmental impacts of genetically modified (GM) crop use 1996–2014: Impacts on pesticide use and carbon emissions. In: GM Crops Food. Band 7, Nr. 2, 2016, S. 84–116. doi:10.1080/21645698.2016.1192754
- A. S. Davis, G. B. Frisvold: Are herbicides a once in a century method of weed control? In: Pest Manag Sci. Band 73, Nr. 11, 2017, S. 2209–2220. doi:10.1002/ps.4643
- G. Schütte u. a.: Herbicide resistance and biodiversity: agronomic and environmental aspects of genetically modified herbicide-resistant plants. In: Environ Sci Eur. Band 29,Nr. 1, 2017, S. 5, doi:10.1186/s12302-016-0100-y
- J. W. Haegele, F. E. Below: Transgenic Corn Rootworm Protection Increases Grain Yield and Nitrogen Use of Maize. In: Crop Science. Band 53, 2013, S. 585–594. doi:10.2135/cropsci2012.06.0348
- G. Brookes, P. Barfoot: Environmental impacts of genetically modified (GM) crop use 1996–2014: Impacts on pesticide use and carbon emissions. In: GM Crops Food. Band 7, Nr. 2, 2016, S. 84–116. doi:10.1080/21645698.2016.1192754
- W. D. Hutchison u. a.: Areawide suppression of European corn borer with Bt maize reaps savings to non-Bt maize growers. In: Science. Band 330, Nr. 6001, 2010, S. 222–225. doi:10.1126/science.1190242
- G. P. Dively u. a.: Regional pest suppression associated with widespread Bt maize adoption benefits vegetable growers. In: Proc Natl Acad Sci USA. Band 115, Nr. 13, 2018, S. 3320–3325. doi:10.1073/pnas.1720692115
- E. Pellegrino u. a.: Impact of genetically engineered maize on agronomic, environmental and toxicological traits: a meta-analysis of 21 years of field data. In: Sci Rep. Band 8, Nr. 1, 2018, S. 3113. doi:10.1038/s41598-018-21284-2
- G. U. Ryffel: Transgene flow: Facts, speculations and possible countermeasures. In: GM Crops Food. Band 5, Nr. 4, 2014, S. 249–258. doi:10.4161/21645698.2014.945883
- M. Trtikova u. a.: Teosinte in Europe – Searching for the Origin of a Novel Weed. In: Sci Rep. Band 7, Nr. 1, 2017, S. 1560. doi:10.1038/s41598-017-01478-w
- Y. Devos u. a.: Teosinte and maize × teosinte hybrid plants in Europe−Environmental risk assessment and management implications for genetically modified maize. In: Agriculture, Ecosystems & Environment. Band 259, 2018, S. 19–27. doi:10.1016/j.agee.2018.02.032
- B. E. Tabashnik, Y. Carriere: Surge in insect resistance to transgenic crops and prospects for sustainability. In: Nat Biotechnol. Band 35, Nr. 10, 2017, S. 926–935. doi:10.1038/nbt.3974
- B. E. Tabashnik, F. Gould: Delaying corn rootworm resistance to Bt corn. In: J.Econ.Entomol. Band 105, Nr. 3, 2012, S. 767–776. doi:10.1603/EC12080
- J. Deitloff u. a.: Effects of refuges on the evolution of resistance to transgenic corn by the western corn rootworm, Diabrotica virgifera virgifera LeConte. In: Pest Manag Sci. Band 72, Nr. 1, 2016, S. 190–198. doi:10.1002/ps.3988
- H. K. Abbas u. a.: Implications of Bt traits on mycotoxin contamination in maize: Overview and recent experimental results in southern United States. In: J Agric Food Chem. (Journal of Agricultural and Food Chemistry) Band 61, Nr. 48, 2013, S. 11759–11770. doi:10.1021/jf400754g
- Sicherheitsbewertung genetisch veränderter Lebens- und Futtermittel – BfR. In: bund.de. Abgerufen am 15. Januar 2020.
- A. S. M. Society: Statement of the American Society for Microbiology on Genetically Modified Organisms. (Memento vom 4. März 2016 im Internet Archive) asm.org, 2000, abgerufen am 12. Februar 2014.
- The Safety of Genetically Modified Foods Produced through Biotechnology. SOT, 2002. (toxicology.org (Memento vom 1. März 2012 im Internet Archive))
- Statement on Plant Genetic Engineering (Memento vom 28. Dezember 2013 im Internet Archive), ASPB
- ASCB Statement in Support of Research on Genetically Modified Organisms, ASCB
- New Genetics, Food and Agriculture: Scientific Discoveries – Societal Dilemas (2003), ICSU (2003)
- Committee on Identifying and Assessing Unintended Effects of Genetically Engineered Foods on Human Health: Safety of Genetically Engineered Foods: Approaches to Assessing Unintended Health Effects. Institute of Medicine & National Research Council. The National Academies Press, 2004, ISBN 0-309-09209-4, S. 8.
- Genetically modified foods and health: a second interim statement. (PDF; 110 kB). British Medical Association, 2004.
- GM Plants. Questions and Answers. The Royal Society, Mai 2016.
- Sicurezza alimentare e OGM Consensus Document
- Gibt es Risiken für den Verbraucher beim Verzehr von Nahrungsprodukten aus gentechnisch veränderten Pflanzen? (Memento vom 10. Oktober 2006 im Internet Archive) (PDF; 153 kB). Union der deutschen Akademien der Wissenschaften.
- Umweltforschungsplan des Bundesministeriums für Umwelt, Naturschutz und Reaktorsicherheit, Forschungsbericht 201 67 430/06, UBA – FB 000514, Müller u. a: Alternativen zu gentechnisch veränderten Pflanzen, Umweltbundesamt Wien, 2002.
- V. Ostry, J. Ovesna, J. Skarkova, V. Pouchova, J. Ruprich: A review on comparative data concerning Fusarium mycotoxins in Bt maize and non-Bt isogenic maize. In: Mycotoxin Research. Band 26, 2010, S. 141–145, doi:10.1007/s12550-010-0056-5.
- Felicia Wu: Bt corn and impact on mycotoxins. In: CAB Reviews: Perspectives in Agriculture, Veterinary Science, Nutrition and Natural Resources. Band 2, Nr. 060, 2007, S. 1–8.
- Gary Munkvold: Maize Management to Minimize Mycotoxins. In: John F. Leslie, Antonio Logrieco (Hrsg.): Mycotoxin Reduction in Grain Chains. John Wiley & Sons, 2014, ISBN 978-0-8138-2083-5, S. 59–77.
- A. König, A. Cockburn, R. W. R. Crevel, E. Debruyne, R. Grafstroem, U. Hammerling, I. Kimber, I. Knudsen, H. A. Kuiper, A. A. C. M. Peijnenburg, A. H. Penninks, M. Poulsen, M. Schauzu, J. M. Wal: Assessment of the safety of foods derived from genetically modified (GM) crops. (PDF; 890 kB). In: Food and Chemical Toxicology. Band 42, 2004, S. 1047–1088.
- A. Aumaitre: Safety assessment and feeding value for pigs, poultry and ruminant animals of pest protected (Bt) plants and herbicide tolerant (glyphosate, glufosinate) plants: interpretation of experimental results observed worldwide on GM plants. In: Italian Journal of Animal Science. Band 3, 2004, S. 107–121. (PDF)
- Gerhard Flachowsky, Andrew Chesson, Karen Aulrich: Animal nutrition with feeds from genetically modified plants. (Memento vom 3. März 2016 im Internet Archive) (PDF; 247 kB). In: Archives of Animal Nutrition. Band 59, 2005, S. 1–40.
- Modern food biotechnology, human health and development: an evidence-based study. (PDF; 1,2 MB). WHO, 2005, S. iii.
- J. Domingo: Toxicity Studies of Genetically Modified Plants: A Review of the Published Literature. (Memento vom 13. April 2012 im Internet Archive) (PDF; 127 kB). In: Critical Reviews in Food Science and Nutrition. Band 47, 2007, S. 721–733.
- Australian Academy of Science: Statement on gene technology and gm plants. (Memento vom 3. März 2014 im Internet Archive) 2007.
- GMO Panel: Safety and nutritional assessment of GM plants and derived food and feed: The role of animal feeding trials. (PDF; 850 kB). In: Food and Chemical Toxicology. Band 46, 2008, S. S2–S70.
- Suzie Key, Julian K.-C. Ma, Pascal M. W. Drake: Genetically modified plants and human health. In: Journal of the Royal Society of Medicine. Band 101, Nummer 6, 2008, S. 290–298, doi:10.1258/jrsm.2008.070372.
- Maddalena Querci, Gijs Kleter, Jean-Paul Malingreau, Hermann Broll, Guy Van den Eede: Scientific and technical contribution to the development of an overall health strategy in the area of GMOs. (Memento vom 20. November 2011 im Internet Archive) (PDF; 6,3 MB). JRC Reference Reports, European Communities, 2008.
- Peggy G. Lemaux: Genetically Engineered Plants and Foods: A Scientist’s Analysis of the Issues (Part I). (PDF; 342 kB). In: Annual Review of Plant Biology. Band 59, 2008, S. 771–812.
- Javier A Magaña-Gómez, Ana M Calderón de la Barca: Risk assessment of genetically modified crops for nutrition and health. In: Nutrition Reviews. Band 67, 2009, S. 1–16.
- A decade of EU-funded GMO research (2001–2010). Europäische Kommission, 2010.
- José L. Domingo, Jordi Giné Bordonaba: A literature review on the safety assessment of genetically modified plants. (PDF; 267 kB). In: Environment International. Band 37, 2011, S. 734–742.
- Chelsea Snell, Aude Bernheim, Jean-Baptiste Bergé, Marcel Kuntz, Gérard Pascal, Alain Paris, Agnès E. Ricroch: Assessment of the health impact of GM plant diets in long-term and multigenerational animal feeding trials: A literature review. In: Food and Chemical Toxicology. Band 50, Nr. 3–4, 2012, S. 1134–1148, doi:10.1016/j.fct.2011.11.048.
- Nutzen und Risiken der Freisetzung gentechnisch veränderter Pflanzen. Nationales Forschungsprogramm NFP 59. 3.1 Gesundheitliche Aspekte gentechnisch veränderter Pflanzen mit Relevanz für die Schweiz. (nfp59.ch (Memento vom 18. März 2016 im Internet Archive))
- H-480.958 Bioengineered (Genetically Engineered) Crops and Foods. (Memento vom 8. Juli 2013 im Internet Archive)
- Introduction of recombinant DNA-engineered organisms into the environment : key issues. National Academy Press, 1987, OCLC 474129616. (heartland.org (Memento vom 18. Dezember 2014 im Internet Archive))
- Alessandro Nicolia, Alberto Manzo, Fabio Veronesi, Daniele Rosellini: An overview of the last 10 years of genetically engineered crop safety research. In: Critical Reviews in Biotechnology. 2013, S. 1–12, doi:10.3109/07388551.2013.823595.
- A. L. Van Eenennaam, A. E. Young: Prevalence and impacts of genetically engineered feedstuffs on livestock populations. In: Journal of Animal Science. 2014, doi:10.2527/jas.2014-8124.
- Genetically Engineered Crops: Experiences and Prospects. National Academies of Sciences, Engineering, and Medicine. 2016.
- Séralini gewinnt Prozess. In: Gen-ethischer Informationsdienst. April 2011, S. 40–42, www.criigen.fr, 20.01.11; www.corporateeurope.org, 19.01.11 (Memento vom 23. November 2012 im Internet Archive)
- Marc Mennessier: Un chercheur condamné pour diffamation. Le Pr Fellous avait contesté l’«indépendance» d’un confrère anti-OGM. In: Le Figaro. 19. Januar 2011, (online, abgerufen 30. Oktober 2011).
- Artemis Dona, Ioannis S. Arvanitoyannis: Health Risks of Genetically Modified Foods. (Memento vom 21. April 2013 im Internet Archive) (PDF; 131 kB). In: Critical Reviews in Food Science and Nutrition. Vol. 49, Nr. 2, 2009, S. 164–175. doi:10.1080/10408390701855993
- Craig Rickard: Letter to the Editor. In: Critical Reviews in Food Science and Nutrition. Band 50, 2009, S. 85–91, doi:10.1080/10408390903467787.
- Klaus Ammann: Rebuttal to a review of Dona and Arvanitoyannis 2009. (PDF; 938 kB), abgerufen am 30. Juli 2012.
- Alberto Finamore, Marianna Roselli, Serena Britti, Giovanni Monastra, Roberto Ambra, Aida Turrini, Elena Mengheri: Intestinal and Peripheral Immune Response to MON810 Maize Ingestion in Weaning and Old Mice. In: Journal of Agricultural and Food Chemistry. November 2008, doi:10.1021/jf802059.
- O. Nakajima, R. Teshima, K. Takagi, H. Okunuki, J. Sawada: ELISA method for monitoring human serum IgE specific for Cry1Ab introduced into genetically modified corn. In: Regulatory Toxicology and Pharmacology. Band 47, 2007, S. 90–95.
- R. Batista, B. Nunes, M. Carmo, C. Cardoso, H. S. José, A. B. de Almeida, A. Manique, L. Bento, C. P. Ricardo, M. M. Oliveira: Lack of detectable allergenicity of transgenic maize and soya samples. In: Journal of Allergy and Clinical Immunology. Band 116, 2005, S. 403–410.
- S. G. Buzoianu, M. C. Walsh, M. C. Rea, O. O’Sullivan, P. D. Cotter, R. P. Ross, G. E. Gardiner, P. G. Lawlor: High-throughput sequence-based analysis of the intestinal microbiota of weanling pigs fed genetically modified MON 810 maize expressing Bacillus thuringiensis Cry1Ab (Bt maize) for 31 days. In: Applied Environmental Microbiology. Band 78, 2012, S. 4217–4224.
- M. C. Walsh, S. G. Buzoianu, M. C. Rea, O. O’Donovan, E. Gelencse, G. Ujhelyi, R. P. Ross, G. E. Gardiner, P. G. Lawlor: Effects of Feeding Bt MON810 Maize to Pigs for 110 Days on Peripheral Immune Response and Digestive Fate of the cry1Ab Gene and Truncated Bt Toxin. In: PLoS ONE. Band 7, 2012, S. e36141.
- EFSA: Scientific Opinion on a request from the European Commission related to the safeguard clause notified by Greece on genetically modified maize MON 810 according to Article 23 of Directive 2001/18/EC. In: EFSA Journal. Band 10, Nr. 9, 2012, S. 2877, doi:10.2903/j.efsa.2012.2877.
- A. Velimirov, C. Binter, J. Zentek: Biological effects of transgenic maize NK603 x MON810 Biological effects of transgenic maize NK603xMON810 fed in long term reproduction studies in mice- Studie. Veterinärmedizinische Universität Wien und Forschungsinstitut für biologischen Landbau, 2008.
- EFSA: Scientific Opinion of the Panel on Genetically Modified Organisms on a request from the European Commission related to the safeguard clause invoked by Austria on maize MON810 and T25 according to Article 23 of Directive 2001/18/EC. In: EFSA Journal. Band 891, 2008, S. 1–64, doi:10.2903/j.efsa.2008.891.
- Safety Assessment of Yieldgard Rootworm Corn. (Memento vom 29. November 2006 im Internet Archive) Monsanto.com.
- B. Hammond, J. Lemen, R. Dudek, D. Ward, C. Jiang, M. Nemeth, J. Burns: Results of a 90-day safety assurance study with rats fed grain from corn rootworm-protected corn. (PDF; 219 kB). In: Food and Chemical Toxicology. Band 44, 2006, S. 147–160.
- MON863. Transgen.de, 13. Januar 2006, abgerufen am 30. Juli 2012.
- EFSA bleibt dabei: Keine Bedenken bei gv-Mais MON863. Biosicherheit.de, 28. Juni 2007, abgerufen am 30. Juli 2012.
- Keine Geheimnisse in Sicherheitsfragen. Biosicherheit.de, 24. Juni 2005, abgerufen am 30. Juli 2012.
- Gilles-Eric Seralini, Dominique Cellier, Joel Spiroux de Vendomois: New Analysis of a Rat Feeding Study with a Genetically Modified Maize Reveals Signs of Hepatorenal Toxicity. (Memento vom 3. September 2011 im Internet Archive) (PDF; 126 kB). In: Archives of Environmental Contamination and Toxicology. Band 52, 2007, S. 596–602.
- J. Doull, D. Gaylor, H. A. Greim, D. P. Lovell, B. Lynch, I. C. Munro: Report of an Expert Panel on the reanalysis by Séralini u. a. (2007) of a 90-day study conducted by Monsanto in support of the safety of a genetically modified corn variety (MON 863). (PDF; 251 kB). In: Food and Chemical Toxicology. Vol. 45, Nr. 11, 2007, S. 2073–2085.
- Statistisch signifikante Unterschiede treten in praktisch allen Fütterungsstudien auf. BioSicherheit.de, 4. Juni 2007, abgerufen am 30. Juli 2012.
- FSANZ reaffirms its risk assessment of genetically modified corn MON 863. FSANZ, 25 Juli 2007. (Memento vom 29. Juni 2011 im Internet Archive)
- Joël Spiroux de Vendômois, François Roullier, Dominique Cellier, Gilles-Eric Séralin: A Comparison of the Effects of Three GM Corn Varieties on Mammalian Health. In: International Journal of Biological Sciences. Band 5, 2009, S. 706–726.
- Monsanto Response: de Vendômois u. a. 2009, (Memento vom 10. März 2016 im Internet Archive) (PDF; 176 kB), Monsanto.com, 16. Februar 2010, abgerufen am 30. Juli 2012.
- Minutes of the 55th Plenary Meeting of the Scientific Panel on Genetically Modified Organisms held on 27–28 January 2010 in Parma, Italy. EFSA, 10. März 2010, abgerufen am 30. Juli 2012.
- EFSA-Gutachten: Erneut keine Sicherheitsbedenken bei Gentechnik-Mais MON863. Transgen.de, 7. April 2010, abgerufen am 30. Juli 2012.
- EFSA Panel on Genetically Modified Organisms: Scientific Opinion on an application (EFSA-GMO-RX-MON863) for renewal of the authorisation for continued marketing of existing feed materials, feed additives and food additives produced from maize MON863, under Regulation (EC) No 1829/2003 from Monsanto. In: EFSA Journal. Band 82010, S. 1562.
- FSANZ response to de Vendomois et al. (2009), A comparison of the Effects of Three GM Corn Varieties on Mammalian Health, Int. J. Biol. Sci. 5(7), S. 706–726. (Memento vom 29. März 2011 im Internet Archive) Food Standards Australia New Zealand (FSANZ), 2009, abgerufen am 30. Juli 2012.
- J. Spiroux de Vendômois, F. Roullier, D. Cellier, G. E. Séralini: Opinion relating to the deposition of 15 December 2009 by the Member of Parliament, François Grosdidier, as to the conclusions of the study entitled „A comparison of the effects of three GM corn varieties on mammalian health“. (Memento vom 5. November 2013 im Internet Archive) In: Int. J. Biol. Sci. Band 5, Nr. 7, 2009, S. 706–726. High Council of Biotechnologies. Scientific Committee, 2009 (Übersetzung der Food Standards Agency).
- Un maïs OGM de Monsanto soupçonné de toxicité. In: Le Monde.fr. 19. September 2012.
- Gilles-Eric Séralini, Emilie Clair, Robin Mesnage, Steeve Gress, Nicolas Defarge, Manuela Malatesta, Didier Hennequin, Joël Spiroux de Vendômois: Long term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize. In: Food and Chemical Toxicology. 2012, online veröffentlicht am 19. September 2012.
- Ist Gentechnik-Mais doch schädlich? In: Der Standard. 19. September 2012.
- Auchan et Carrefour ont aidé à financer l’étude sur les OGM. In: L’express. 21. September 2012, abgerufen am 2. Oktober 2012.
- Todbringender Genmais. (Memento vom 23. September 2012 im Internet Archive) In: ARTE Journal. 21. September 2012.
- Rattenstudie mit genmodifiziertem Mais - Biologenverband sieht schwere Mängel. (Memento vom 30. September 2012 im Internet Archive)
- Scientists Discredit GMO-Fed Rat Study Results. In: The Inquisitr. 20. September 2012.
- Ashley Ng: Genetically modified corn and cancer – what does the evidence really say?. In: The Conversation. 25. September 2012, abgerufen am 2. Oktober 2012.
- Study on Monsanto GM corn concerns draws scepticism. Reuters, 19. September 2012.
- GM Corn-Tumor Link Based on Poor Science. (Memento vom 3. Januar 2013 im Internet Archive) news.discovery.com, 20. September 2012.
- Interview mit Michelle Epstein: „Statistiken schlecht gemacht“. derStandard.at, 21. September 2012, abgerufen am 2. Oktober 2012.
- Orac: Bad science about GMOs: It reminds me of the antivaccine movement. Respectful Insolence, 24. September 2012, abgerufen am 2. Oktober 2012.
- Andrew Kniss: Why I think the Seralini GM feeding trial is bogus Control Freaks, 19. September 2012, abgerufen am 2. Oktober 2012.
- Illumination: Rats, Tumors and Critical Assessment of Science. In: kfolta.blogspot.be. Abgerufen am 15. Januar 2020.
- Henry Miller: Scientists Smell A Rat In Fraudulent Genetic Engineering Study. Forbes.com, 25. September 2012, abgerufen am 2. Oktober 2012.
- VIB concludes that Séralini study is not substantiated. (Memento vom 12. März 2015 im Internet Archive) VIB, 8. Oktober 2012.
- Lacunes, résultats inexplicables: l’étude anti-OGM sur la sellette. In: Le Huffington Post. Abgerufen am 15. Januar 2020.
- Experts Question Validity of GMO Cancer Study. (Memento vom 22. Juni 2015 im Internet Archive) VOA, 16. Oktober 2012.
- Expert reaction to GM maize causing tumours in rats. (Memento vom 22. September 2012 im Internet Archive) Science Media Centre, 19. September 2012.
- RWI Essen – Unstatistik. In: RWI Essen. Abgerufen am 15. Januar 2020.
- From Darwinius to GMOs: Journalists Should Not Let Themselves Be Played. In: The Loom. Abgerufen am 15. Januar 2020.
- NeuroLogica Blog >> The GM Corn Rat Study. In: theness.com. Abgerufen am 15. Januar 2020.
- Roundup scare. In: statschat.org.nz. Abgerufen am 15. Januar 2020.
- Authors of study linking GM corn with rat tumors manipulated media to prevent criticism of their work. In: Boing Boing. Abgerufen am 15. Januar 2020.
- Ratten-Versuch von Seralini: Der kalkulierte Genmais-Schock. In: Spiegel online. 28. September 2012, abgerufen am 15. Januar 2020.
- Keine Gesundheitsgefährdung: Vielfältige Kritik an Studie zu Gentech-Mais. In: Neue Zürcher Zeitung. 2. Oktober 2012, abgerufen am 15. Januar 2020.
- Are GMO foods safe? Opponents are skewing the science to scare people. In: Slate Magazine. Abgerufen am 15. Januar 2020.
- Rat study sparks GM furore. In: Nature News & Comment. Abgerufen am 15. Januar 2020.
- GM corn and cancer: the Séralini affair. Cosmos, 9. Oktober 2012. (cosmosmagazine.com (Memento vom 20. Januar 2013 im Webarchiv archive.today))
- French GM-fed rat study triggers furore. In: BBC News. Abgerufen am 15. Januar 2020.
- Monsanto Corn Study In France Finds Tumors And Organ Damage In Rats. In: The Huffington Post. Abgerufen am 15. Januar 2020.
- monsanto.com
- OGM : 9 critiques et 9 réponses sur l’étude de Séralini. In: Le nouvel observateur. 20. September 2012.
- Susanne Kutter: Minenfeld Genfood. In: Wirtschaftswoche. 22. September 2012.
- Hervé Kempf: OGM: Qu'a fait l’État? In: Le Monde. 22. September 2012.
- CNRS: Centre national de la recherche scientifique – Pour un débat raisonné sur les OGM. (Nicht mehr online verfügbar.) In: cnrs.fr. Archiviert vom Original am 14. Oktober 2012; abgerufen am 10. Oktober 2012.
- Veröffentlichung von Seralini et al. zu einer Fütterungsstudie an Ratten mit gentechnischverändertem Mais NK603 sowie einer glyphosathaltigen Formulierung. Stellungnahme Nr. 037/2012 des BfR vom 28. September 2012. (bfr.bund.de)
- Studie der Universität Caen ist kein Anlass für eine Neubewertung von Glyphosat und gentechnisch verändertem Mais NK 603 – BfR. In: bund.de. Abgerufen am 15. Januar 2020.
- (Seite nicht mehr abrufbar, Suche in Webarchiven: NVWA – Bijlage: Beoordeling inzake artikel Séralini)
- foodstandards.gov.au (Memento vom 20. Oktober 2012 im Internet Archive)
- Review of the Séralini (2012) publication on a 2-year rodent feeding study with glyphosate formulations and GM maize NK603 as published online on 19 September 2012 in Food and Chemical Toxicology. In: EFSA Journal. 10, 2012, S. 2910, doi:10.2903/j.efsa.2012.2910.
- efsa.europa.eu
- BVL – Fachmeldungen – BVL prüft Rattenfütterungsstudie mit gentechnisch verändertem Mais und glyphosathaltigen Pflanzenschutzmitteln (Seralini et al. 2012). (Memento vom 10. September 2017 im Internet Archive)
- anses.fr (Memento vom 15. Oktober 2013 im Internet Archive)
- efsa.europa.eu
- Fachzeitschrift zieht Genmaisstudie zurück. In: Spiegel online. 28. November 2013.
- Elsevier Announces Article Retraction from Journal Food and Chemical Toxicology. In: elsevier.com. Abgerufen am 15. Januar 2020.
- Nathan Gray: Monsanto GM study fallout: Seralini stands firm over retraction. 29. November 2013. (foodnavigator.com (Memento vom 1. Dezember 2013 im Webarchiv archive.today))
- Republished study: long-term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize. In: Environmental Sciences Europe. Band 26, 2014, S. 14, doi:10.1186/s12302-014-0014-5
- O. Sanvido, J. Romeis, F. Bigler: Ecological impacts of genetically modified crops: ten years of field research and commercial cultivation. In: Advances in Biochemical Engineering/Biotechnology. Vol 107, 2007, S. 235–278. PMID 17522828.
- (Seite nicht mehr abrufbar, Suche in Webarchiven)
- Gen-Mais als Risiko für die Natur – Angst vor dem Giftmais Deutschlands Naturschutzbehörde hält den Gen-Mais 1507 für ein Risiko. Er könnte neben Schädlingen auch andere Tiere töten. In: taz.de, 19. Februar 2014.
- BMBF: 25 Jahre BMBF-Forschungsprogramme zur biologischen Sicherheitsforschung. Bonn 2014.
- J. Losey, L. Rayor, M. Carter: Transgenic pollen harms monarch larvae. (Memento vom 28. Januar 2012 im Internet Archive) (PDF; 158 kB). In: Nature. Vol. 399, 1999, S. 214.
- Laura C. Hansen Jesse, John J. Obrycki: Field deposition of Bt transgenic corn pollen: lethal effects on the monarch butterfly. In: Oecologia. Band 125, Nr. 2, 2000, S. 241–248, doi:10.1007/s004420000502.
- Werner Mueller: Handbuch zu Monitoring und Resistenzmanagement für BT-Mais, Österreichisches Umweltamt, Monographien M-144 Wien, 2001
- Selbst bei flächendeckendem Anbau von Bt-Mais kaum Gefährdung für Schmetterlinge. Biosicherheit.de, 7. Januar 2010, abgerufen am 30. Juli 2012.
- Agnès Ricroch, Jean Baptiste Bergé, Marcel Kuntz (2009): Is the German suspension of MON810 maize cultivation scientifically justified? Transgenic Research, Vol. 19, Nr. 1, S. 1.12. doi:10.1007/s11248-009-9297-5
- Langzeit-Studie: Anbau von Bt-Mais ohne Einfluss auf Regenwürmer. Biosicherheit.de, 18. Mai 2010, abgerufen am 30. Juli 2012.
- Margit Fink: FAL-Daten zeigen keine Gefahr von Gen-Mais für Bodenmikroorganismen. Informationsdienst Wissenschaft, 25. Juli 2006, abgerufen am 30. Juli 2012.
- Michelle Marvier, Chanel McCreedy, James Regetz, Peter Kareiva: A Meta-Analysis of Effects of Bt Cotton and Maize on Nontarget Invertebrates. In: Science. Band 316, Nr. 5830, 2007, S. 1475–1477, doi:10.1126/science.1139208.
- Isik Icoz, Guenther Stotzky: Fate and effects of insect-resistant Bt crops in soil ecosystems. In: Soil Biology and Biochemistry. Band 40, Nr. 3, 2008, S. 559–586, doi:10.1016/j.soilbio.2007.11.002.
- C. Comas, B. Lumbierres, X. Pons, R. Albajes: No effects of Bacillus thuringiensis maize on nontarget organisms in the field in southern Europe: a meta-analysis of 26 arthropod taxa. In: Transgenic Research. Band 23, 2013, S. 135–143, doi:10.1007/s11248-013-9737-0.
- Thomas Bøhn, Raul Primicerio, Dag O. Hessen, Terje Traavik: Reduced Fitness of Daphnia magna Fed a Bt-Transgenic Maize Variety. In: Archives of Environmental Contamination and Toxicology. Band 55, Nr. 4, 2008, S. 584–592, doi:10.1007/s00244-008-9150-5.
- Jörg E. U. Schmidt, Cora U. Braun, Lisa P. Whitehouse, Angelika Hilbeck: Effects of activated Bt transgene products (Cry1Ab, Cry3Bb) on immature stages of the ladybird Adalia bipunctata in laboratory ecotoxicity testing. In: Archives of Environmental Contamination and Toxicology. Band 56, Nr. 2, 2009, S. 221–228, doi:10.1007/s00244-008-9191-9.
- BVL (2009): Stellungnahme der ZKBS zur Risikobewertung von MON810 – Neue Studien zur Umweltwirkung von MON810.
- Agnes Ricroch, Jean Baptiste Berge, Marcel Kuntz: Is the German suspension of MON810 maize cultivation scientifically justified? In: Transgenic Research. Band 19, 2010, S. 1–12, doi:10.1007/s11248-009-9297-5.
- Stefan Rauschen: A case of “pseudo science”? A study claiming effects of the Cry1Ab protein on larvae of the two-spotted ladybird is reminiscent of the case of the green lacewing. In: Transgenic Research. Band 19, Nr. 1, 2010, S. 13–16, doi:10.1007/s11248-009-9301-0.
- Fernando Álvarez-Alfageme, Franz Bigler, Jörg Romeis: Laboratory toxicity studies demonstrate no adverse effects of Cry1Ab and Cry3Bb1 to larvae of Adalia bipunctata (Coleoptera: Coccinellidae): the importance of study design. In: Transgenic Research. Band 20, Nr. 3, 2011, S. 467–479, doi:10.1007/s11248-010-9430-5.
- M. Porcar, I. García-Robles, L. Domínguez-Escribà, A. Latorre: Effects of Bacillus thuringiensis Cry1Ab and Cry3Aa endotoxins on predatory Coleoptera tested through artificial diet-incorporation bioassays. In: Bulletin of Entomological Research. Band 100, Nr. 3, 2010, S. 297–302, doi:10.1017/S0007485309990290.
- Stellungnahme der ZKBS zu neueren wissenschaftlichen Veröffentlichungen zur Risikoabschätzung der Maislinie MON810. BVL, 2011.
- Angelika Hilbeck, Joanna M McMillan, Matthias Meier, Anna Humbel, Juanita Schläpfer-Miller, Miluse Trtikova: A controversy re-visited: Is the coccinellid Adalia bipunctata adversely affected by Bt toxins? In: Environmental Sciences Europe. Band 24:10, 2012, S. 3–12, doi:10.1186/2190-4715-24-10.
- Gentechnik-Mais und Zweipunkt-Marienkäfer: Die wissenschaftliche Kontroverse geht weiter. In: bioSicherheit.de. Abgerufen am 15. Januar 2020.
- Jörg Romeis, Fernando Álvarez-Alfageme, Franz Bigler: Putative effects of Cry1Ab to larvae of Adalia bipunctata – reply to Hilbeck u. a. (2012). In: Environmental Sciences Europe. Band 24, Artikel 18, 2012, S. 1–5, doi:10.1186/2190-4715-24-18.
- Thomas Bøhn, Raul Primicerio, Terje Traavik: The German ban on GM maize MON810: scientifically justified or unjustified? In: Environmental Sciences Europe. Band 24, Artikel 22, 2012, S. 1–7, doi:10.1186/2190-4715-24-22.
- Peggy G. Lemaux: Genetically Engineered Plants and Foods: A Scientist’s Analysis of the Issues (Part II). In: Annual Review of Plant Biology. Band 60, 2009, S. 511–559. doi:10.1146/annurev.arplant.043008.092013.
- Projektleiter: Prof. Dr. Hans-Hinrich Kaatz Teilprojekt: Auswirkungen von Bt-Maispollen auf die Honigbiene – Methodenentwicklung zu Wirkungsprüfung und Monitoring. Förderkennzeichen: 031631J Schlußbericht 2004
- Auswirkungen von Bt-Maispollen auf die Honigbiene. (2001–2004) Universität Jena, Institut für Ernährung und Umwelt. (Memento vom 22. Dezember 2015 im Internet Archive) in Biosicherheit
- Auswirkungen von Bt-Maispollen auf die Honigbiene. (Memento vom 22. Dezember 2015 im Internet Archive) Biosicherheit.de, 12. Oktober 2005, abgerufen am 30. Juli 2012.
- Janisse Bailey, Cynthia Scott-Dupree, Ron Harris, Jeff Tolman, Brenda Harris: Contact and oral toxicity to honey bees (Apis mellifera) of agents registered for use for sweet corn insect control in Ontario, Canada. In: Apidologie. Band 36, 2005, S. 623–633, doi:10.1051/apido:2005048.
- Ricardo Ramirez-Romero, Josette Chaufaux, Minh-Hà Pham-Delègue: Effects of Cry1Ab protoxin, deltamethrin and imidacloprid on the foraging activity and the learning performances of the honeybee Apis mellifera, a comparative approach. In: Apidologie. Band 36, 2005, S. 601–611, doi:10.1051/apido:2005039.
- S. Arpaia: Ecological impact of Bt-transgenic plants: 1. Assessing possible effects of CryIIIB toxin on honey bee (Apis mellifera L.) colonies. In: Journal of Genetics and Breeding. Band 50, 1996, S. 315–319.
- D. Babendreier, D. Joller, J. Romeis, F. Bigler, F. Widmer: Bacterial community structures in honeybee intestines and their response to two insecticidal proteins. In: FEMS Microbiology Ecology. Band 59, Nr. 3, 2007, S. 600–610, doi:10.1111/j.1574-6941.2006.00249.x.
- D. Babendreier, N. M. Kalberer, J. Romeis, P. Fluri, E. Mulligan, F. Bigler: Influence of Bt-transgenic pollen, Bt-toxin and protease inhibitor (SBTI) ingestion on development of the hypopharyngeal glands in honeybees. In: Apidologie. Band 36, 2005, S. 585–594, doi:10.1051/apido:2005049.
- D. Babendreier, J. Romeis, F. Bigler, P. Fluri: Neue Erkenntnisse zu möglichen Auswirkungen von transgenem Bt-Mais auf Bienen. Forsch. Agroscope Liebefeld-Posieux ALP, Schweiz 2006.
- Jian J. Duan, Michelle Marvier, Joseph Huesing, Galen Dively, Zachary Y. Huang: A Meta-Analysis of Effects of Bt Crops on Honey Bees (Hymenoptera: Apidae). In: PLOS ONE. Nr. 1, 2008, S. e1415, doi:10.1371/journal.pone.0001415.
- Transgenic DNA discovered in native Mexican corn, according to a new study by UC Berkeley researchers. Pressemitteilung der UC Berkeley vom 29. November 2001, Update am 4. April 2002, abgerufen am 30. Juli 2012.
- Rex Dalton: Modified genes spread to local maize. In: Nature. Vol. 456, Nr. 149, 12. November 2008.
- Mexiko: Spuren von gentechnisch verändertem Mais bestätigt. Biosicherheit.de, 11. März 2009, abgerufen am 30. Juli 2012.
- Mexico issues first permits to grow GM corn. (englisch). Reuters, 15. Oktober 2009, abgerufen am 30. Juli 2012.
- Rex Dalton: Mexico’s transgenic maize under fire. In: Nature. Vol. 462, Nr. 404, 25. November 2009.
- Fremdgene in Landsorten: Gefahr für die biologische Vielfalt? Biosicherheit.de, 10. Februar 2003, abgerufen am 30. Juli 2012.