Pyrrolizidinalkaloide
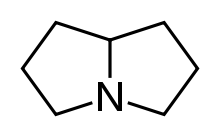
Pyrrolizidinalkaloide (abgekürzt PA) ist eine Sammelbezeichnung für Alkaloide, deren Grundstruktur das Ringsystem Pyrrolizidin enthält, ein bicyclisches tertiäres Amin.
In der Natur kommen Pyrrolizidinalkaloide als sekundäre Pflanzenstoffe weltweit in über 6000 verschiedenen Arten von Blütenpflanzen vor, die hauptsächlich den Familien der Korbblütler, Raublattgewächse, Hülsenfrüchtler (Crotalaria) und Orchideen zugehören. Den Pflanzen dienen diese Stoffe vornehmlich zur Abwehr von Verbiss. Bisher wurden mehr als 660 unterschiedliche PA und PA-Aminoxide identifiziert. Etwa die Hälfte dieser Verbindungen kann im tierischen Stoffwechsel zu reaktiven Metaboliten umgewandelt werden, die lebertoxisch (hepatotoxisch) wirken, beispielsweise da sie den Glutathion-Metabolismus stören.[1] Daher können pyrrolizidinalkaloidhaltige Pflanzen für Vieh, Wildtiere und Menschen ein Gefährdungspotential darstellen.[2]
Daneben nehmen verschiedene Insektenarten wie Heuschrecken oder Schmetterlinge Pyrrolizidinalkaloide auf (Pharmakophagie), sequestrieren diese und nutzen sie als Pheromone oder als Schutz vor Fressfeinden.[3][4]
Gliederung nach Strukturtypen
Man kann die Pyrrolizidinalkaloide in übergeordnete Gruppen einteilen, in jene des Necin-Typs und jene des Nicht-Necin-Typs. Der Begriff Necin leitet sich von der Pflanzengattung Senecio (Greis- bzw. Kreuzkräuter) ab, da es in ihr ein besonders reichhaltiges Vorkommen an Alkaloiden dieses Chemotyps gibt. Vertreter der Necingruppe werden deshalb auch als Senezioalkaloide bezeichnet.
Zu den Nicht-Necinen gehören beispielsweise Loline, Pyrrolame (die Zurechnung derartiger Amide zu den Alkaloiden ist definitionsabhängig), Australine, Hyazynthazine, Bohemamine, Bistellettazine, Epohelmine, Jenamidine, Casuarine, Janfestin, Salinosporamid C, Heronamid A, Pochonizin, 1-epi-Alexin[5] und Retronecanol.
Verwandte Alkaloidgruppen basieren auf Indolizidin- und Chinolizidin-Basen, bei denen entweder nur ein Ring oder beide Ringe um je eine Methylengruppe größer als das Pyrrolizidin sind.
Biosynthese
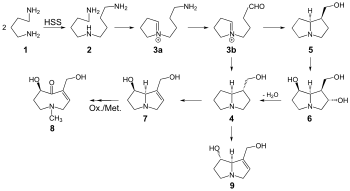
Die Biosynthese des Retronecins erfolgt aus Putrescin (1) mit Hilfe des Schlüsselenzyms Homospermidin-Synthetase (HSS) über die Stufen des Homospermidin (2), das Iminiumion (3a, 3b), Trachelanthamidin (4) und schließlich zum Retronecin (7).[6]
Toxikologie

Es ist möglich, dass Pyrrolizidinalkaloide über pflanzliche Nahrungskomponenten in den menschlichen Nahrungskreislauf eingetragen werden.[7]
Laut Bundesinstitut für Risikobewertung (BfR) sind Verunreinigungen in Tees und Honig die Hauptaufnahmequellen für Pyrrolizidinalkaloide.[8] Ebenso können tiefgefrorene und getrocknete Gewürzkräuter mit 1,2-ungesättigten Pyrrolizidinalkaloiden belastet sein.[9] Das BfR rät aufgrund der Giftigkeit der Pyrrolizidinalkaloide davon ab, derartig belastete Lebensmittel regelmäßig oder in größeren Mengen zu verzehren, fordert Nulltoleranz aber nur für den Zusatz von giftigen Pflanzenstoffen in isolierter Form.[10]
Der Übergang von Pyrrolizidinalkaloiden in den Nektar und mit diesem in Honig wurde nachgewiesen.[11] Untersuchungen ergaben eine geringere Belastung bei deutschen Honigen. In 50 % der untersuchten Fälle lag die Belastung jedoch bei 250 µg/kg Honig. Noch kritischer ist dies bei Honigen aus Übersee.[12]
Auch wurde über Kontaminationen von Rucola und Salatmischungen mit Greiskrautblättern und Pyrrolizidinalkaloide in Kräutertees[13] berichtet. Bis heute gibt es bei Lebensmitteln weder Regelungen bezüglich Höchstmengen noch Kontrollen.[14] Jedoch wurde für phytopharmazeutische Produkte vom Bundesgesundheitsamt die Einnahme auf 1 µg/Tag bei Anwendung von bis zu sechs Wochen beziehungsweise 0,1 µg/Tag bei Anwendung über sechs Wochen begrenzt.[15]
Weitaus stärker ist die Gefährdung in Ländern des Nahen und Mittleren Ostens sowie Ostafrikas. So gab es in den 1970er Jahren drei epidemieartig verlaufende Wellen von Lebererkrankungen in Usbekistan, Pakistan und Indien mit insgesamt etwa 6000 betroffenen Personen und mehreren Todesfällen.[16] Die Erkrankungen wurden durch den Genuss von mit Sonnenwenden- und Crotalariaarten verunreinigtem Mehl, das einen hohen Gehalt an Pyrrolizidinalkaloiden aufwies, verursacht.[17] Auch in Äthiopien und Afghanistan gab es Berichte von Todesfällen bei Kindern durch kontaminiertes Getreide.[18]
Toxisch wirken dabei nicht die Pyrrolizidinalkaloide selbst, sondern die Abbauprodukte der vor allem in der Leber abgebauten Verbindungen, die hepatotoxisch sind und in hoher Dosierung zu tödlichen Leberfunktionsstörungen führen, unter anderem Lebervenenverschluss. Das Krankheitsbild der PA-Vergiftung ist in der Veterinärmedizin als Seneziose oder „Schweinsberger Krankheit“ bekannt und wird meist durch Greiskrautbestand auf Weiden verursacht.
Von den Haustieren sind Pferde besonders empfindlich. Hier entwickelt sich nach der Aufnahme verschiedener Crotalaria-Arten die meist tödlich verlaufende Crotalariosis equorum.[19]
Toxikodynamik
Auf dem Giftungsweg werden die Alkaloide enzymatisch zu Halbaminalen oxidiert, welche sich dann durch spontane Dehydratisierung in Dehydropyrrolizidine umwandeln. Diese Verbindungen sind instabil und reagieren, indem ihre jeweiligen Carbonsäureesterfunktionen als Nukleofug abgespalten werden, leicht mit Nukleophilen. Auf diese Weise bilden Dehydropyrrolizidine im Organismus schädliche Addukte mit Zellproteinen und mit der DNS. In wässrigem Medium haben die Dehydropyrrolizidine eine Halbwertszeit von 0,3 bis 5 Sekunden.[20]
Ökologie
Die Raupen des Jakobskrautbärs (Tyria jacobaeae) ernähren sich von Greiskräutern (Senecio spec.), hauptsächlich vom Jakobs-Greiskraut (Senecio jacobaea), dem sie auch ihren Namen verdanken und auf dem sie durch ihre Färbung nicht leicht zu entdecken sind. Bei dem Gift handelt es sich hauptsächlich um bitter schmeckende Pyrrolizidinalkaloide, die bei Verletzungen von Nachbarpflanzen (Beweidung) intensiver produziert werden.[21] Diese Alkaloide sind für Wirbeltiere lebertoxisch und dienen der Abwehr von Herbivoren. Allerdings können die Pyrrolizidinalkaloide auch zur Ortung der Wirtspflanze beitragen: Sie werden vom spezialisierten Fressfeind, dem Jakobskrautbär, wahrgenommen, der das Kraut dann für die Eiablage aufsucht.[22] Auf den Jakobskrautbär haben die meisten Pyrrolizidinalkaloide keine giftige Wirkung.[23] Die Raupen nehmen es während des Fressens auf und lagern es ein (Sequestrierung), wobei sie selbst für andere Tiere giftig werden, ohne selbst Schaden zu nehmen.[24] Teilweise fressen sie auch Huflattich (Tussilago farfara) und Pestwurzen (Petasites spec.).
Nachweis
Zum Nachweis der Pyrrolizidinalkaloide eignen sich chromatographische Methoden wie die Dünnschichtchromatographie, die Hochleistungsflüssigkeitschromatographie oder die Gaschromatographie. Für den dünnschichtchromatographischen Nachweis ist teilweise eine Überführung in das N-Oxid und weitere Derivatisierung notwendig.[25] Die gaschromatographische Bestimmung erfordert aufgrund der Zersetzung der Pyrrolizidinalkaloide eine möglichst moderate Säulentemperatur beziehungsweise eine schonende Aufheizung.[26] Eine zuverlässige Identifizierung und Trennung einzelner Pyrrolizidinalkaloide wird durch die Kopplung der HPLC mit der Massenspektrometrie erreicht.[27]
Literatur
- H. Habs, M. Habs, H. Marquardt, E. Röder, D. Schmähl, H. Wiedenfeld: Carcinogenic and Mutagenic Activity of an Alkaloidal Extract of Senecio nemorensis ssp. fuchsii (Karzinogene und mutagene Wirkung eines Alkaloid-Extraktes aus Senecio nemorensis ssp. fuchsii). In: Arzneimittel-Forschung / Drug Research. 32, 1982, S. 144–148. PMID 7199918.
- Peter Stengl, Helmut Wiedenfeld, Erhard Röder: Lebertoxische Pyrrolizidinalkaloide in Symphytum-Präparaten. In: Deutsche Apotheker-Zeitung. 122, 1982, S. 851–855.
- Helmut Wiedenfeld, Erhard Roeder, Thomas Bourauel, John Edgar: Pyrrolizidine Alkaloids. 2008, ISBN 978-3-89971-426-5.
- Erhard Röder: Wie verbreitet und wie gefährlich sind Pyrrolizidinalkaloide? (PDF-Datei, 20,3 MB). In: Pharmazie in unserer Zeit. 13, 1984, S. 33–38. doi:10.1002/pauz.19840130201
- R. Rasenack, C. Müller, M. Kleinschmidt, J. Rasenack, H. Wiedenfeld: Veno-Occlusive Disease in a Fetus Caused by Pyrrolizidine Alkaloids of Food Origin (Venenverschlusskrankheit in einem Fetus verursacht durch Pyrrolizidinalkaloide aus Nahrungsmitteln). In: Fetal Diagnosis and Therapy. 18, 2003, S. 223–225. doi:10.1159/000070799. PMID 12835579.
- Alfonso Lampen: Pyrrolizidinalkaloide (PA): Toxikologie und Risikobewertung. Bundesinstitut für Risikobewertung, 2015.
Weblinks
- Enzootische Leberdystrophie und hepatoenzephales Syndrom bei Pferden nach Vergiftung mit Senecio alpinus (leicht gekürzte Fassung aus: Pferdeheilkunde, 1990, 6, S. 119–124)
- Senecio jacobaea – Veterinärtoxikologie – Fütterungsversuche mit Jakobskreuzkraut bei Pferd, Rind und anderen Säugetieren, Institut für Veterinärpharmakologie und -toxikologie, Universität Zürich.
Einzelnachweise
- Yan Xinmiao, Kang Hong, Feng Jun, Yang Yiyan, Tang Kailin, Zhu Ruixin, Yang Li, Wang Zhengtao, Cao Zhiwei: Identification of Toxic Pyrrolizidine Alkaloids and Their Common Hepatotoxicity Mechanism. In: International Journal of Molecular Science. Band 17, Nr. 3, März 2016, S. 318, doi:10.3390/ijms17030318, PMC 4813181 (freier Volltext)
- P. P. Fu, Q. Xia, G. Lin, M. W. Chou: Pyrrolizidine alkaloids-genotoxicity, metabolism enzymes, metabolic activation, and mechanisms. In: Drug Metab Rev. Band 36, Nr. 1, 2004, S. 1–55, doi:10.1081/DMR-120028426, PMID 15072438 (englisch).
- M. Boppré, O. W. Fischer: Harlekinschrecken (Orthoptera: Zonocerus) – Schadinsekten der besonderen Art. In: Gesunde Pflanzen. 51, 1999, S. 141–149.
- Gadi V. P. Reddy, Angel Guerrero: Interactions of insect pheromones and plant semiochemicals. In: Trends in Plant Science. 9, 2004, S. 253–261, doi:10.1016/j.tplants.2004.03.009.
- J. Robertson, K. Stevens: Pyrrolizidine alkaloids. In: Nat Prod Rep. Band 31, Nr. 12, 2014, S. 1721–1788, doi:10.1039/c4np00055b, PMID 25158215.
- E. Roeder: Medicinal plants in Europe containing pyrrolizidine alkaloids. In: Pharmazie. 50(2), Feb 1995, S. 83–98. PMID 7700976
- Monika Lahrssen-Wiederholt: Pyrrolizidinalkaloide als unerwünschte Stoffe in der Nahrungskette – Beispiel Jakobskreuzkraut. (Memento vom 21. Juli 2007 im Internet Archive) (PDF; 735 kB). Bundesinstitut für Risikobewertung, Forum Verbraucherschutz, Juli 2007.
- Suzan Fiack: Verunreinigungen in Tees und Honig sind die Hauptaufnahmequellen für Pyrrolizidinalkaloide. IDW, Pressemitteilung vom 29. September 2016 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 30. September 2016.
- Bundesinstitut für Risikobewertung: Pyrrolizidinalkaloidgehalt in getrockneten und tiefgefrorenen Gewürzen und Kräutern zu hoch. 13. Mai 2019, abgerufen am 10. Juli 2019.
- Nulltoleranzen in Lebens- und Futtermitteln. (PDF; 200 kB). Positionspapier des BfR vom 12. März 2007, S. 3.
- Robert Hegnauer: Chemotaxonomie der Pflanzen. Birkhäuser, Basel 1989, S. 281.
- A. Dübecke, G. Beckh, C. Lüllmann: Pyrrolizidine alkaloids in honey and bee pollen. In: Food additives & contaminants. Part A, Chemistry, analysis, control, exposure & risk assessment. Band 28, Nummer 3, März 2011, S. 348–358, doi:10.1080/19440049.2010.541594. PMID 21360377.
- Gehalte an Pyrrolizidinalkaloiden in Kräutertees und Tees sind zu hoch. Bundesinstitut für Risikobewertung, 15. Juli 2013, abgerufen am 20. Juli 2013.
- Udo Pollmer: Schön, aber giftig. Radiofeuilleton „Mahlzeit“, Deutschlandradio Kultur.
- Bundesgesundheitsamt (1992) Bundesanzeiger, 4805; Deutsche Apothekerzeitung. 132, S. 1406–1408.
- E. Roeder: Medicinal plants in Europe containing pyrrolizidine alkaloids. In: Pharmazie. 50.2, 1995, S. 83–98.
- Erhard Röder: Wie verbreitet und wie gefährlich sind Pyrrolizidinalkaloide? In: Pharmazie in Unserer Zeit. 13, 1984, S. 33–38, doi:10.1002/pauz.19840130201.
- Helmut Wiedenfelder: Gefährliche Giftpflanze auf dem Vormarsch. Pressemitteilung der Universität Bonn, 2009.
- C. J. Botha, A. Lewis, E. C. du Plessis, S. J. Clift, M. C. Williams: Crotalariosis equorum ("jaagsiekte") in horses in southern Mozambique, a rare form of pyrrolizidine alkaloid poisoning. In: Journal of veterinary diagnostic investigation : official publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. Band 24, Nummer 6, November 2012, S. 1099–1104, doi:10.1177/1040638712460673, PMID 22991388.
- Q. Xia, L. Ma, X. He, L. Cai, P. P. Fu: 7-Glutathione pyrrole adduct: a potential DNA reactive metabolite of pyrrolizidine alkaloids. In: Chem. Res. Toxicol. Band 28, Nr. 4, 2015, S. 615–620, doi:10.1021/tx500417q, PMID 25768656.
- W. H. Gera Hol, Mirka Marcel, Johannes Avan Veen, Ed van der Meijden: Root damage and aboveground herbivory change concentration and composition of pyrrolizidine alkaloids of Senecio jacobaea. In: Basic and Applied Ecology. 5, Nr. 3, 2004, S. 253–260, doi:10.1016/j.baae.2003.12.002.
- Mirka Macel, Klaas Vrieling: Pyrrolizidine alkaloids as oviposition stimulants for the cinnabar moth, Tyria jacobaeae. In: Journal of Chemical Ecology. 29, Nr. 6, 2003, S. 1435–1446 researchgate.net (PDF).
- Mirka Macel, Peter G. Klinkhamer, Klaas Vrieling, Ed van der Meijden: Diversity of pyrrolizidine alkaloids in Senecio species does not affect the specialist herbivore Tyria jacobaeae. In: Oecologia. 133, Nr. 4, 2002, S. 541–550 miekevd.home.xs4all.nl (PDF; 300 kB).
- Dellbrücker Heide Abgerufen am 11. Juni 2012.
- A. R. Mattocks: Detection of pyrrolizidine alkaloids on thin-layer chromatograms. In: Journal of Chromatography A. 27, 1967, S. 505–508, doi:10.1016/S0021-9673(01)85914-8.
- H. Wiedenfeld u. a.: Zur gaschromatographischen Bestimmung der Pyrrolizidinalkaloide aus einigen Senecioarten. In: Planta Medica. 41.02, 1981, S. 124–128.
- L. Fang, A. Xiong, X. Yang, W. Cheng, L. Yang, Z. Wang: Mass-spectrometry-directed analysis and purification of pyrrolizidine alkaloid cis/trans isomers in Gynura japonica. In: J Sep Sci. 37(15), Aug 2014, S. 2032–2038. PMID 24840731