Schuppe (Schmetterling)
Die Schuppen der Schmetterlinge finden sich auf ihren Flügeloberseiten und werden auch „Schmetterlingsstaub“ genannt.[1] Sie sind charakteristisch für die Ordnung der Schmetterlinge[2] und waren auch namensgebend für ihre wissenschaftliche Bezeichnung als „Lepidoptera“ (aus altgriechisch λεπίδος lepidos, deutsch ‚Schuppe‘ und πτερόν pteros, deutsch ‚Flügel‘).[3] Schuppen können auch auf Kopf- (Caput), Brust- (Thorax) und Hinterleibabschnitt (Abdomen) sowie Genitalien ausgebildet sein. Die Schuppe ist der kleinste mosaikförmige Teil der Farbgebung des Schmetterlingsflügels.[2] Beschuppung der Schmetterlinge bezieht sich immer nur auf deren Adultformen, die fertig ausgebildeten Imagines.

Ausschnitt ca. 600 µm × 600 µm in ca. 200-facher Vergrößerung unter Polarisationsfilter
Außer Schmetterlingen tragen nur einige Köcherfliegen ähnliche Schuppen auf ihren Flügeln, z. B. die afrikanische Art Pseudoleptocerus chirindensis.[4]
Form
Die Schuppen sind meist Hohlstrukturen, nur einige primitive Motten (Urmotten, Micropterigidae) bilden kompakte Schuppen. Sie können aufgrund ihrer äußeren Form in drei Klassen eingeteilt werden:[3]
- Dachpfannenförmige oder lamelläre Schuppen, typischerweise von etwa 0,1 Millimeter Länge und 0,05 Millimeter Breite[1]
- Haarförmige oder piliforme Schuppen (z. B. bei Zwergwickler, Nepticuloidea, Roter Apollo, Hemaris, Micropterix aruncella)
- Andere Formen (z. B. besitzt Agdistis keilförmige, Smerinthus stachelförmige Schuppen)
Aufbau
Unterhalb der Oberkante ihrer Unterseite besitzen die Schuppen, ähnlich wie Dachpfannen, eine stiftförmige Ausbildung.[1] Diese ist in einer zylindrischen Ausformung der Flügeloberseite des Schmetterlings verhakt.[3] Die Verhakung kann mechanisch gelöst werden, womit sich die Schuppe irreversibel vom Flügel löst,[5] ohne weitere Verletzungen auszulösen.
Die äußere Oberfläche der Schuppen ist fein strukturiert (oft parallel rillenförmig), während die aufliegende Seite glatt ist.[3]
Das Hauptmaterial der Schuppen besteht wie das der Cuticula aus Chitin. Es besitzt gegen Luft einen Brechungsindex von 1,58.[6]

 REM Aufnahme eines lamellär beschuppten Flügels (× 200)
REM Aufnahme eines lamellär beschuppten Flügels (× 200) REM Aufnahme von lamellären Flügelschuppen (× 1000)
REM Aufnahme von lamellären Flügelschuppen (× 1000) REM Aufnahme der Feinstruktur einer Schuppe (× 5000)
REM Aufnahme der Feinstruktur einer Schuppe (× 5000)
Färbung und Reflexion
Das Farb- und Reflexionsmuster des Schmetterlingsflügels ergibt sich aus dem mosaikförmigen Zusammenwirken vieler tausender Einzelschuppen sowie dem physikalischen Zusammenwirken von Absorption und Reflexion des einfallenden Lichtes auf den Flügel.[7]
Farbstoffe
Die dunkle Färbung der Flügel wird überwiegend durch Pigmentierung der Schuppen mittels Melanin erreicht, welche Licht absorbieren.[8] Jede Schuppe ist im Wesentlichen einfarbig,[1] Farbverläufe kommen vor.
UV-Muster
Manche Ritterfalter produzieren UV-Flügelmuster entweder durch UV-Absorption oder UV-Reflexion, um artspezifische Signale austauschen zu können (etwa zur Revierabgrenzung oder Partnersuche), die von ihren Prädatoren kaum erkannt werden.[9][10]
Polarisationsmuster
Manche auffallend bunte Schmetterlingsflügel produzieren Polarisationsmuster, welche allerdings meist nicht durch die Schuppen erzeugt werden, sondern vielmehr durch Mikrostrukturen der darunterliegenden Cuticula.[11] Die transparenten Schuppen (Glasschuppen) der Ritterfalter (wie Graphium sarpedon) können Polarisationsmuster erzeugen.[12][13]
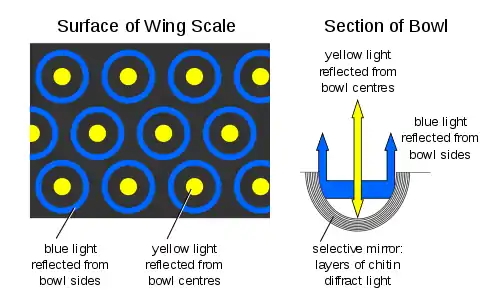

Reflexionseffekte
Auffällige Reflexionsmuster (Metallglanz, Irisieren, Schimmern, Schillern) produziert häufig nur eines der Geschlechter. Starke Lichtreflexionen ermöglichen innerartliche Signale über größere Sichtentfernungen.[14]
Spezielle Reflexionseigenschaften entstehen durch Interferenz des Lichts an feinen Oberflächenstrukturierungen (Strukturfarbe genannt).[6][8][14][15][16] Die Mikrostrukturen sind vor allem aus Chitin aufgebaut.[6] Reflexionsmuster können für den Menschen sichtbares Licht wie UV-Licht als Einstrahlquelle reflektieren und sichtbares Licht oder UV-Licht abgeben, manchmal auch als Polarisationsmuster. Dabei können die Reflexionsmuster von einer Vielzahl Eigenschaften der Lichtquelle wie der Oberflächenstrukturen abhängen. Es gilt, dass die der Reflexion zugrunde liegenden Mikrostrukturen die Größenordnung der Wellenlänge des Lichtes einnehmen müssen. Das Grundelement wird als Photonischer Kristall bezeichnet.[6] Diese Strukturen müssen sich periodisch öfters wiederholen, um z. B. Bragg-Reflexionen zu erzeugen, wie z. B. in der häufig vorkommenden feinen Riffelung (die in den REM-Bildern oben gut zu sehen ist).
Beispiele
- Viele Bläulinge erzeugen einen Farbschimmer zu einer andersfarbigen Grundfarbe. Um die zugrunde liegenden Mikrostrukturen zu analysieren, wurden die vorkommenden Strukturraster untersucht.[17] Albulina metallica erzeugt stark gelbgrüne Reflexionsmuster durch relativ gleichmäßig angeordnete geschichtete Mikrostrukturen.[6] Cyanophrys remus erzeugt Reflexionsmuster durch dorsal angeordnete lange und ventral kurze Mikrostrukturen.[6]

- Das typische Schillern der Schillerfalter (sowohl für Apatura ilia wie Apatura iris) hat seine Ursache in besonderen Hohlräumen in den Schuppen der männlichen Tiere, während die Schuppen bei beiden Geschlechtern braun pigmentiert sind.[19] Die Reflexion im Lilabereich liegt bei einer Wellenlänge von bei 380 nm ± 50 nm und tritt nur in einem Winkel von 18° aus.[18] Die Reflexionen werden durch das Zusammenspiel zweier Typen von Schuppen erzeugt. Typ I liegt zuoberst, Typ II darunter. Typ I erzeugt die schimmernde Reflexionswirkung aufgrund seiner Nanostrukturen, ähnlich wie bei Morphofaltern.[20]
- Leuchtend schimmernde Reflexionserscheinungen erzeugen manche Morpho-Arten durch Mikrostrukturen ihrer Schuppen. Im blauen Laser konnte an zwei Arten experimentell ermittelt werden, dass bis zu 75 % des blauen Lichtes reflektiert werden unter verschiedenen Einstrahlwinkeln. Dabei spielen Interferenzen zwischen zwei Lagen von Schuppen eine Rolle, wobei die obere Lage weitgehend transparent (ohne Pigmentierung) ist, während die untere komplexere Feinstrukturen auf ihrer Oberfläche trägt.[14]
 Blauer Morphofalter: strahlendes Blau durch Doppelreflexion an transparenten und pigmentierten Schuppen
Blauer Morphofalter: strahlendes Blau durch Doppelreflexion an transparenten und pigmentierten Schuppen Morpho cypris: strahlendes Blau durch Reflexion
Morpho cypris: strahlendes Blau durch Reflexion Morpho cypris: weitgehend braune Pigmentierung bei flacher Beleuchtung
Morpho cypris: weitgehend braune Pigmentierung bei flacher Beleuchtung

- Einige männliche Papilio-Arten zeigen ein sehr effektvolles Reflexionsverhalten, beispielsweise Papilio ulysses und Papilio blumei. Sie sind im sichtbaren Licht gut unterscheidbar. Unter UV-Licht zeigt P. ulysses zwei Reflexionsmaxima. Das eine stammt von einer Mikro-Vertiefung, das andere von einer Mikro-Erhöhung auf seinen Schuppen. Unter verschiedenen UV-Einstrahlwinkeln ändern sich die Reflexionsmaxima. Die leuchtend hellblaue Farbe des P. ulysses setzt sich aus zwei unterschiedlichen Spektralfarben zusammen, welche je nach UV-Lichtwinkeleinfall alternieren. P. blumei weist gleichartige Feinstrukturen auf, aber Änderungen des Einstrahlwinkels haben keinen Effekt; er weist nur ein Reflexionsmaximum im Grünbereich auf, welches aber deutlich ausgeprägt ist. Hier geht die blaue Reflexion auf starke Polarisierungseffekte seiner Schuppenmikrostrukturen zurück.[21]
 Papilio blumei: Grün durch Pigmentierung
Papilio blumei: Grün durch Pigmentierung Papilio blumei: Blau durch polarisierte Reflexion und grüne Pigmentierung
Papilio blumei: Blau durch polarisierte Reflexion und grüne Pigmentierung
Funktionen
Flügelmusterung
Die Flügelmusterung spielt vielfältige Rollen bei Tarnung, eventueller Mimese, Warnfärbung, Mimikry, Partnerwahl und innerartlicher Kommunikation.[3]
Zwecke der Tarnung und Mimese (Phytomimese) sind bei vielen unscheinbaren oder formauflösenden Flügelmusterungen offensichtlich.

Warnfärbung
Manche deutlich kontrastreichen Musterungen besonders mit großen gegliederten Gelb- und Rotanteilen werden als Warnfärbung (Aposematismus) interpretiert, zumal wenn deren Träger Toxine für ihre möglichen Fressfeinde tragen (z. B. Ithomiini-Arten, Altinote dicaeus callianira).[22]
Mimikry
Mimikry (oder Bates’sche Mimikry) wird z. B. den großen Flecken des Tagpfauenauges als Scheinaugen zugeschrieben, die beim Auffliegen ein Wirbeltierauge imitieren.[23] Mimikry beinhaltet auch die Nachahmung aposematistisch gefärbter Tiere einer anderen Art, ohne jedoch über Toxine zu verfügen.
Innerartliche Kommunikation
Geschlechterspezifischen Musterungen kommt besondere Bedeutung zu bei der Partnersuche, Partnerwahl und Reviermarkierung. Insbesondere auffällige Erscheinungen der Flügelmusterung ermöglichen Signalweitergabe über größere Sichtentfernungen[14] und spielen oft eine Rolle in der innerartlichen Kommunikation, das plötzliche Zur-Schau-Stellen beim Aufklappen der Flügel kann aber auch starke Signalwirkung besitzen und einen panikartigen Fluchtreflex anderer Individuen auslösen.
Da UV- und Polarisationsmuster für Wirbeltieraugen kaum erkennbar sind, bieten diese speziellen Musterformen eine gute Möglichkeit zur innerartlichen Signalübermittlung, ohne die Aufmerksamkeit der Fressfeinde zu erregen.
Auftriebshilfe
Als Hohlkörper tragen die Schuppen zur Flugfähigkeit bei und verleihen dem Flügelschlag Stabilität.[1][3] Bei Aufwärtsbewegungen der Flügel werden sie auf den Untergrund gepresst und verhalten sich aerodynamisch, aber da sie locker beweglich angebracht sind, üben sie einen zusätzlichen Luftwiderstand bei Abwärtsbewegungen aus, wodurch weniger Muskelarbeit benötigt wird und eine Bremswirkung beim Absenken zu Landemanövern erreicht wird.
Der Verlust großer Teile der Beschuppung kann daher das Flugverhalten und die Flugfähigkeit beeinträchtigen.
Tarnung des Geleges
Verschiedene weibliche Schmetterlinge tarnen ihre Gelege bei Eiablage mit einigen Flügelschuppen (Afterwolle genannt), z. B. Augen-Eulenspinner, Frühlings-Kreuzflügel, Südliches Kleines Nachtpfauenauge.[24][25]
Wärmespeicherung
Melanin der Schuppen kann als Wärmeabsorber und -speicher dienen und die gespeicherte Sonnenwärme an den Körper abgegeben werden. Dunkle Flügelmuster konnten bei Weißlingen (Pieris) in Relation mit differentieller Körperwärmeverteilung gebracht werden.[26]
Wachsschuppen
Frisch in einem Ameisennest geschlüpfte myrmecophile Schmetterlinge wie Ameisenbläulinge können entkommen, da sie bewachste Schuppen tragen, welche die sie verfolgenden Knotenameisen irritieren und eine Weile behindern, den jungen Schmetterling zu überwältigen.[3][27]
Schuppenbüschel zum Aussteuern
Taubenschwänzchen nutzen spezielle verlängerte Schuppen, die wie Haarbüschel aussehen und die zur Namensgebung der Tiere beitrugen, zur Aussteuerung ihres kolibrihaften Schwirrflugverhaltens.
Duftschuppen
Viele männliche Coliasarten und Monarchfalter tragen Duftschuppen, welche anderen „normalen“ Schuppen ähneln, aber Pheromone verteilen helfen, um Weibchen anzulocken. Damit die Pheromone nicht durch Flügelschläge verweht und verschwendet werden, sitzen die Duftschuppen auf den Hinterflügeloberseiten an einer Stelle, an der sich Vorder- und Hinterflügel überdecken.[28]
Evolutionäre Entwicklung
Die stammesgeschichtliche Entwicklung der Schmetterlingsschuppen war eine entscheidende Eigenschaft, welche Schmetterlinge von anderen Insekten unterscheidet.[2] Die Schuppen entwickelten sich aus Sinnesborsten der gemeinsamen Insektenvorfahren.[2] Die Schuppen sind z. B. den Sinnesborsten von Drosophila homolog, entsprechende Gene wurden als homolog charakterisiert.[2] Da auch wenige Köcherfliegen ähnlich beschuppte Flügel tragen, werden die beiden Ordnungen Lepidoptera und Trichoptera auf einen gemeinsamen Vorfahren Amphiesmenoptera zurückgeführt.[29]
Einzelnachweise
- Was ist Schmetterlingsstaub?. Planet Wissen. Abgerufen am 7. März 2013.
- Ron Galant, et al.: Expression pattern of a butterfly achaete-scute homolog reveals the homology of butterfly wing scales and insect sensory bristles. In: Current biology. Band 8, Nr. 14, 2. Juli 1998, S. 807–813, doi:10.1016/S0960-9822(98)70322-7.
- M.J. Scoble: The Lepidoptera: Form, Function, and Diversity. 2005, Seite 63 (eingeschränkte Vorschau in der Google-Buchsuche, abgerufen am 21. August 2009).
- John Huxley, Peter C. Barnard: Wing‐scales of Pseudoleptocerus chirindensis Kimmins (Trichoptera: Leptoceridae). In: Zoological journal of the Linnean Society. Band 92, Nr. 3, 15. März 1988, S. 285–312, doi:10.1111/j.1096-3642.1988.tb01514.x (englisch).
- Heinz Schumacher, stellvertretender Vorsitzender der Arbeitsgemeinschaft rheinisch-westfälischer Lepidopterologen, zitiert durch
Was ist Schmetterlingsstaub?. Planet Wissen. Abgerufen am 7. März 2013. - L. P. Biró, et al.: Living photonic crystals: butterfly scales—nanostructure and optical properties. In: Materials Science and Engineering. C 27, Nr. 5–8, 2007, S. 941–946, doi:10.1016/j.msec.2006.09.043 (englisch).
- P. Vukusic, J. R. Sambles and C. R. Lawrence: Structural colour: Colour mixing in wing scales of a butterfly. In: Nature. Band 404, Nr. 6777, 30. März 2000, S. 457–457, doi:10.1038/35006561 (englisch).
- Mason C. W.: Structural colors in insects. II. In: The Journal of Physical Chemistry. Band 31, Nr. 3, Januar 1926, S. 321, doi:10.1021/j150273a001 (englisch).
- Robert E. Silberglied, O. R. Taylor: Ultraviolet differences between sulfur butterflies, Colias eurytheme and Colias philodice, and a possible isolating mechanism. In: Nature. Band 241, 1973, S. 406–408 (englisch).
- Robert E. Silberglied: Communication in the ultraviolet. In: Annual Review of Ecology and Systematics. Band 10, 1979, S. 373–398 (englisch).
- Jonathan M. Douglas, et al.: Light habitats and the role of polarized iridescence in the sensory ecology of neotropical nymphalid butterflies (Lepidoptera: Nymphalidae). In: The Journal of Experimental Biology. Band 210, 1. Mai 2007, S. 788–799, doi:10.1242/jeb.02713 (englisch).
- Doekele G. Stavenga, et al.: Glass scales on the wing of the swordtail butterfly Graphium sarpedon act as thin film polarizing reflectors. In: The Journal of Experimental Biology. Band 215, Nr. 4, 15. Februar 2012, S. 657–662, doi:10.1242/jeb.066902 (englisch).
- Doekele G. Stavenga, Marco A. Giraldo, Hein L. Leertouwer: Butterfly wing colors: glass scales of Graphium sarpedon cause polarized iridescence and enhance blue/green pigment coloration of the wing membrane. In: Journal of Experimental Biology. Band 213, Pt 10, 2010, S. 1731–1739, PMID 20435824 (englisch).
- Vukusic P., et al.: Quantified interference and diffraction in single Morpho butterfly scales. In: Proceedings of the Royal Society of London Series B: Biological Sciences. Band 266, Nr. 1427, 1999, S. 1403–1411 (Online).
- P. Vukusic, J. R. Sambles and H. Ghiradella: Optical classification of microstructure in butterfly wing-scales. In: Photonics Science News. Band 6, 2000, S. 61–66 (englisch, Online).
- Ro Prum, T. Quinn, Rh. Torres: Anatomically diverse butterfly scales all produce structural colours by coherent scattering. In: The Journal of experimental biology. Band 209, Pt 4, Februar 2006, ISSN 0022-0949, S. 748–765, doi:10.1242/jeb.02051, PMID 16449568 (englisch).
- G. I. Márk, Z. Vértesy, K. Kertész, Z. Bálint, L. P. Biró: Order-disorder effects in structure and color relation of photonic-crystal-type nanostructures in butterfly wing scales. In: Phys Rev E Stat Nonlin Soft Matter Phys. Band 80, 5 Part 1, 9. November 2009, PMID 20365002 (englisch).
- Dejan Pantelić, et al.: High angular and spectral selectivity of purple emperor (Lepidoptera: Apatura iris and A. ilia) butterfly wings. In: Optics Express. Band 19, Nr. 7, 2011, S. 5817–5826, doi:10.1364/OE.19.005817 (englisch).
- J. Heath, Emmet A. Maitland: The moths and butterflies of Great Britain and Ireland. Band 7, Nr. 1. Harley Books Ltd., Colchester 1989, ISBN 0-946589-25-9.
- Srećko B. Ćurčić, et al.: Micro‐and nanostructures of iridescent wing scales in purple emperor butterflies (Lepidoptera: Apatura ilia and A. iris). In: Microscopy Research and Technique. 2012, doi:10.1002/jemt.22021 (englisch).
- Ying-Ying Diao, Xiang-Yang Liu: Mysterious coloring: structural origin of color mixing for two breeds of Papilio butterflies. In: Opt Express. Band 19, Nr. 10, 9. Mai 2011, S. 9232–9241, doi:10.1364/OE.19.009232, PMID 21643177 (englisch).
- Aposematic colourations (en) Abgerufen am 9. März 2013.
- Diematic patterns (en) Abgerufen am 9. März 2013.
- Saturniidae of Europe. A.R. Pittaway, abgerufen am 22. März 2011.
- Unterschiede zwischen Saturnia pavonia und Saturnia pavoniella in Mittel- und Südeuropa. (PDF; 609 kB) Wolfgang A. Nässig, abgerufen am 22. März 2011.
- Joel G. Kingsolver: Thermoregulatory significance of wing melanization in Pieris butterflies (Lepidoptera: Pieridae): physics, posture, and pattern. In: Oecologia. Band 66, Nr. 4, 1985, S. 546–553 (englisch).
- Heiko Bellmann: Der neue Kosmos-Schmetterlingsführer, Schmetterlinge, Raupen und Futterpflanzen. Franckh-Kosmos, Stuttgart 2003, ISBN 3-440-09330-1, S. 150.
- Lennart Lundgren, Gunnar Bergström: Wing scents and scent-released phases in the courtship behavior ofLycaeides argyrognomon (Lepidoptera: Lycaenidae). In: Journal of Chemical Ecology. Band 1, Nr. 4, 1975, S. 399–412 (englisch).
- Paul Whalley: A review of the current fossil evidence of Lepidoptera in the Mesozoic. In: Biological Journal of the Linnean Society. Band 28, Nr. 3, 28. Juni 2008, S. 253–271, doi:10.1111/j.1095-8312.1986.tb01756.x (englisch).