Lithotrophie
Lithotrophie[1][2] bezeichnet bei Lebewesen eine spezielle Lebensweise[3] (Stoffwechseltyp): Lithotrophe Organismen sind in der Lage, anorganische Reduktionsmittel für ihren Baustoffwechsel zu verwenden. Für Reduktionen bei der Biosynthese werden bei allen Lebewesen reduzierende Coenzyme als Elektronenüberträger verwendet, die regeneriert werden müssen. So setzen beispielsweise Pflanzen NADPH in NADP+ um, wenn sie im Calvinzyklus aus CO2 Zucker bilden (Kohlenstoffdioxid-Assimilation). Diverse autotrophe Organismen nutzen zur Biosynthese andere Stoffwechselwege mit anderen Coenzymen. Lithotrophe Organismen können die zur Assimilation nötigen Coenzyme durch anorganische Elektronendonatoren regenerieren. Alle anderen Organismen sind organotroph und bei ihrer Biosynthese auf organische Elektronendonatoren beschränkt. Sie regenerieren z. B. NADPH mit NADH[4], das Reduktionsäquivalente aus dem Abbau organischer Verbindungen liefert.

Eine Reihe von lithotrophen Organismen können neben anorganischen Reduktionsmitteln auch organische, meist niedermolekulare organische Verbindungen zur NADPH-Regeneration nutzen. Sie sind fakultativ lithotroph.
Herkunft und Verwendung der Bezeichnung
Das Wort Lithotrophie kommt aus dem Altgriechischen und bedeutet wörtlich ‚sich von Steinen ernährend‘ (altgriechisch λίθος líthos, deutsch ‚Stein‘; altgriechisch τροφή trophḗ, deutsch ‚Ernährung‘), wobei „Stein“ hier für anorganische Stoffe steht. Das Adjektiv zu Lithotrophie lautet lithotroph (lithotrophe Lebewesen, lithotropher Stoffwechsel).
Diversität und Vorkommen lithotropher Organismen
Bei Prokaryoten ist Lithotrophie weit verbreitet. Lithotrophe Organismen kommen bei Archaeen und Bakterien in unterschiedlichen Familien vor, oft zusammen mit eng verwandten organotrophen Lebewesen. Bei Eukaryoten findet Lithotrophie innerhalb von Organellen statt, die höchstwahrscheinlich von prokaryotischen Endosymbionten abstammen.
| Redoxreaktion | E'0(V) |
|---|---|
| CO + H2O → CO2 + 2H+ + 2e− | −0,54 |
| H2 → 2H+ + 2e− | −0,41 |
| Ferredoxinreduziert → Ferredoxinoxidiert + e− | −0,4[6] |
| NADPH + H+ → NADP+ + 2 e− + 2 H+ | −0,32 |
| H2S → S + 2H+ + 2 e− | −0,25 |
| S + 4 H2O → SO42− + 8 H+ + 8 e− | −0,23 |
| NO2− + H2O → NO3− + 2 H+ + 2 e− | +0,42 |
| NH4+ + 2 H2O → NO2− + 8 H+ + 6 e− | +0,44 |
| Fe2+ → Fe3+ + e− | +0,78 |
| 2 H2O → O2 + 4 H+ + 4 e− | +0,86 |
Lithotrophe Organismen nutzen ganz unterschiedliche anorganische Elektronendonatoren (Tabelle 1). Darunter befinden sich sehr kräftige Reduktionsmittel wie Kohlenstoffmonoxid (CO) und Wasserstoff (H2), von denen Elektronen unter Energiegewinn auf NADP+ übertragen werden können. Die in der Tabelle unter NADPH stehenden Elektronendonatoren benötigen dagegen Energie um NADP+ zu reduzieren. Das triff vor allem auf H2O zu, das ohne Energiezufuhr nur äußerst starke Oxidationsmittel reduzieren kann.
Bei lithotrophen Organismen gibt es zur Nutzung der unterschiedlichen Elektronendonatoren nicht nur ganz verschiedene Enzyme und Elektronenüberträger, sondern auch ganz unterschiedliche Stoffwechselwege zur Nutzung anorganischer Reduktionsmittel.
Photolithotrophie
Decken lithotrophe Organismen ihren Energiebedarf photosynthetisch aus Licht, bezeichnet man sie als photolithotroph.
- Anaerobe photolithotrophe Bakterien, die H2S als Elektronendonator bei der anoxygenen Photosynthese nutzen und elementaren Schwefel als Abfallprodukt bilden. Hierzu zählen Schwefelpurpurbakterien (Chormatiaceae) und Grüne Schwefelbakterien (Chlorobiaceae).
- Pflanzen und Cyanobakterien unterscheiden sich dahingehend von photolithotrophen Organismen, als dass sie Wasser als Reduktionsmittel benutzen, was man als Photohydrotrophie bezeichnet.
Eine ausführliche Beschreibung photolithotropher Stoffwechseltypen findet sich unter Phototrophie und Photosynthese.
Energiestoffwechsel
Chemolithotrophe Organismen decken ihren Energiebedarf nicht durch Licht, sondern durch anorganische chemische Reaktionen, nämlich exergone Redoxreaktionen.
Inwieweit Organismen Energie aus Redoxreaktionen gewinnen können, hängt nicht nur vom Redoxpotential des Elektronendonators ab, sondern auch von dem des Elektronenakzeptors: Je größer die Differenz ist, desto mehr Energie ist daraus zu gewinnen.
- Viele chemolithotrophe Organismen nutzen das kräftige Oxidationsmittel O2 als Elektronenakzeptor. Sie sind aerob.
- Daneben gibt es eine Reihe anaerober chemolithotropher Archaeen und Bakterien. Sie nutzen beispielsweise die relativ schwachen Oxidationsmittel Sulfat und CO2 als Elektronenakzeptor.
Nahezu alle Organismen benötigen Energie in Form eines chemiosmotischen Membranpotentials. Ihre Cytoplasmamembranen sind außen positiv und innen negativ geladen. Innen ist die Konzentration negativ geladener Ionen (Anionen) höher als außen, positive Kationen wie z. B. H+-Ionen sind außen stärker konzentriert. So besteht neben dem Konzentrationsgradienten der Ionen auch noch ein elektrischer Gradient, also eine elektrische Spannung.
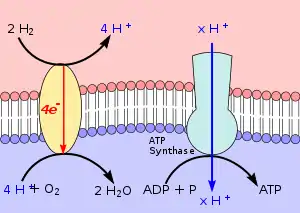
Diese Spannung nutzen alle chemolithotrophen Organismen zur Bildung von ATP, das als Energielieferant für die unterschiedlichsten Stoffwechselprozesse essentiell ist. Es entsteht durch die endotherme Reaktion
Diese Reaktion wird durch das Enzym ATP-Synthase katalysiert. Seine Funktion ist in Abb. 1 rechts im Bild schematisch erläutert. Der rote Bereich oben ist positiv geladen. Er befindet sich außerhalb der Zelle, im Bild oberhalb der Zellmembran. Von dort fließt ein Strom von H+-Ionen durch die ATP-Synthase in das Zellplasma (im Bild rötlich) und liefert die Energie für die ATP-Bildung.
Lithotrophe Organismen erhalten durch Redoxreaktionen ihr Membranpotenzial aufrecht. Dabei sind H+-produzierende Reaktionen meist auf der Außenseite der Zellmembran lokalisiert, während auf der Innenseite eher Reaktionen lokalisiert sind, die H+ verbrauchen. Links oben im Bild entsteht H+ aus der Oxidation von Wasserstoff. Links unten im Bild wird H+ verbraucht. Zusammen mit den vier Elektronen, die durch ein Transmembran-Komplex die Membran durchqueren, entsteht nach
- 4 H+ + O2 + 4 e ↔ 2 H2O
Wasser. Wegen dieser Reaktion, die gewissermaßen eine Knallgasreaktion ist, nennt man Organismen, die Wasserstoff zu Wasser oxidieren auch Knallgasbakterien. Für die Aufrechterhaltung ihres Membranpotentials finden sich bei lithotrophen Stoffwechselwegen ganz unterschiedliche Elektronentransportketten, Co-Enzyme, Cytochrome etc. Die wichtige Rolle der Zellmembranen zeigt sich daran, dass sie oft ähnlich den Thylakoiden stark eingefaltet sind und nicht selten Membranstapel[10] aufweisen.[11] Für das Verständnis, wie die Organismen ihr Membranpotential aufrechterhalten, ist es entscheidend, ob Redoxreaktionen an der Innen- oder Außenseite der Zellmembran stattfinden.[12]
Reduktion von NADP+
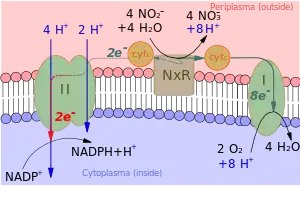
Es ist auffällig, dass viele chemolithotrope Organismen in der Lage sind, das kräftigere Reduktionsmittel NADPH unter Energieaufwand auch mit schwächeren Reduktionsmitteln zu regenerieren. Die Energie für die Regeneration von NADPH durch schwächere Reduktionsmittel wird bei einigen dieser Organismen durch ATP geliefert. Dazu dient eine Elektronentransportkette, in unter ATP-Verbrauch die schwach reduzierenden Elektronen auf ein Niveau gebracht werden, mit dem NADP+ zu NADPH reduziert werden kann.
Energielieferant für solche Elektronentransportketten ist in den meisten Fällen aber direkt das Membranpotential. Sie funktionieren damit wie reverse Atmungsketten oder umgekehrte Protonenpumpen. NADPH wird durch einströmende Protonen ohne ATP-Verbrauch regeneriert.[14]
- Das Prinzip ist in Abb. 2 anhand eines Nitrit oxidierenden Bakteriums erläutert (Abb. 2). Im Bild rechts wird das Membranpotential durch die außen stattfindende Oxidation von Nitrit und die an der Membran-Innenseite stattfindende Reduktion von O2 aufgebaut. Wie in Abb. 1 wird außen H+ gebildet und innen verbraucht.
- Elektronenüberträger ist dabei ein Cytochrom-Pool. Ein relativ geringer Teil der reduzierten Cytochrome speist ihre Elektronen in einen Enzymkomplex II (im Bild links). In diesem Enzymkomplex werden die Elektronen Schritt für Schritt auf immer schwächere Oxidationsmittel übertragen. Jeder dieser Schritte kostet Energie, die durch von außen nach innen transportierte H+-Ionen geliefert wird. Zum Schluss entsteht ein so kräftiges Reduktionsmittel, dass es zur Regenerierung von NADH dienen kann.
Lithoautotrophie
Viele lithotrophe Organismen können organische Verbindungen nicht als Kohlenstoffquelle für ihren Baustoffbedarf nutzen und sind deshalb auf anorganische Kohlenstoffquellen wie CO2 angewiesen. Diese reduzieren sie mit Hilfe des lithotroph gebildeten NADPH. Sie sind obligat autotroph, genauer lithoautotroph. Ihr Zellmaterial müssen sie durch Reduktion von CO2 durch NADH oder NADPH produzieren.
Andere, meist fakultativ lithotrophe Organismen können organische Verbindungen als Kohlenstoffquelle verwenden und sind fakultativ heterotroph.
- Photolithotrophe autotrophe Organismen sind die Primärproduzenten von Biomasse in den meisten Ökosystemen, z. B. Pflanzen und Cyanobakterien. Sie betreiben Photosynthese.
- Chemolithotrophe autotrophe Organismen sind in manchen lichtlosen Biotopen die Primärproduzenten. In der Tiefsee bilden sie beispielsweise die Basis einer Nahrungskette an „Schwarzen Rauchern“. Dort produzieren sie Biomasse, die sie aus der Oxidation von vulkanischem H2S gewinnen. Das nennt man gelegentlich Chemosynthese. Chemolithotrophe Organismen sind aber nicht auf lichtlose Biotope beschränkt.
Lithoheterotrophie
Verschiedene zu den Alphaproteobacteria gehörende marine Bakterien, die sogenannte Roseobacter-Gruppe (am besten bekannte Art ist Silicibacter pomeroyi), nutzen anstelle von Kohlendioxid Kohlenmonoxid als exklusive Kohlenstoffquelle. Anders als fakultativ kohlenmonoxidverwertende (carboxyotrophe) Bakterien wie Oligotropha carboxidovorans und Hydrogenophaga pseudoflava, die das Enzym Kohlenmonoxid-Dehydrogenase (CODH) nutzen, um erst Kohlendioxid zu bilden, das sie anschließend konventionell mittels RuBisCO fixieren (vgl. Energie- und Kohlenstoffquelle kohlenstoffmonoxidverwertender Bakterien), kommen sie mit den niedrigen Konzentrationen im Meerwasser aus, die hier vor allem durch abiotischen Abbau organischer Substanz entstehen. Die Bakterien der Roseobacter- Gruppe gewinnen aus der Oxidation von Kohlenmonoxid ausschließlich Energie, den Kohlenstoff zum Aufbau von Biomasse müssen sie durch heterotrophe Ernährung, also Aufnahme von Biomasse, decken. Diese bisher unbekannte, aber im Meerwasser individuenreich auftretende Bakteriengruppe ist zum Beispiel für die Modellierung des globalen Kohlenstoffzyklus bedeutsam.[15]
Beispiele für chemolithotrophe Lebewesen
Siehe auch
Einzelnachweise
- G. Gottschalk: Bacterial Metabolism. 2. Auflage. Springer, New York 1986.
- Hans G. Schlegel: Allgemeine Mikrobiologie. Thieme, Stuttgart / New York 1981, S. 177.
- Georg Fuchs, Hans Günter Schlegel, Thomas Eitinger: Allgemeine Mikrobiologie. 9., vollständig überarbeitete und erweiterte Auflage. Georg Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-444609-8, 12. Oxidation anorganischer Verbindungen: die chemolithotrophe Lebensweise.
- Sebastiaan K Spaans, Ruud A Weusthuis, John van der Oost, Servé W M Kengen: NADPH-generating systems in bacteria and archaea. In: Frontiers in Microbiology. 6, 2015, S. 742. doi:10.3389/fmicb.2015.00742.
- G. Gottschalk: Bacterial Metabolism. 2. Auflage. Springer, New York 1986, S. 288.
- Shuning Wang, Haiyan Huang, Jörg Kahnt, Rudolf K. Thauer: A Reversible Electron-Bifurcating Ferredoxin- and NAD-Dependent [FeFe]-Hydrogenase (HydABC) in Moorella. In: Journal of Bacteriology. 195, Nr. 6, 2013, S. 1267–1275. doi:10.1128/JB.02158-12.
- Anne De Poulpiquet, Alexandre Ciaccafava, Saïda Benomar, Marie-Thérèse Giudici-Orticoni, Elisabeth Lojou: Carbon Nanotube-Enzyme Biohybrids in a Green Hydrogen Economy. In: Satoru Suzuki (Hrsg.): Syntheses and Applications of Carbon Nanotubes and Their Composites. 2013, ISBN 978-953-511-125-2.
- bip.cnrs-mrs.fr
- Peter Karlson: Kurzes Lehrbuch der Biochemie für Mediziner und Naturwissenschaftler. Thieme, 1984.
- Membranstapel Foto
- Heribert Cypionka: Grundlagen der Mikrobiologie. Springer, 2010, ISBN 978-3-642-05095-4.
- Alan B. Hooper, Alan A. Dispirito: In Bacteria Which Grow on Simple Reductants, Generation of a Proton Gradient Involves Extracytoplasmic Oxidation of Substrate. In: Microbiological Reviews. June 1985, S. 140–157.
- S. Lücker, M. Wagner, F. Maixner, E. Pelletier, H. Koch, E. Spieck u. a.: Nitrospira metagenome illuminates the physiology and evolution of globally important nitrite-oxidizing bacteria. In: PNAS. 107, 2010, S. 13479–13484. doi:10.1073/pnas.1003860107
- Genome Sequence of the Chemolithoautotrophic Nitrite-Oxidizing Bacterium Nitrobacter winogradskyi Nb-255. In: Appl. Environ. Microbiol. March 2006 vol. 72 no. 3, S. 2050–2063.
- Mary Ann Moran, William L. Miller: Resourceful heterotrophs make the most of light in the coastal ocean. In: Nature Reviews Microbiology, 2007, 5, S. 792-800; doi:10.1038/nrmicro1746
- Gary M King, Carolyn F Weber: Distribution, diversity and ecology of aerobic CO-oxidizing bacteria. In: Nature Reviews Microbiology. 5, 2007, S. 107-118. doi:10.1038/nrmicro1595.
- Naresh Kumar Ponnuru: Carboxydothermus hydrogenoformans. (PDF) In: J Phylogen Evolution Biol. 2, Nr. 135, 2014, S. 2. doi:10.4172/2329-9002.1000135.
- G Meruane, T Vargas: Bacterial oxidation of ferrous iron by Acidithiobacillus ferrooxidans in the pH range 2.5–7.0. In: Hydrometallurgy. 71, Nr. 1, 2003, S. 149–158. doi:10.1016/S0304-386X(03)00151-8.
- M Libert, L Esnault, M Jullien, O Bildstein: Molecular hydrogen: an energy source for bacterial activity in nuclear waste disposal Archiviert vom Original am 27. Juli 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF) In: Physics and Chemistry of the Earth. 2010. Abgerufen am 12. August 2015.
- M. Guiral, C. Aubert, M.-T. Giudici-Orticoni: Hydrogen metabolism in the hyperthermophilic bacterium Aquifex aeolicus. In: Biochemical Society Transactions. 33, Nr. 1, 2005, S. 22–24.
- Bernhard Schink et al. Desulfotignum phosphitoxidans sp. nov., a new marine sulfate reducer that oxidizes phosphite to phosphate. In: Archives of microbiology, 2002, 177.5, S. 381–391.
- William W. Metcalf, Ralph S. Wolfe: Molecular genetic analysis of phosphite and hypophosphite oxidation by Pseudomonas stutzeriWM88. In: Journal of bacteriology, 1998, 180.21, S. 5547–5558. jb.asm.org
- Kartal B, Kuypers MM, Lavik G, Schalk J, Op den Camp HJ, Jetten MS, Strous M: Anammox bacteria disguised as denitrifiers: nitrate reduction to dinitrogen gas via nitrite and ammonium. In: Environmental Microbiology. 9, Nr. 3, 2007, S. 635–642. doi:10.1111/j.1462-2920.2006.01183.x. PMID 17298364.