Anammox
Anammox ist ein Akronym, das sich aus den Wörtern Anaerobe Ammonium-Oxidation zusammensetzt. Die anaerobe Ammonium-Oxidation ist ein biologischer Vorgang aus dem Bereich des Stickstoffkreislaufes.
Wie die Bezeichnung schon andeutet, ist die anaerobe Ammonium-Oxidation ein Oxidationsvorgang, der ohne Sauerstoff (anaerob) abläuft. Dabei wird Ammonium (NH4+) mit Nitrit (NO2−) unter anaeroben Bedingungen zu molekularem Stickstoff (N2) synproportioniert:
Unter Standardbedingungen wird dabei je Mol oxidiertes Ammonium 357,8 kJ Energie frei (ΔG0' = −357,8 kJ).
Anammox-Organismen
Von der Theorie schon Jahrzehnte zuvor postuliert[1], wurde die Anammox-Reaktion erstmals in den 1980ern in einer Abwasserreinigungsanlage in Delft in den Niederlanden beobachtet (Mike Jetten). Verantwortlich dafür ist das bisher wenig beachtete Bakterium Candidatus Brocadia anammoxidans. Anfang 2006 wurden von einem europäischen Forscherkonsortium Erkenntnisse zur Evolution und zum Stoffwechsel des erst seit wenigen Jahren bekannten Bakteriums gewonnen.[2] Neben Brocadia anammoxidans wurde der Anammox-Prozess auch bei den Bakterien Kuenenia stuttgartiensis und Scalindua sorokinii beobachtet; während erstere Süßwasserorganismen sind, lebt Scalindua im Meer.
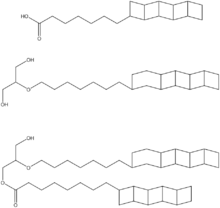
Dem Erbgut nach zählt Candidatus Brocadia anammoxidans eindeutig zu den Bakterien, doch besitzen die Mikroben Organellen, wie es eigentlich nur bei den komplizierter aufgebauten Eukaryoten (Lebewesen mit Zellkern) üblich ist. Die Zellwand der purpurroten Bakterien ähnelt dagegen der von Archaeen. Brocadia anammoxidans nutzt die Anammox-Reaktion zur Energiegewinnung, wobei das giftige Zwischenprodukt Hydrazin entsteht. Das Schlüsselenzym der Reaktion, eine Hydroxylamin-Oxidoreduktase, befindet sich in einer speziellen Organelle, dem Anammoxosom.[3] Lipide mit anellierten Cyclobutan-Ringen, aufgrund der leiterähnlichen Struktur als „Ladderane“ bezeichnet, verleihen der Membran des Anammoxosoms eine besonders dichte Struktur. Ursprünglich wurde angenommen, dass so das Austreten von Hydrazin aus dem Organell verhindert wird. Diese Barrierewirkung ist jedoch experimentell widerlegt, zudem finden sich Ladderane auch in anderen Membransystemen von Anammox-Bakterien[4].
Ein Forscherteam um Boran Kartal vom Max-Planck-Institut für marine Mikrobiologie in Bremen hat einen Mikroorganismus (Candidatus Methanoperedens nitroreducens – eine Archaee aus der Ordnung der Methanosarcinales) entdeckt, der Methan in einer anaeroben Methanoxidation mit Hilfe von dreiwertigem Eisen in Kohlenstoffdioxid umwandeln kann. Das dreiwertige Eisen wird dabei zu zweiwertigem Eisen reduziert, das gut wasserlöslich ist und somit anderen Organismen zur Verfügung steht. Außerdem kann C. Methanoperedens nitroreducens Nitrat zu Ammonium reduzieren, welches seinerseits in der Anammox-Reaktion ohne Sauerstoff elementaren Stickstoff (N2) bildet. Somit könnte in einem Bioreaktor, der zweierlei Mikroorganismen enthält, gleichzeitig Ammonium, Methan und Nitrat aus dem Abwasser in harmlosen elementaren, molekularen Stickstoff und Kohlenstoffdioxid umgewandelt werden, wobei Kohlenstoffdioxid weniger klimaaktiv als Methan ist.[5][6][7]
Bedeutung für die Abwasserreinigung
Der Anammox-Prozess ist nicht nur von akademischem Interesse, sondern bietet eine vielversprechende Alternative zu der klassischen Methode in Kläranlagen, Stickstoffverbindungen zu entfernen. Wohl aus diesem Grund wurden auch schon mehrere Patente in Zusammenhang mit dem Anammox-Prozess erteilt. Im Gegensatz zu den für biologische Klärstufen typischen Mikroben benötigt Brocadia anammoxidans keinen Sauerstoff und verbraucht noch dazu das Treibhausgas Kohlenstoffdioxid. Durch die entfallende Energieaufwendung zur Belüftung entstehen erhebliche Einsparpotenziale. Zwar liegen wegen der mangelnden Betriebserfahrung bei der Anwendung des Verfahrens im Hauptstrom keine belastbaren Zahlen vor, es werden jedoch Einsparpotenziale der Kosten auf bis zu 10 % prognostiziert und gleichzeitig verringert sich der Ausstoß von Kohlenstoffdioxid bis 88 %. Für die Entwicklung biologischer Verfahren legten die in den 90er Jahren durchgeführten Untersuchungen über die mikrobiologischen Zusammenhänge der Nitrifikation/Denitrifikation sowie insbesondere die zunehmende Kenntnis über Hemmmechanismen innerhalb der Stickstoffumsetzung die Grundlage zur Entwicklung angepasster Verfahren unter gezielter Verwendung dieser Mechanismen. Beispielhaft sind hier zu nennen die Untersuchungen in Wien (Nowak und Svardal, 1993; Nowak, 1996), Delft (van Niel et al., 1993; van Loosdrecht und Jetten, 1998) und Hannover (Abeling, 1994; Hippen, 1999). Eine erfolgreiche Anwendung von Anammox ist von unterschiedlichen Parametern abhängig, z. B. von den vorherrschenden Temperaturen und dem Schlammalter. In Deutschland wurden etwa seit dem Jahr 2000 auf unterschiedlichen Kläranlagen Anammox-Projekte umgesetzt, die bisher jedoch immer auf die Behandlung von Teilströmen konzentriert waren (z. B. Schlammwasserbehandlung). Bislang wird Anammox nur in Österreich auf der Verbandskläranlage Strass/Zillertal in der Hauptstromdeammonifikation eingesetzt. In Rotterdam setzte man diese Erkenntnisse seit Anfang 2006 um. Zum jetzigen Zeitpunkt stehen eine Vielzahl verschiedener Verfahrenssysteme auf dem Markt zur Verfügung. Inwieweit sie jeweils die Anforderungen an einen wirtschaftlichen und betriebsstabilen Betrieb erfüllen, wird sich in den nächsten Jahren mit zunehmenden Erfahrungen von großtechnisch realisierten Anlagen zeigen.
Eine weitere, noch unerforschte Variante der anaeroben Ammoniumoxidation ist die Oxidation mithilfe von Anoden bioelektrischer Systeme. Solche Systeme können mikrobielle Brennstoffzellen oder mikrobielle Elektrolysezellen sein. Unter Sauerstoffausschluss und in Abwesenheit von Nitrit oder Nitrat können Mikroorganismen, die die anodische Halbzelle bevölkern, Ammonium zu Distickstoff (N2) oxidieren.[8] Das Reaktionsprodukt ist also dasselbe, wie im klassischen Anammox-Verfahren. Gleichzeitig werden die freigesetzten Elektronen auf die Anode übertragen und können so einen elektrischen Strom erzeugen. Dieser kann dann der entweder direkt im Brennstoffzellenmodus[9] genutzt werden, oder im Elektrolyse-Modus zur Erzeugung von Wasserstoff und Methangas.[8] Während der Reaktionsmechanismus noch ungeklärt ist, wurde vermutet, dass Nitrit, Nitrat oder Distickstoffoxid als Intermediate eine Rolle spielen.[9] Da der Prozess jedoch auch bei sehr niedrigen elektrochemischen Potentialen stattfindet, scheinen andere, spekulative Reaktionsmechanismen ebenfalls möglich zu sein.
Ökologische Bedeutung
Bisher nahm man an, dass die sogenannte Denitrifikation (stufenweise bakterielle Reduktion von Nitrat zu Stickstoffgas durch organische Stoffe bei Sauerstoffmangel) für die Freisetzung von Stickstoff allein verantwortlich ist. Die Entdeckung der bakteriellen anaeroben Ammonium-Oxidation hat somit weitreichende Konsequenzen für das wissenschaftliche Verständnis des Stickstoffkreislaufs. Eine besondere Bedeutung für den globalen Stickstoffkreislauf hat die Anammox in den Ozeanen.[10]
Die mathematischen Modelle, welche die globale Stickstoffbilanz beschreiben, müssen jetzt revidiert werden, denn diese neu entdeckte Nährstoff-Senke hat direkten Einfluss auf die Berechnung des Kohlenstoffkreislaufs und damit auf langfristige Klimaabschätzungen.
Literatur
- M. S. Jetten et al.: 1994-2004: 10 years of research on the anaerobic oxidation of ammonium. In: Biochem. Soc. Trans. Bd. 33, 2005, S. 119–123. PMID 15667281.
- M. S. Jetten et al.: Anaerobic ammonium oxidation by marine and freshwater planctomycete-like bacteria. In: Appl. Microbiol. Biotechnol. Bd. 63, 2003, S. 107-14. PMID 12955353.
- M. S. Jetten et al.: Microbiology and application of the anaerobic ammonium oxidation ('anammox') process. In: Curr. Opin. Biotechnol. Bd. 12, 2001, S. 283–288. PMID 11404106.
- M. S. Jetten et al.: The anaerobic oxidation of ammonium. In: FEMS Microbiological Reviews. Bd. 22, 1998, S. 421–437. PMID 9990725.
- U. Abeling: Stickstoffelimination aus Industrieabwässern – Denitrifikation über Nitrit, In: Schriftenreihe des Institutes für Siedlungswasserwirtschaft und Abfalltechnik der Universität Hannover. H. 86, 1994.
- O. Nowak: Nitrifikation im Belebungsverfahren bei maßgebendem Industrieabwassereinfluß, In: Wiener Mitteilung. H. 135, 1996.
- O. Nowak, K. Svardal: Observations on the kinetics of nitrification under inhibiting conditions caused by industrial wastewater compounds. In: Water Science and Technology. Bd. 28, 1993, S. 115–123.
- A. A. van de Graaf, P. de Bruijn, A. Robertson, M. S. M. Jetten, J. G. Kuenen: Metabolic pathway of anaerobic ammonium oxidation on basis of 15N-studies in a fluidized bed reactor. In: Microbiology (UK). Bd. 143, 1997, S. 2415–2421.
- M. C. M. van Loosdrecht, M. S. M. Jetten: Microbiological conversions in nitrogen removal. In: Wat. Sci. Tech. Bd. 38, 1998, S. 1–8.
- E. W. J. van Niel, A. Robertson, J. G. Kuenen: A mathematical description of the behaviour of mixed chemostat cultures of an autotrophic nitrifier and a heterotrophic nitrifier / aerobic denitrifier; a comparison with experimental data. In: FEMS Microbiology Ecology, Bd. 102, 1993. S. 99–108.
Weblinks
Einzelnachweise
- Aharon Oren: Anammox revisited: thermodynamic considerations in early studies of the microbial nitrogen cycle, FEMS Microbiol Lett. 2015 Aug;362(15):fnv114, doi:10.1093/femsle/fnv114. PMID 26174999
- M. Strous et al.: Deciphering the evolution and metabolism of an anammox bacterium from a community genome. In: Nature. Bd. 440, Nr. 7085, 2006, S. 790–794. PMID 16598256
- Jogler, C. (2014), The bacterial ‘mitochondrium'. In: Molecular Microbiology, Vol. 94(4), pp 751–55, doi:10.1111/mmi.12814. PMID 25287615
- Neumann, S., et al. (2014), Isolation and characterization of a prokaryotic cell organelle from the anammox bacterium Kuenenia stuttgartiensis. In: Molecular Microbiology, Vol. 94(4), pp 794–802, doi:10.1111/mmi.12816. PMID 25287816
- Katharina F. Ettwig, Baoli Zhua, Daan Speth, Jan T. Keltjens, Mike S. M. Jetten, Boran Kartal: Archaea catalyze iron-dependent anaerobic oxidation of methane. 24. Oktober 2016, doi:10.1073/pnas.1609534113 (pnas.org).
- Mohamed F. Haroon, Shihu Hu, Ying Shi, Michael Imelfort, Jurg Keller, Philip Hugenholtz, Zhiguo Yuan, Gene W. Tyson: Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage. In: Nature. 500, Nr. 7464, 2013, S. 567–570, doi:10.1038/nature12375.
- Annika Vaksmaa, Simon Guerrero-Cruz, Theo A. van Alen, Geert Cremers, Katharina F. Ettwig, Claudia Lüke, Mike S. M. Jetten: Enrichment of anaerobic nitrate-dependent methanotrophic ‘Candidatus Methanoperedens nitroreducens’ archaea from an Italian paddy field soil, in: Appl Microbiol Biotechnol, Band 101, Nr. 18, S. 7075–7084, 4. August 2017, doi:10.1007/s00253-017-8416-0, PMID 28779290, PMC 5569662 (freier Volltext)
- M. Siegert, A. Tan: Electric stimulation of ammonotrophic methanogenesis. In: Frontiers in Energy Research. 7, 2019, S. 17. doi:10.3389/fenrg.2019.00017.
- A. Vilajeliu-Pons, C. Koch, M.D. Balaguer, J. Colprim, F. Harnisch, S Puig: Microbial electricity driven anoxic ammonium removal. In: Water Research. 130, 2018, S. 168–175. doi:10.1016/j.watres.2017.11.059.
- Moritz Holtappels, Phyllis Lam, Marcel M. M. Kuypers: Der Stickstoffkreislauf im Ozean. In: Biospektrum. Bd. 15, Nr. 4, 2009, S. 368–373.