Gallionella
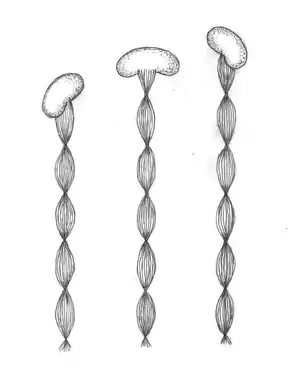
Gallionella ist eine Gattung der Bakterien, die bisher nicht sicher in das phylogenetische System der Bakterien eingeordnet werden kann und zurzeit als einzige Gattung der Familie Gallionellaceae in der Ordnung Nitrosomonadales geführt wird. Mit Gallionella ferruginea wurde 1836 erstmals ein Vertreter dieser Gattung beschrieben[2]. Gallionella ist bohnenförmig, gramnegativ, polar monotrich begeißelt, gewinnt Energie aus der Oxidation von zweiwertigen Eisenionen mit Sauerstoff (Chemolithotrophie), ist Kohlenstoff-autotroph und neutrophil (kommt im mittleren pH-Bereich vor). Charakteristisch für diese Organismen sind die verdrillten Anhänge, die in der Körpermitte auf der konkaven Seite gebildet werden. Allerdings finden sich diese Zellanhänge nicht bei allen Gallionellen.
| Gallionella | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Gallionella ferruginea | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Gallionellaceae | ||||||||||||
| Henrici & Johnson 1935[1] | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Gallionella | ||||||||||||
| Ehrenberg, 1838 |
Energiestoffwechsel
Gallionella nutzt als Energiequelle die bei der Oxidation von zweiwertigen Eisen-Ionen (Fe2+) mit Sauerstoff (O2) zu Verbindungen des dreiwertigen Eisens (Fe(III)) frei werdende Energie. Summengleichung für die Oxidation von Fe2+-Ionen zu Fe3+-Ionen:
- Fe2+ + 1/4 O2 + H+ → Fe3+ + ½ H2O
- Fe3+ + 3 H2O → Fe(OH)3 + 3 H+
Die Summengleichung der Oxidation von Fe2+ zu Fe(OH)3 lautet also:
- Fe2+ + 1/4 O2 + 2½ H2O → Fe(OH)3 + 2 H+
Voraussetzung für die Möglichkeit, aus der Fe2+-Oxidation Energie zu gewinnen, ist, dass in dem Milieu das Chemische Gleichgewicht der Redoxreaktion auf der Seite des dreiwertigen Eisens liegt, weil anderenfalls bei der Umsetzung keine Energie frei würde, dass aber andererseits die Fe2+-Ionen weitgehend stabil vorliegen müssen, damit sie dem Bakterium zur Verfügung stehen. Die Aktivierungsenergie der Fe2+-Oxidation muss also so hoch sein, dass eine von selbst ablaufende Oxidation (Autoxidation) nur sehr langsam abläuft. Bei hohen Sauerstoffkonzentrationen, hohem Redoxpotential und hohem pH-Wert ist das nicht gegeben, unter diesen Bedingungen läuft die Autoxidation schnell ab und für das Bakterium besteht keine Möglichkeit, durch Oxidation Energie zu gewinnen. Bei relativ niedriger Sauerstoffkonzentration und nicht zu hohem pH-Wert dagegen ist Fe2+ stabil, weil die Aktivierungsenergie der Oxidation zu Fe(III) hoch ist. Unter diesen Bedingungen kann das Bakterium die Oxidation enzymatisch katalysieren, d. h. Die Aktivierungsenergie herabsetzen und so lenken, dass die frei werdende Energie zur Deckung seines Energiebedarfs genutzt werden kann. Die Änderung der Freien Energie unter Standardbedingungen ΔG0′ bei der Eisenoxidation ist kaum zur Abschätzung der frei werdenden Energie geeignet, weil die Konzentrationen der Reaktanten sowohl unter natürlichen Bedingungen wie auch unter Laborbedingungen stark von den Standardbedingungen abweichen, besonders die Konzentration des Eisen(III)-Produkts, die wegen seiner sehr geringen Wasserlöslichkeit äußerst gering ist. Diese Tatsache ist für den Energiegewinn günstig. Für reale Bedingungen wurde ein ΔG von – 62,5 kJ/mol errechnet.[3]
Besonderheiten

Im mittleren pH-Bereich, in dem Gallionella vorkommt, sind die Fe3+-Ionen nicht stabil, sondern sie setzen sich mit Wasser zu fast unlöslichen Fe(III)-Verbindungen um, die als braune Ausfällungen in Erscheinung treten, beispielsweise zu Eisen(III)hydroxid: Die Ausscheidung des Oxidationsprodukts in Form eines Bandes in einem eng umgrenzten Bereich der Zelloberfläche hat den Vorteil, dass die Bakterienzelle nicht von den Eisenausfällungen umhüllt wird und dass auf diese Weise der Stoffaustausch mit der Umgebung nicht behindert wird. Das Band besteht aus etwa 40 (oder mehr) parallel angeordneten Filamenten, die wiederum aus aneinandergereihten globulären Partikeln mit einem Durchmesser von etwa 40 – 300 nm bestehen, und ist um seine Längsachse gedrillt. Die Drillung wird möglicherweise dadurch verursacht, dass die äußeren Fibrillen der Bänder etwas länger sind als die inneren. Man vermutet, dass das primär ausgeschiedene Band aus Ferrihydrit (ein Ferrioxid-Hydrat unklarer Struktur) besteht[4]. Meistens ist das Band an einem Festkörper angeheftet und die Bakterienzelle wird deshalb durch die Verlängerung des Bandes unter Drehung weiterbewegt. Bei der Teilung des Bakteriums wird das Band geteilt und jede der beiden Tochterzellen setzt einen Zweig des Bandes fort, so dass das Band an der Teilungsstelle dichotom verzweigt ist. Altert das Band, wird es durch abiotische Auflagerung von weiteren Eisen(III)oxid-Hydraten verdickt.
Vorkommen

Das Vorkommen ist bestimmt durch das Erfordernis, Energie aus der Oxidation von Eisen zu gewinnen. Das bedeutet, dass das Milieu Fe2+-Ionen und Sauerstoff enthalten muss. Das ist in solchen Habitaten der Fall, in die Wasserzuflüsse aus anoxischen, eisenhaltigen Bereichen gelangen, also etwa aus dem Grundwasserbereich eisenhaltigen Untergrunds. In solchen Bereichen liegt Eisen wegen des niedrigen Redoxpotentials in Form von im Wasser gelösten Fe2+-Ionen vor. Durch Kontakt mit Luft gelangt der erforderliche Sauerstoff in das Habitat. Die Sauerstoffkonzentration, das Redoxpotential und der pH-Wert müssen aber in Bereichen liegen, in denen zwar das Gleichgewicht der Redoxreaktion auf der Seite des Fe(III) liegt, die Aktivierungsenergie jedoch so hoch ist, dass die Autoxidation sehr langsam verläuft (siehe unter Energiestoffwechsel). Deswegen kommt Gallionella bei Redoxpotentialen von +200 bis +320 mV vor, bei Sauerstoffkonzentrationen von 0,1 bis 1 mg/L und im pH-Bereich von 6,0 bis 7,6. Zudem muss CO2 vorhanden sein (Konzentration über etwa 20 mg/L, weil das von Gallionella zum C-autotrophen Wachstum benötigt wird. In Gallionella-Habitaten liegt die Fe2+-Konzentration zwischen etwa 5 und 25 mg/L, die Konzentration an organischen Stoffen ist sehr gering. Der Temperaturbereich ist überwiegend etwa 8 – 16 °C, jedoch gibt es auch Vorkommen in wärmeren Habitaten, beispielsweise an Thermalquellen bis 47 °C. Gallionella kommt meistens in nichthalinen Wässern (Süßwasser), aber auch in Salzwasserhabitaten (Meerwasser) vor.
Wachstum, Vermehrung, Verbreitung
Die Gallionella-Zellen wachsen in die Länge und teilen sich quer. An einem natürlichen Standort wurde die Generationsdauer (Zeit zwischen zwei Zellteilungen) zu etwa 17 h bestimmt. In stationären Flüssigkulturen wurde eine Generationsdauer von etwa 11 h erreicht. In beiden Fällen wurde zwischen zwei Zellteilungen knapp 0,5 mm Band produziert. Die Verbreitung werden offenbar monopolar, monotrich begeißelte „Schwärmzellen“ gebildet.[5]
Technische Bedeutung
In Brunnen der Wassergewinnung und in Drainagesystemen in landwirtschaftlich genutzten Böden kommt es – wenn eisenhaltige Grundwässer vorliegen – oft durch Massenentwicklung von Gallionella und die damit verbundene Ausfällung von Fe(III)-Verbindungen zu Verstopfungen.
Bei der Aufbereitung von eisenhaltigen Grundwässern zu Trinkwasser muss das gelöste Eisen daraus entfernt werden. Dies geschieht durch Eintrag von Sauerstoff aus der Luft und Abscheidung des Eisens als Fe(III)-Verbindungen in Filtern. Hierbei entwickelt sich eine Population von Gallionella, ohne die die Eisenausfällung nur langsam abliefe und zu unzureichender Enteisenung des Grundwassers führen würde.
Arten
Bisher ist nur eine Art sicher bekannt, nämlich Gallionella ferruginea. Es wurden aber auch weitere Arten beschrieben, vor allem aufgrund von Variationen der Gestalt des Bandes. So wurde beispielsweise eine Art G. filamenta beschrieben, bei der das Band aus nur 3 – 8 parallel gelagerten Filamenten besteht. Die Identität dieser Formen als selbständige Arten ist jedoch nicht gesichert.
Literatur
- George M. Garrity, Julia A. Bell, Timothy G. Lilburn: Taxonomic Outline of the Prokaryotes. Bergey's Manual of Systematic Bacteriology. Second Edition, Release 5.0, Springer-Verlag, New York, 2004. PDF.
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.) The Prokaryotes, A Handbook of the Biology of Bacteria. Volume 5: Proteobacteria: Alpha and Beta Subclasses, 3. Auflage, Springer-Verlag, New York u. a. O., 2006, ISBN 978-0-387-25495-1 (Print) und ISBN 978-0-387-30743-5 (Online), doi:10.1007/0-387-30743-5.
Weblinks
Quellen
- J.P. Euzéby: List of Prokaryotic names with Standing in Nomenclature - Family Gallionellaceae
- C. G. Ehrenberg: Vorläufige Mitteilungen über das wirkliche Vorkommen fossiler Infusorien und ihre große Verbreitung. In: Poggendorf’s Annalen der Physik und Chemie. Bd. 38, 1836, S. 213–227.
- Arnold Martin Gebauer: Nachweis und Quantifizierung des Autotrophiestoffwechsels von Gallionella ferruginea Ehrenberg. Doktordissertation Technische Universität Braunschweig 1993.
- F. V. Tschukrov, L. P. Ermilova, A. I. Gorschkov, B. B. Zviagin, A. P. Shukchlistov, O. W. Siderenko, V. V. Balashova: Über die Natur der Eisenoxide in geologisch jungen Bildungen. In: Chemie der Erde Bd. 33, 1974, S. 109–124.
- Helmut Hanert: Struktur und Wachstum von Gallionella ferruginea Ehrenberg am natürlichen Standort in den ersten 6 Std der Entwicklung. In: Archiv für Mikrobiologie. Bd. 75, 1970 S. 10–24.