Eisen-Kohlenstoff-Diagramm
In verarbeitetem Eisen (Stahl und Gusseisen) ist stets eine gewisse Menge Kohlenstoff enthalten, dessen Anteil die Eigenschaften des Stahls und des Gusseisens bestimmt. Das Eisen-Kohlenstoff-Diagramm (EKD) ist ein Gleichgewichtsschaubild für das binäre System Eisen-Kohlenstoff, aus dem sich in Abhängigkeit vom Kohlenstoffgehalt und der Temperatur die Phasenzusammensetzung ablesen lässt.
Ist die zeitliche Gefügeentwicklung bei unterschiedlich schneller Abkühlung von Interesse, werden so genannte Zeit-Temperatur-Umwandlungsschaubilder verwendet.
Der Kohlenstoff ist der wichtigste Legierungsbestandteil des Stahls, da bereits kleinste Veränderungen des Kohlenstoffgehalts große Auswirkungen auf die Eigenschaften des Werkstoffs haben. Die Aussagefähigkeit des Eisen-Kohlenstoff-Diagramms wird jedoch geringer, je schneller abgekühlt oder erwärmt wird oder je größer der Gehalt an anderen Legierungselementen ist. Das EKD wird in zwei Formen dargestellt: dem metastabilen System (Fe-Fe3C), in dem der Kohlenstoff in gebundener Form vorkommt, und dem stabilen System (Fe-C) mit elementarem Kohlenstoff in Form von Graphit. Die beiden Systeme werden meist in einem Diagramm abgebildet und entsprechend gekennzeichnet. In der Praxis wird aber hauptsächlich das metastabile Fe-Fe3C-System verwendet.
Darstellung der Phasen
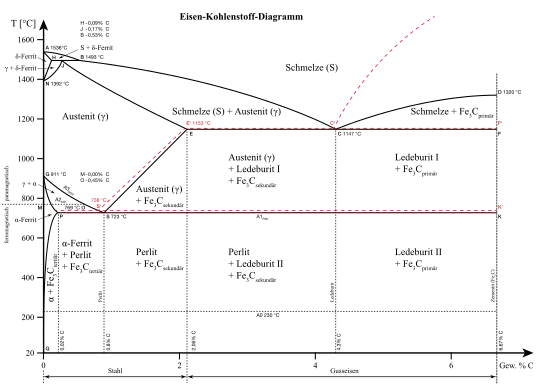
Auf der x-Achse werden die Massenprozente des Kohlenstoffs aufgetragen, auf der y-Achse die Temperatur. Das Diagramm stellt nur den technisch interessanten Kohlenstoffgehalt von 0 bis 6,67 %[1] dar. Letzteres entspricht einem Zementitgehalt von 100 %.
Die Linien stellen die zu anderen Temperaturen verschobenen Haltepunkte bzw. Knickpunkte dar und grenzen die einzelnen Phasenfelder voneinander ab. Die signifikanten Punkte werden mit Buchstaben gekennzeichnet. In einigen Darstellungen wird der Punkt I als Punkt J bezeichnet.
Der Linienzug ABCD stellt die Liquiduslinie dar, oberhalb dieser ist die Legierung flüssig, der Linienzug AHJECF entspricht der Soliduslinie, unterhalb der die Legierung komplett erstarrt ist. In dem Temperaturintervall zwischen der Liquidus- und Solidustemperatur hat die Legierung eine breiige Konsistenz und besteht aus Restschmelze, δ-Eisen, γ-Eisen und Zementit (Fe3C) in wechselnden Konzentrationen und Mengenverhältnissen. Wird bei der Abkühlung der Legierung die Liquiduslinie unterschritten, so beginnt die Primärkristallisation aus der Schmelze.
Aufgrund der verschiedenen allotropen Modifikationen des Eisens bilden sich je nach Kohlenstoffgehalt verschiedene Phasen. Das Eisen bildet verschiedene Einlagerungsmischkristalle (δ-, γ- und α-Mischkristalle) mit verschiedenen Löslichkeiten für Kohlenstoff. Die Gründe für das unterschiedliche Lösungsvermögen der einzelnen Mischkristalle sind die verschiedenen Raumgitter und Gitterkonstanten. Die metallografischen Bezeichnungen der Mischkristalle lauten δ-Ferrit für δ-Mischkristalle, Austenit für γ-Mischkristalle und Ferrit für α-Mischkristalle.
Grobe Unterteilung
- Schmelze bezeichnet die flüssige Eisen-Kohlenstoff-Legierung. Oberhalb der Liquiduslinie ist die gesamte Legierung als Schmelze, zwischen Liquidus- und Soliduslinie als eine Mischkristallkomponente mit Schmelze und unter der Soliduslinie als Mischkristalle vorhanden.
- δ-Ferrit (Delta-Ferrit): kubisch raumzentrierte Kristallstruktur
- Austenit (γ-Mischkristalle): kubisch flächenzentrierte Kristallstruktur
- α-Ferrit (Alpha-Ferrit): kubisch raumzentrierte Kristallstruktur
- Graphit (stabiles System) oder Zementit (Fe3C; metastabiles System)[1]
Bei Perlit und Ledeburit handelt es sich nicht um Phasen, sondern um besondere Phasengemische (Gefüge). Diese entstehen nur im stabilen oder metastabilen System, also bei langsamer Abkühlung. Andererseits entsteht bei schneller Abkühlung (z. B. Abschrecken in Wasser) aus Austenit Martensit. Martensit ist ein hartes und sprödes Gefüge. Im metastabilen System gibt es folgende charakteristische Punkte, Linien und Phänomene:[2]
- Punkte
- A: (0 %/1536 °C) B: (0,53 %/1493 °C) C: (4,3 %/1147 °C) D: (6,67 %/1320 °C) E: (2,06 %/1147 °C)
- F: (6,67 %/1147 °C) G: (0 %/911 °C) H: (0,1 %/1493 °C) J: (0,16 %/1493 °C) K: (6,67 %/723 °C)
- N: (0 %/1392 °C) P: (0,022 %/723 °C) S: (0,8 %/723 °C) Q: (0,002 %/20 °C) M: (0 %/769 °C)
- S': (0,69 %/738 °C) E': (2,03 %/1153 °C) C': (4,25 %/1153 °C)
- Linien
- Liquiduslinie: A-B-C-D Soliduslinie: A-H-J-E-C-F
- Eutektikale: E-C-F Eutektoide: P-S-K Peritektikale: H-J-B
- Phänomene
- Eutektikum: 4,3 % bei 1147 °C (Punkt C)
- Eutektoid: 0,8 % bei 723 °C (Punkt S)
- Peritektikum: 0,16 % bei 1493 °C (Punkt J)
Metallografische Bezeichnung
Die metallografischen Bezeichnungen der Mischkristalle lauten δ-Ferrit für δ-Mischkristalle, Austenit für γ-Mischkristalle und Ferrit für α-Mischkristalle.
| Bezeichnung | Max. C-Gehalt | Metallografische Bezeichnung |
|---|---|---|
| δ-Mischkristall | 0,10 % bei 1493 °C | δ-Ferrit |
| γ-Mischkristall | 2,06 % bei 1147 °C | Austenit |
| α-Mischkristall | 0,02 % bei 723 °C | Ferrit |
Die Eisen-Kohlenstoff-Verbindung Fe3C oder auch Zementit ist ebenfalls eine Phase, diese ist aber nicht mit Eisenmischkristallen zu verwechseln, es handelt sich hierbei um eine intermetallische/intermediäre Phase. Zementit kommt in drei unterschiedlichen Formen vor, wobei die chemische Zusammensetzung des Zementits immer die gleiche ist:
| Bezeichnung | Entstehung |
|---|---|
| Primärzementit | primäre Kristallisation aus der Schmelze (Linie CD) |
| Sekundärzementit | Ausscheidung aus dem Austenit (Linie ES) |
| Tertiärzementit | Ausscheidung aus dem Ferrit (Linie PQ) |
Neben den reinen Phasen treten auch Phasengemische auf:
| Bezeichnung | Besteht aus | Existenzbereich |
|---|---|---|
| Perlit | 88 % Ferrit und 12 % Zementit | 0,02 % bis 6,67 % bei T≤723 °C |
| Ledeburit I | 51,4 % Austenit und 48,6 % Zementit | 2,06 % bis 6,67 % bei 723 °C≤T≤1147 °C |
| Ledeburit II | 51,4 % Perlit und 48,6 % Zementit | 2,06 % bis 6,67 % bei T≤723 °C |
Isotherme Reaktionen
Das Eisen-Kohlenstoff-Diagramm zeigt drei isotherme Reaktionen, eine peritektische (Linie HIB), eine eutektische (Linie ECF) und eine eutektoide (Linie PSK). Punkt H: Maximale C-Löslichkeit im δ-Ferrit. Punkt J: Peritektikum δ+S → γ.
Bei der Erwärmung oder Abkühlung des Stahls entstehen an einigen Linien Haltepunkte, die die einzelnen Umwandlungen kennzeichnen. Die wichtigsten sind:
- A1 – Linie P-S-K, bei 723 °C zerfällt der Austenit zu Perlit, bei Kohlenstoffgehalten > 0,02 %
- A2 – Linie M-O, bezeichnet den Verlust des Ferromagnetismus von Ferrit bei einer Erwärmung über 769 °C (Curiepunkt).
- A3 – Linie G-O-S, wird bei der Abkühlung diese Linie unterschritten bilden sich C-arme α-Mischkristalle (Ferrit), der freiwerdende Kohlenstoff reichert sich im Austenit an, bis dieser bei 723 °C die eutektoide Konzentration erreicht hat.
Die Linie E-C-F wird eutektische Linie oder auch Eutektikale genannt, da hier das Eutektikum entsteht. Hat die Schmelze die eutektische Konzentration von 4,3 % C, wandelt sie sich isotherm bei 1147 °C (Punkt C) in ein Mischgefüge aus Austenit und Zementit um, den sogenannten Ledeburit.
Die Linie H-J-B wird peritektische Linie oder Peritektikale genannt, hier setzen sich die δ-Mischkristalle mit 0,1 % C und Restschmelze mit 0,51 % C isotherm bei 1493 °C zu γ-Mischkristallen mit 0,16 % C (Punkt I).
Anwendung
Mit Hilfe des Eisen-Kohlenstoff-Diagramms lassen sich beispielsweise einige Fragen zum unterschiedlichen Verhalten von Stahl (schmiedbare Eisenlegierung, meistens mit <2,06 % C) und Gusseisen (nicht schmiedbare Eisenlegierung, meist mit >2,06 % C) erklären:
- Stahl lässt sich schmieden, weil er im weiten, homogenen Austenitbereich gut verformbar ist. Bei Gusseisen tritt dieses Verhalten nicht ein, weil die größeren Anteile von Kohlenstoff in Form von Graphit oder Ledeburit die Verformbarkeit erschweren und der Übergang in die Schmelze schroff ist.
- Die Schmelztemperatur des reinen Eisens liegt bei 1536 °C, die Temperaturen der vollständigen Erstarrung (bzw. Beginn des Aufschmelzens) von Stahl (Linie A-H-I-E) und Gusseisen (Linie E-C-F bei 1147 °C) sind ebenfalls ablesbar. Der niedrigere Schmelzpunkt des Gusseisens ist eine der Ursachen, warum dieses besser und einfacher gießbar ist als Stahl.
Die grafische Darstellung dieser Eigenschaften in Abhängigkeit vom Kohlenstoffgehalt macht das Eisen-Kohlenstoff-Diagramm zu einem wichtigen Werkzeug zur Beurteilung und zum Verständnis der verschiedenen Eisenlegierungen, die eine der am häufigsten verwendeten Werkstoffgruppen bilden.
Literatur
- Hermann Schumann, Heinrich Oettel: Metallografie. 14. Auflage. Wiley-VCH-Verlag.
- Hans-Jürgen Bargel, Günter Schulze: Werkstofftechnik. 8. Auflage. Springer-Verlag Berlin.
- Volker Läpple: Wärmebehandlung des Stahls. 9. Auflage. Verlag Europa-Lehrmittel.
Einzelnachweise
- Christoph Broeckmann: Werkstoffkunde 1. Aachen 2015, S. 277 ff.
- Dr. Volker Läpple: Wärmebehandlung des Stahls Grundlagen, Verfahren und Werkstoffe. 8. Auflage. Europa-Lehrmittel Nourney, Vollmer, Haan 2003, ISBN 3-8085-1308-X.