Dystektikum
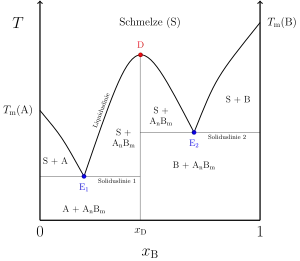
Als ein Dystektikum oder einen dystektischen Punkt (griechisch δύς dys- schlecht, τήκω teko schmelzen) bezeichnet man ein lokales Maximum der Liquiduslinie in einem Schmelzdiagramm.
Namensherkunft
Der Begriff Dystektikum leitet sich ab von der geringen Eignung intermetallischer Verbindungen als Werkstoffe, da bei diesen grobkristalline Gefüge entstehen, deren Festigkeit gering ist.[1]
Bedingungen
Voraussetzung für die Beobachtung eines Dystektikums ist, dass zwei (seltener mehrere) nicht mischbare Komponenten A und B einen Mischkristall mit einer konstanten stöchiometrischen Zusammensetzung AnBm bilden. Dieser steht mit der Schmelze am dystektischen Punkt im Gleichgewicht. Hieraus folgt, dass der Mischkristall eine kongruent schmelzende Verbindung sein muss: Er besitzt somit eine definierte Schmelztemperatur und darf sich somit nicht unterhalb des Schmelzpunktes zersetzen, was die Ausbildung eines Peritektikum zur Folge hätte.[2][3] Der Mischkristall kann keine Mischphasen mit den Komponenten A und B ausbilden, sodass es zur Entstehung zweier Eutektika kommt. Dies ist auf die unterschiedliche Kristallstruktur der Ausgangskomponenten und des Mischkristalls zurückzuführen (Beispiel: Mg: Hexagonal, Ge: Diamantstruktur, Mg2Ge: Fluorit-Struktur).[4]
Eine Besonderheit eines Dystektikums gegenüber einem Eu- oder Peritektikum ist, dass wenn die Verbindung AnBm sich in der Schmelze zersetzt, die Liquiduslinie am dystektischen Punkt stetig verläuft. Bei sich zersetzenden Mischkristallen wird dagegen eine unstetig verlaufende Liquiduslinie beobachtet.[5][6]
Vorkommen
Dystektika können für verschiedenste Zwei- oder Mehrkomponentensysteme beobachtet werden. Oftmals tritt ein dystektischer Punkt bei Schmelzen von Metallen auf, wenn diese beim Abkühlen intermetallische Verbindungen ausbilden (Beispiel: Entstehung von CaAl2 aus einer Calcium-Aluminium-Schmelze[5]).
Verbindungen wie GaAs[7] oder Mg2Ge zeigen jedoch auf, dass Dystektika nicht auf intermetallische Verbindungen limitiert sind. Oftmals kann ein dystektischer Punkt gar bei Mischungen von Nichtmetall-Verbindungen beobachtet werden, vorausgesetzt, es kommt zur Ausbildung von Assoziaten. Beispiele hierfür sind die Mischungen Resorcin/Harnstoff[8] oder Phenol/Anilin.[3]
Anwendung
Dystektika können genutzt werden, um die Existenz bestimmter Verbindungen nachzuweisen. Die Hydrate der Schwefelsäure konnten anhand der Dystektika im Siedediagramm nachgewiesen werden.[9]
Einzelnachweise
- Gert Blumenthal, Dietmar Linke, Siegfried Vieth: Chemie: Grundwissen für Ingenieure. Springer Verlag, Wiesbaden 2007, ISBN 978-3-8351-9047-4, Kap. 9, S. 134 (eingeschränkte Vorschau in der Google-Buchsuche).
- Schmelzdiagramm. In: Spektrum.de – Lexikon der Chemie. Abgerufen am 5. Januar 2018.
- Andreas Heintz: Thermodynamik der Mischungen: Mischphasen, Grenzflächen, Reaktionen, Elektrochemie, äußere Kraftfelder. Springer Verlag, 2017, ISBN 978-3-662-49924-5, Kap. 1, S. 64–65 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, Berlin/ New York 2011, ISBN 978-3-11-022566-2, Kap. 2, S. 195.
- Gerd Wedler, Hans-Joachim Freud: Lehrbuch der Physikalischen Chemie. 6. Auflage. Wiley-VCH, 2012, ISBN 978-3-527-32909-0, Kap. 2, S. 398 (eingeschränkte Vorschau in der Google-Buchsuche).
- Guenter Gauglitz, Manuela Reichert: Phasengleichgewichte – Dystektikum. In: chemgapedia.de. Abgerufen am 4. Januar 2018.
- Peter Atkins, Julio de Paula, James Keeler: Physical Chemistry. 11. Auflage. Oxford University Press, 2018, ISBN 978-0-19-876986-6, Kap. 5 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erich Meister: Grundpraktikum Physikalische Chemie: Theorie und Experimente. 2. Auflage. vdf Hochschulverlag, 2012, ISBN 978-3-7281-3709-8, Kap. 5, S. 85–87, doi:10.3218/3709-8 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman (Begr.), Egon und Nils Wiberg: Anorganische Chemie. 103. Auflage. Band 2. de Gruyter, Berlin/ Boston 2016, ISBN 978-3-11-049573-7, Kap. 11, S. 1653.