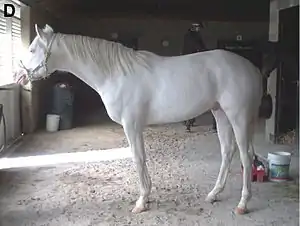
Leuzismus
Leuzismus (von altgriechisch λευκός (leukós, „weiß“)) ist eine Defektmutation bei Tieren, die dazu führt, dass das Fell weiß und die darunterliegende Haut rosa ist, da die Haut keine Melanozyten (farbstoffbildende Zellen) enthält. Im Gegensatz dazu sind beim Albinismus die Zellen zwar vorhanden, aber unfähig, den Farbstoff Melanin zu bilden.


Gene, deren Mutation zu Leuzismus führt, wurden früher üblicherweise mit „W“ abgekürzt. Sie bewirken in der frühembryonalen Entwicklung eine Fehlentwicklung von Strukturen der Neuralleiste, die dazu führt, dass keine oder sehr wenige Melanoblasten aus der Neuralleiste auswandern. Damit gibt es an der Körperoberfläche keine pigmentbildenden Zellen mehr. Bereiche, die mit dem Zentralnervensystem unmittelbar zusammenhängen, besonders die Augen, haben meist zumindest eine gewisse Anzahl pigmentbildender Zellen, sodass die Augen von leuzistischen Tieren hellbraun oder dunkelblau bis orange (bei Schlangen dunkelblau (fast schwarz) bis blau) gefärbt sind, je nachdem, wie hoch die Anzahl der Pigmentzellen ist. Es gibt leuzistische Gene, die gesundheitliche Beeinträchtigungen hervorrufen, insbesondere wenn sie homozygot vorliegen, aber auch solche, die keine Beeinträchtigungen mit sich bringen, hier ist manchmal die Kombination mit anderen Genen bedeutsam.
Die meisten Formen der Scheckung sind auf abgeschwächte Formen des Leuzismus zurückzuführen.
Inzwischen ist bekannt, dass es mehrere unterschiedliche Gene gibt, deren Mutationen zu Leuzismus führen können. Dazu gehört der Endothelin-Rezeptor-B-Gen (EDNRB), das Paired Box Gen 3 (PAX3), SOX10, der Microphthalmie-assoziierter Transkriptionsfaktor (MITF), c-Kit und der Steel-Locus (codiert MGF).
Mutationen einzelner Genorte
Endothelin-Rezeptor-B-Gen
Das Endothelin-Rezeptor-B-Gen (EDNRB) codiert einen G-Protein-gekoppelten Rezeptor, der in diversen Zelltypen produziert wird und für die Differenzierung der Melanozyten und Nervenzellen des Darmes zuständig ist, die die Neuralwülste schon vor der völligen Schließung des Neuralrohrs und der vollständigen Ausbildung der Neuralleiste verlassen.
Mutationen des Endothelin-Rezeptor-B-Gens führen deshalb zu Scheckung oder Leuzismus (rosa Haut und weißes Fell) und oft auch einer Überdehnung des Dickdarms (Megacolon) aufgrund fehlender Nervenzellen im Darm (Aganglionose). Der Megacolon führt innerhalb weniger Stunden bis Tage nach der Geburt zum Tod.
Menschen (EDNRB)
Ein kleiner Teil der Fälle von Morbus Hirschsprung sind auf Mutationen des Endothelinrezeptors zurückzuführen.
Ebenfalls eine Mutation des Endothelin-Rezeptors führt zum Waardenburg-Shah-Syndrom oder WS4.
Lethal white Syndrom bei Pferden (OLWS)

Heterozygote Träger einer Mutation des Endothelinrezeptors bei Pferden haben fast immer eine durch dieses Gen hervorgerufene Frame-Overo-Scheckung. Fohlen, die homozygot für das Frame-Overo-Gen sind, sind völlig weiß und sterben innerhalb von 24 Stunden nach ihrer Geburt an Darmverschluss aufgrund der fehlenden Darminnervation. Das nennt man Lethal-White-Syndrom.
- Siehe auch Overo-Lethal-White-Gen.
Ratten (EDNRB)

Heterozygote Tiere mit dem spotting lethal (sl)-Gen, bei dem es sich um eine Mutation des Endothelinrezeptors handelt, sind gescheckt. Die farbigen Flecken befinden sich auf dem Kopf, Schwanz und bilden einen schwarzen Rückenstreifen. Abgesehen davon sind sie gesund.
Für dieses Gen homozygote Ratten (slsl) sind völlig weiß mit dunklen Augen. Manchmal haben sie kleine Flecken auf Kopf und Hüften. Sie bekommen einen Megacolon aufgrund fehlender Nerven und sterben daran gewöhnlich innerhalb der ersten Lebenswoche.
Japanwachtel (Coturnix japonica) (EDNRB)
Bei der Japanwachtel (Coturnix japonica) ist eine der beiden Varianten des EDNRB-Gens bei Vögeln, nämlich EDNRB2 für die Farben Panda und Dotted white verantwortlich.[ednrb 1][ednrb 2]
c-Kit
c-Kit ist eine transmembrane Rezeptor-Tyrosinkinase aus der Familie der Plättchen-Wachstumsfaktor- (PDGF)- und CSF-1 (colony stimulating factor-1) Rezeptoren.
c-Kit ist beim malignen Melanom als Proto-Onkogen wirksam. Eine c-Kit-Expression wurde bei einigen soliden Tumoren nachgewiesen. Defekte von c-Kit führen zu myeloische Leukämien.
Der c-Kit-Rezeptor ist an der Vermehrung, Differenzierung, funktionellen Reifung sowie am Erhalt einer Vielzahl an differenzierten Zellen beteiligt. Seine Mutationen können Anämien und Sterilität verursachen. Außerdem sind sie für verschiedene Formen des Leuzismus und der Scheckung verantwortlich.
Mensch (c-Kit)

Piebaldismus – weiße Flecken auf der Haut, meist verbunden mit einer weißen Stirnlocke – wird beim Menschen ebenfalls durch den KIT-Locus hervorgerufen.
Maus (c-Kit)
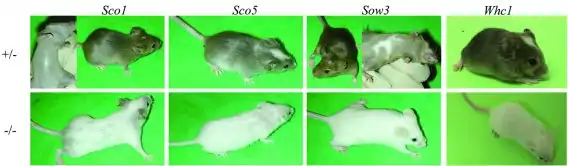
Der c-Kit-Locus der Maus ist unter anderem unter folgenden Namen bekannt: c-kit, belly-spot, dominant spotting, spotted sterile male, Steel Factor Receptor, Dominant white spotting, proto-oncogene protein
Die meisten Mutationen dieses Genorts sind unvollständig dominant.
Homozygote oder Mäuse mit zwei unterschiedlichen c-Kit Mutationen auf den Allelen sind meist dunkeläugig und völlig weiß. Je nach schwere der Mutation ist es im unterschiedlichen Maße mit weiteren Gesundheitsproblemen wie Sterilität, Leberschäden und Anämie verbunden. Viele sterben im Mutterleib oder kurz nach der Geburt. Nur wenn eine ausreichende Restfunktion von c-Kit erhalten ist, sind sie überlebensfähig. Die Belly-Spot-Mutante hat auch homozygot nur einen weißen Fleck unter dem Bauch und ist sonst gesund.
Heterozygote Mäuse sind lebensfähig und in unterschiedlichem Ausmaß gefleckt vor allem an Bauch und Schwanz.
Pferde (c-Kit)
Der Kit-Locus befindet sich auf Chromosom 3 des Pferdes (ECA3).
Eine von mehreren Formen der Sabinoscheckung wird durch eine Mutation des c-KIT-Locus hervorgerufen.
Dasselbe trifft auf das Roan-Gen zu das in heterozygoter Form zu stichelhaarigen Pferden führt, bei denen weiße und farbige Haare gemischt auftreten. Homozygot ist das Roan-Gen letal.
Auch für die Tobianoscheckung ist nachgewiesen, dass sie entweder durch den Kit-Locus selbst oder durch einen Genort, der auf demselben Chromosom in direkter Nachbarschaft liegt hervorgerufen wird.
Außerdem wurde nachgewiesen, dass die Dominant weiße Farbe des Pferdes ebenfalls auf diesen Locus zurückzuführen ist.
 TobianoscheckungCommons: Tobiano – Sammlung von Bildern, Videos und Audiodateien
TobianoscheckungCommons: Tobiano – Sammlung von Bildern, Videos und Audiodateien Deutliche Sabinoscheckung
Deutliche Sabinoscheckung Minimaler Sabino: Wenn das Gen nur einfach vorliegt, führt es zu deutlichen Abzeichen an Gesicht und Beinen mit höchstens kleinen Flecken am Bauch.
Minimaler Sabino: Wenn das Gen nur einfach vorliegt, führt es zu deutlichen Abzeichen an Gesicht und Beinen mit höchstens kleinen Flecken am Bauch. Dauer-Rotschimmel: Genetisch kein Schimmel, sondern ein Fuchs mit weißen Stichelhaaren
Dauer-Rotschimmel: Genetisch kein Schimmel, sondern ein Fuchs mit weißen Stichelhaaren
Rind (c-Kit)
Das weiße Gesicht der Herefordrinder ist durch den c-Kit-Locus hervorgerufen, und es besteht aufgrund dieser Mutation eine erhöhte Anfälligkeit für einen schnell wachsenden Krebs der Nickhaut (3. Augenlid). Das ebenfalls weiße Gesicht der Simmentaler Kühe ist auf eine andere Mutation zurückzuführen, deren Genort noch nicht bestimmt wurde. Sehr wahrscheinlich ist die typische Scheckung, die man von Holsteinern und Schwarzbunten Niederungsrindern kennt, ebenfalls auf den Kit-Locus zurückzuführen.
 Holsteiner Kühe
Holsteiner Kühe Herefordbulle
Herefordbulle
Schwein (c-Kit)
Sowohl die rosa Farbe der meisten Hochleistungsrassen, als auch verschiedene Scheckmuster als auch die Gürtelzeichnung einiger Schweinerassen werden durch Mutationen des c-Kit-Locus hervorgerufen.
 Norwegisches Landschwein
Norwegisches Landschwein
Die rosa Farbe der Schweine wird durch eine Mutation des c-Kit-Locus hervorgerufen.
 Gürtelzeichnung – ebenfalls eine c-Kit-Mutation
Gürtelzeichnung – ebenfalls eine c-Kit-Mutation
Katze (c-Kit)
Die weißen Handschuhe der Birma-Katze werden durch eine Mutation des c-Kit-Locus hervorgerufen. Das helle Körperfell und die blauen Augen sind dagegen Folgen eines Teilalbinismus, da hier zwar die Melanozyten vorhanden sind, diese aber aufgrund eines veränderten Enzyms nur noch an den kühleren Körperstellen Melanin produzieren können.
Die Gene, die für die weißen Flecken normaler Hauskatzen verantwortlich sind, sind zurzeit (2011) noch nicht identifiziert.
.jpg.webp) Birma-Katze mit weißen Handschuhen, verursacht durch eine Mutation im KIT-Locus
Birma-Katze mit weißen Handschuhen, verursacht durch eine Mutation im KIT-Locus Gescheckte Katzen haben ihre Flecken von einer Mutation von c-Kit
Gescheckte Katzen haben ihre Flecken von einer Mutation von c-Kit
Pax3
Das Pax3-Gen (paired box gene 3, auch paired domain gene 3 oder paired box homeotic gene 3) ist daran beteiligt, die frühe Embryonalentwicklung als Transkriptionsfaktor zu steuern.
Es gehört zur Gruppe der Pax-Gene, die typischerweise eine Paired-Box-Domäne und eine paired type homeodomain haben.
Leichte Mutationen dieses Lokus führen zu verschiedenen Formen der Scheckung und des Leuzismus. Andere Mutationen führen zu Taubheit. Es gibt schwere Missbildungen von Gehirn und Nervensystem, bei denen sich oft die Wirbelsäule bis zur Geburt nicht schließt (Spina bifida) oder der Schädel offen bleibt. Ebenso schwer kann das Kreislaufsystem betroffen sein, so dass viele der Hauptarterien an der falschen Stelle beginnen, Adern, die normalerweise zurückgebildet werden, erhalten bleiben und dergleichen. Schwere Mutationen des Gens führen deshalb noch vor der Geburt zum Tod.
Mensch (Pax3)
Beim Menschen rufen Mutationen des Gens das Waardenburg-Syndrom Typ 1 und 3 (WS1 und WS3), das craniofacial-deafness-hand syndrome (wörtlich: Gesichtsschädel-Taubheits-Hand-Syndrom) und das Rhabdomyosarkom hervor.
Maus (Pax3)
Die meisten Erkenntnisse über das Pax3-Gen wurden durch Mutationen der Maus gewonnen.
Neben Mutationen, die aufgrund schwerer Missbildungen von Nerven- und Kreislaufsystem noch im Mutterleib oder kurz nach der Geburt zum Tod führen, gibt es auch Tiere, die nur gescheckt und sonst gesund sind.
Häufige Merkmale sind weiße Füße, ein Knick im Schwanz, ein offenes Neuralrohr, verschiedene Fehlbildungen und Verlagerungen der Hauptarterien.
Microphthalmie-assoziierter Transkriptionsfaktor (MITF)
Der Microphthalmie-assoziierte Transkriptionsfaktor (MITF) ist ein Protein aus der Gruppe der Transkriptionsfaktoren. Mutationen seines Gens können zu verschiedenen Formen des Leuzismus (der Scheckung) führen. Außerdem treten Fehlbildungen der Augen (Mikrophthalmie) auf. Im Unterschied zu den meisten Formen des Leuzismus haben Tiere, die aufgrund einer Mutation dieses Locus leuzistisch oder gescheckt sind, oft keine blauen oder braunen, sondern rote oder rosa Augen.
Mensch (MITF)
Beim Menschen liegt das MITF-Gen auf dem Chromosom 3 (GeneID 4286) und verursacht das Tietz-Syndrom und das Waardenburg-Syndrom Typ 2 (WS2). Darüber hinaus wird die Aktivität des MITF-Gens im metastasierten Melanom in 10 – 16 % aller Fälle nachgewiesen. Die genaue Rolle von MITF in der Melanomentstehung und in der Progression ist aber noch ungeklärt.
Taufliege (Mitf)
Mutationen dieses Gens führen auch bei Taufliegen (Drosophila melanogaster) zu Fehlbildungen der Augen, was die Theorie stützt, dass Facettenauge und Linsenauge sich nicht unabhängig voneinander entwickelt haben.
Maus (Mitf)

Mutationen der Maus durch dieses Gen reichen von Tieren, die weiß, aufgehellt oder gescheckt, aber sonst gesund sind und aufgehellte, rote oder rosa Augen haben, bis hin zu Tieren mit schweren Fehlbildungen oder mit einem völligen Fehlen der Augen- und Knochenverdichtung in unterschiedlichem Ausmaß. Außerdem gibt es Tiere, die taub sind.
Sox10
Sox 10 ist ein Transkriptionsfaktor, der für die Herausbildung der Neuralleiste in der Embryonalentwicklung notwendig ist. Er ist notwendig für die Entwicklung der Melanozyten und der Oligodendrozyten, die im zentralen Nervensystem die Axone der Nervenzellen voneinander isolieren. Er spielt außerdem eine Schlüsselrolle in der Entwicklung des peripheren und des Eingeweide-Nervensystems.
Mensch (Sox10)
Mutationen des Sox10-Locus rufen beim Menschen das Waardenburg-Syndrom Typ 4, das Yemenite deaf-blind hypopigmentation syndrome und die neurologische Variante des Waardenburg-Shah-Syndroms hervor, das den Megakolon des Morbus Hirschsprung mit den Symptomen des Waardenburg-Syndroms kombiniert.
Schwerere Mutationen führen dazu, dass das Kind im Mutterleib noch während der Embryonalentwicklung abstirbt.
Maus (Sox10)
Neben verschiedenen Mutationen, die zu Leuzismus oder Scheckung ohne weitere Krankheitszeichen führen, gibt es auch bei der Maus Mutationen mit einem Megakolon, die dazu führen, dass die Jungtiere kurz nach der Geburt sterben.
Steel-Locus
Der Steel-Locus (Steel factor, SF, Steel) arbeitet eng mit dem c-Kit-Locus zusammen und wird deshalb auch Kitl (Kitlg, Kit ligand) genannt. Weitere Namen und Abkürzungen für den Steel-Locus sind: Sl; SLF; contrasted (Con), cloud gray (Clo), grizzle-belly (Gb), stem cell factor (SCF), mast cell growth factor (Mgf).
Wie alle Leuzismus-Loci führt er zu Leuzismus in unterschiedlicher Ausprägung.
Der Steel-Faktor spielt eine wesentliche Rolle in der Entwicklung der Zellen der Keimbahn zu fertigen Ei- und Samenzellen und bei ihrer Wanderung zu den späteren Geschlechtsorganen. Deshalb führen viele Mutationen dieses Locus zu Unfruchtbarkeit. Weitere häufige Folgen von Mutationen dieses Locus sind eine zu hohe Knochendichte und Anämie aufgrund verringerter Blutbildung. Da Steel auch die Entwicklungen der Mastzellen beeinflusst, können Mutationen zu Störungen des Immunsystems führen. Auch Taubheit kommt vor.
Maus (Steel)
Stark aufgehellte Mutationen führen zu Tieren mit weißem Fell und normalfarbigen Augen. Geringfügig aufgehellte Tiere sind entweder gleichmäßig grau oder haben an Ohren, Füßen, Schwanzspitze und auf dem Bauch hellere Stellen oder weiße Flecken.
Neben Tieren, die außer dem hellen Fell in jeder Hinsicht gesund sind, gibt es einige Mutationen, die mit Unfruchtbarkeit und Blutarmut verbunden sind oder bei denen homozygote Tiere noch im Mutterleib sterben.
Rind (Steel)
Die Farbe aus gemischten weißen und dunklen Haaren des Weißblauen Belgiers und des Shorthorn-Rindes wird durch eine Mutation des Steel-Locus hervorgerufen. Bei homozygoten Tieren führt die Mutation zu völlig weißem Fell und Unfruchtbarkeit eines Teils der Kühe (white heifer disease), da der Uterus nicht voll ausgebildet ist.
 Weißblauer Belgier homozygot für die Mutation des Steel-Locus
Weißblauer Belgier homozygot für die Mutation des Steel-Locus Weißblauer Belgier heterozygot für die Mutation des Steel-Locus
Weißblauer Belgier heterozygot für die Mutation des Steel-Locus Weißblauer Belgier ohne diese Mutation
Weißblauer Belgier ohne diese Mutation
Siehe auch
- Albinismus
- Fellfarbe
- Fellfarben der Hunde
- Fellfarben der Katze
- Fellfarben der Pferde
- Genetik der Pferdefarben
- Genetik des Hauskaninchens
- Melanismus
Quellen
Endothelinrezeptor
- Ling Hou, William J. Pavan, Myung K. Shin und Heinz Arnheiter: Cell-autonomous and cell non-autonomous signaling through endothelin receptor B during melanocyte development. In: Development. 2004, 131, S. 3239–3247 Published by The Company of Biologists doi:10.1242/dev.01193
- Cheryl E. Gariepy, Daniel T. Cass, Masashi Yanagisawa: Medical Sciences Null mutation of endothelin receptor type B gene in spotting lethal rats causes aganglionic megacolon and white coat color. In: Proc. Natl. Acad. Sci. USA. Vol. 93, S. 867–872, January 1996, http://www.pnas.org/cgi/content/abstract/93/2/867?ck=nck
- D. L. Metallinos, A. T. Bowling, J. Rine: A missense mutation in the endothelin-B receptor gene is associated with Lethal White Foal Syndrome: an equine version of Hirschsprung disease. In: Mamm Genome. 1998 Jun;9(6), S. 426–431. PMID 9585428.
- E. M. Santschi, P. D. Vrotsos, A. K. Purdy, J. R. Mickelson: Incidence of the endothelin receptor B mutation that causes lethal white foal syndrome in white-patterned horses. In: Am J Vet Res. 2001 Jan;62(1), S. 97–103. PMID 11197568
- G. C. Yang, D. Croaker, A. L. Zhang, P. Manglick, T. Cartmill, D. Cass: A dinucleotide mutation in the endothelin-B receptor gene is associated with lethal white foal syndrome (LWFS); a horse variant of Hirschsprung disease (HSCR). In: Human Molecular Genetics. 1998, Vol. 7, No. 6, S. 1047–1052.
- Jeanne Amiel, Tania Attié, Dominique Jan, Anna Pelet, Patrick Edery, Christelle Bidaud, Didier Lacombe, Paul Tam, Juliette Simeoni, Elisabeth Flori, Claire Nihoul-Fékété, Arnold Munnich, Stanislas Lyonnet: Heterozygous endothelin receptor B (EDNRB) mutations in isolated Hirschsprung disease. In: Human Molecular Genetics. 1996 Vol. 5, No. 3, S. 355–357.
- M. Tsudzuki, Y. Nakane, N. Wakasugi, M. Mizutani: Allelism of panda and dotted white plumage genes in Japanese quail. In: J Hered. 1993 May-Jun;84(3), S. 225–229. PMID 8228175
- M. Miwa, M. Inoue-Murayama, H. Aoki, T. Kunisada, T. Hiragaki, M. Mizutani, S. Ito: Endothelin receptor B2 (EDNRB2) is associated with the panda plumage colour mutation in Japanese quail. In: Anim Genet. 2007 Apr;38(2), S. 103–108. Epub 2007 Feb 22. PMID 17313575
c-Kit
- NCBI - Kit kit oncogene (Mus musculus)
- Olga Maksimovic: Untersuchungen zur Expression des c-kit-Rezeptors bei der Entstehung und Progression des malignen Melanoms. Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin, Universitätshautklinik Tübingen
- Edwin N. Geissler, Melanie A. Ryan, David E. Housman: The dominant-white spotting (W) locus of the mouse encodes the c-kit proto-oncogene. In: Cell. Volume 55, Issue 1, 7. Oktober 1988, S. 185–192, doi:10.1016/0092-8674(88)90020-7
- R. A. Fleischman: Human piebald trait resulting from a dominant negative mutant allele of the c-kit membrane receptor gene. In: J Clin Invest. 1992 Jun;89(6), S. 1713–1717. PMID 1376329
- S. A. Brooks, E. Bailey: Exon skipping in the KIT gene causes a Sabino spotting pattern in horses. In: Mamm Genome. 2005 Nov;16(11), S. 893–902. Epub 2005 Nov 11. PMID 16284805
- Hai-Bin Ruan, Nian Zhang, Xiang Gao: Identification of a Novel Point Mutation of Mouse Proto-Oncogene c-kit Through N-Ethyl-N-nitrosourea Mutagenesis. In: Genetics. 2005 Feb;169(2), S. 819–831. PMID 15731517
- M. Johansson Moller, R. Chaudhary, E. Hellmén, B. Höyheim, B. Chowdhary, L. Andersson: Pigs with the dominant white coat color phenotype carry a duplication of the KIT gene encoding the mast/stem cell growth factor receptor In: Mammalian Genome. Springer, New York, ISSN 0938-8990, Volume 7, Number 11 / November 1996, doi:10.1007/s003359900244, S. 822–830.
- E. Giuffra, G. Evans, A. Tornsten, R. Wales, A. Day, H. Looft, G. Plastow, L. Andersson: The Belt mutation in pigs is an allele at the Dominant white (I/KIT) locus. In: Mamm Genome. 1999 Dec;10(12), S. 1132–1136. PMID 10594235
- E. Giuffra, A. Tornsten, S. Marklund, E. Bongcam-Rudloff, P. Chardon, J. M. Kijas, S. I. Anderson, A. L. Archibald, L. Andersson: A large duplication associated with dominant white color in pigs originated by homologous recombination between LINE elements flanking KIT. In: Mamm Genome. 2002 Oct;13(10), S. 569–577. PMID 12420135
- M. P. Cooper, N. Fretwell, S. J. Bailey, L. A. Lyons: White spotting in the domestic cat (Felis catus) maps near KIT on feline chromosome B1. In: Anim Genet. 2006 April; 37(2), S. 163–165. doi:10.1111/j.1365-2052.2005.01389.x.
- S. Marklund, M. Moller, K. Sandberg, L. Andersson: Close association between sequence polymorphism in the KIT gene and the roan coat color in horses. In: Mamm Genome. 1999 Mar;10(3), S. 283–288. PMID 10051325
- C. Mau, P. A. Poncet, B. Bucher, G. Stranzinger, S. Rieder: Genetic mapping of dominant white (W), a homozygous lethal condition in the horse (Equus caballus). In: Journal of Animal Breeding and Genetics. 121 (6), Volume 121, Issue 6, S. 374–383 doi:10.1111/j.1439-0388.2004.00481.x.
- N. Reinsch, H. Thomsen, N. Xu, M. Brink, C. Looft, E. Kalm, G. A. Brockmann, S. Grupe, C. Kuhn, M. Schwerin, B. Leyhe, S. Hiendleder, G. Erhardt, I. Medjugorac, I. Russ, M. Forster, R. Reents, G. Averdunk: A QTL for the degree of spotting in cattle shows synteny with the KIT locus on chromosome 6. In: J Hered. 1999 Nov-Dec;90(6), S. 629–634. PMID 10589513
- M. D. Grosz, M. D. MacNeil: The "spotted" locus maps to bovine chromosome 6 in a Hereford-Cross population. In: J Hered. 1999 Jan-Feb;90(1), S. 233–236. PMID 9987932
- Sheila Schmutz: Genetics of Coat Color Patterns in Cattle. Whiteface. Stand: 17. Feb. 2004,
- Sheila M. Schmutz: Cat Coat Color Genetics. Stand 18. Oktober 2011,
- L. Magnol, M. C. Chevallier, V. Nalesso, S. Retif, H. Fuchs, M. Klempt, P. Pereira, M. Riottot, S. Andrzejewski, B. T. Doan, J. J. Panthier, A. Puech, J. C. Beloeil, M. H. de Angelis, Y. Herault: KIT is required for hepatic function during mouse post-natal development. In: BMC Dev Biol. 2007 Jul 5;7, S. 81. PMID 17612398
- M. C. Penedo, L. V. Millon, D. Bernoco, E. Bailey, M. Binns, G. Cholewinski, N. Ellis, J. Flynn, B. Gralak, A. Guthrie, T. Hasegawa, G. Lindgren, L. A. Lyons, K. H. Roed, J. E. Swinburne, T. Tozaki: International Equine Gene Mapping Workshop Report: a comprehensive linkage map constructed with data from new markers and by merging four mapping resources. In: Cytogenet Genome Res. 2005;111(1), S. 5–15. PMID 16093715
Pax3
- Waardenburg syndrome, type I. In: Online Mendelian Inheritance in Man. (englisch).
- Craniofacial-deafness-hand Syndrome. In: Online Mendelian Inheritance in Man. (englisch).
- Rhabdomyosarcoma 2. In: Online Mendelian Inheritance in Man. (englisch).
- Waardenburg syndrome, type III. In: Online Mendelian Inheritance in Man. (englisch).
- Pax3 paired box gene 3 (Mus musculus)
- M. Ptok, S. Morlot: Einseitige Innenohrschwerhörigkeit bei Mutationen im PAX3-Gen bei Waardenburg-Syndrom Typ I. In: HNO. Springer, Berlin/ Heidelberg, Volume 54, Number 7 / Juli 2006, ISSN 0017-6192, S. 557–560. doi:10.1007/s00106-005-1315-1
MITF
- NCBI: Mitf (Drosophila melanogaster), GeneID: 3885647, Stand: 21-Feb-2007
- NCBI: Mitf microphthalmia-associated transcription factor (Mus musculus), GeneID: 4286, Stand: 05-Apr-2007
- Phenotypic Alleles (Memento vom 27. September 2011 im Internet Archive)
- NCBI: MITF microphthalmia-associated transcription factor (Homo sapiens), GeneID: 4286, Stand: 08-Apr-2007
- NCBI: Tietz syndrome, MIM: 103500
- NCBI: Waardenburg syndrome, type IIA, MIM: 193510
- NCBI: Waardenburg syndrome/ocular albinism, digenic, MIM: 103470
Sox10
- Sandra Wißmüller: Biochemische Analyse der Eigenschaften der HMG-Domäne des Transkriptionsfaktors Sox10. Naturwissenschaftliche Fakultäten der Friedrich-Alexander-Universität Erlangen-Nürnberg, 2006.
- Michael Wegner: Mechanistische Analyse der Interaktion zwischen den Transkriptionsfaktoren Sox10 und Pax3. Lehrstuhl für Biochemie und Pathobiochemie, Institut für Biochemie, Uni Erlangen.
- NCBI: Sox10 SRY-box containing gene 10 (Mus musculus), GeneID: 20665, Stand: 24-Mar-2007
- NCBI: SOX10 SRY (sex determining region Y)-box 10 (Homo sapiens), GeneID: 6663, Stand: 08-Apr-2007
Steel
- NCBI: Kitl kit ligand (Mus musculus). GeneID: 17311, Stand: 05-Apr-2007
- Mouse Genome Informatics: Kitl. Phenotypic Alleles, Stand: 16. April 2007
- C. Charlier, B. Denys, J. I. Belanche, W. Coppieters, L. Grobet, M. Mni, J. Womack, R. Hanset, M. Georges: Microsatellite mapping of the bovine roan locus: a major determinant of White Heifer disease. In: Mamm Genome. 1996 Feb;7(2), S. 138–142. PMID 8835531
- J. J. Seitz, S. M. Schmutz, T. D. Thue, F. C. Buchanan: A missense mutation in the bovine MGF gene is associated with the roan phenotype in Belgian Blue and Shorthorn cattle. In: Mamm Genome. 1999 Jul;10(7), S. 710–712. PMID 10384045
- Sheila Schmutz: Genetics of Coat Color Patterns in Cattle. The Roan Pattern. Stand: 17. Februar 2004