Südlicher Fiskalwürger
Der Südliche Fiskalwürger (Lanius collaris) ist ein Singvogel aus der Gattung der Echten Würger (Lanius) innerhalb der Familie der Würger (Laniidae). Der Südliche Fiskalwürger wurde 2011 aus dem Lanius collaris–Komplex herausgelöst und in Artrang gestellt. Trotz der sehr großen morphologischen Ähnlichkeit zur Schwesterart, dem Nördlichen Fiskalwürger, bestehen zwischen diesen Arten sehr deutliche genetische Unterschiede.[1] Der schwarz-weiß gezeichnete Vogel mit der auffallenden weißen V-Zeichnung am Rücken, ist mit bis zu 23 Zentimetern Körperlänge etwas kleiner als der Nördliche Raubwürger, aber wesentlich größer als ein Neuntöter.
| Südlicher Fiskalwürger | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Südlicher Fiskalwürger | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Lanius collaris | ||||||||||||
| Linnaeus, 1766 |
Der Südliche Fiskalwürger ist im südlichen Afrika sehr weit verbreitet. Die Art bewohnt unterschiedliche, mäßig feuchte bis ausgesprochen trockene Habitate. Sie benötigt Büsche, Bäume, Termitenhügel, bzw. Zäune oder Strommasten als Ansitze und eine möglichst niedrige Bodenvegetation. In zunehmendem Maße dringt der Südliche Fiskalwürger in Siedlungen und Städte vor, bewohnt landwirtschaftlich genutztes Land, und erschließt sich entlang von Straßen und der sie begleitenden Strommasten neue Lebensräume.[2] Die Art ist vom Meeresniveau bis in Höhen von über 3000 Metern verbreitet.[3]
Der Südliche Fiskalwürger ist ein opportunistischer Jäger, der allen Tieren nachstellt, die er überwältigen kann. Arthropoden bilden den Hauptanteil der Nahrung.
Lanius collaris ist ein Standvogel. Außerbrutzeitlich streicht er kleinräumig umher; auch vertikale Wanderungen wurden beobachtet.[3] Er lebt einzeln oder in Paaren. Zumindest während der Brutzeit behauptet ein Paar ein Territorium.
Die Art, von der 4–5 Unterarten beschrieben werden, gehört gemeinsam mit dem Nördlichen Fiskalwürger zur Lanius collaris – Superspezies. Inwieweit auch andere Würger diesem Artenkreis zuzuzählen sind (Rostmantelwürger, Mackinnonwürger, São-Tomé-Würger), ist Gegenstand gegenwärtiger Forschung.[4]
Im Gegensatz zu den meisten anderen Arten der Gattung Lanius hat sich der Südliche Fiskalwürger regional sehr gut an die Nähe des Menschen angepasst, ist weit verbreitet und lokal häufig. Er wird in keiner Gefährdungsstufe gelistet.[5]
Aussehen
.jpg.webp)
_(6538086101).jpg.webp)

Deutlich die rostroten Flanken, die hell gerandeten Flügeldecken und Schwingen sowie die erkennbare Gesichtsmaske
Der Südliche Fiskalwürger ist ein mittelgroßer, langschwänziger, auffallend schwarz-weiß gezeichneter Würger mit zur Gänze schwarzem Kopf und schwarzem Nacken. Die Größe der einzelnen Unterarten liegt zwischen 21 und 23 Zentimetern bei einem Gewicht zwischen 24,7 und 54 Gramm, wobei die größten und schwersten Individuen in den Höhenlagen festgestellt wurden. Die Unterschiede waren bei Messungen, die zur gleichen Jahreszeit und innerhalb der gleichen Unterart stattfanden, beträchtlich: Vögel aus Durban nahe dem Meeresniveau wogen durchschnittlich 32 Gramm, solche aus Harrismith auf 1800 Metern Höhe 52 Gramm.[6][7] Beim sitzenden Vogel ist die V-förmige Schulter- und Rückenzeichnung besonders auffällig und kennzeichnend, beim fliegenden zusätzlich die sichelförmigen weißen Flügelfelder, der hellgraue Bürzel und die weißen Außenfedern des Schwanzes.
Kopf, Nacken und oberer Rücken sind tiefschwarz. Der Schultergürtel ist weiß, der Bürzel weißlich-grau bis hellgrau. Die Unterart L. c. subcoronatus ist durch einen breiten weißen Überaugenstreif gekennzeichnet, L. c. marwitzi weist einen schmalen, manchmal auch unterbrochenen Überaugenstreif auf. Die Schwingen sind auf der Oberseite schwarz, auf der Unterseite dunkel schiefergrau. Die an ihrer Basis weißen Handschwingen bilden beim sitzenden Vogel ein nicht immer deutlich erkennbares weißes Flügelfeld, das im Fluge als sichelförmige Markierung jedoch sehr auffällig ist. Die Mittelfedern des im Gegensatz zu den Vertretern der Nordgruppe etwas kürzeren und breiteren, gestuften Schwanzes sind zur Gänze schwarz, die Außenfedern weiß. Zur Mitte hin weisen einige Steuerfedern unterschiedlich deutliche weiße, oft tropfenförmige Einschlüsse auf. Die gesamte Unterseite ist weiß oder grau-weiß; an den Flanken sind – insbesondere bei gerade ausgefärbten Individuen – feine dunkle Wellungen erkennbar. Der mächtige Hakenschnabel ist schwarz, ebenso die Beine. Die Iris der Augen ist schwarzbraun.
Männchen und Weibchen sind sehr ähnlich gefärbt. Die Schwarzanteile des Weibchengefieders sind weniger gesättigt, eher sehr dunkel schwarzbraun. Kennzeichnend ist eine bauschige, rötlich braune Federpartie an den Flanken, die jedoch häufig unter den Flügeln verborgen wird. Weibchen sind geringfügig, feldornithologisch nicht auswertbar, kleiner und leichter als Männchen.[8] Juvenile haben eine stumpf braune oder graubraune, fein dunkel gewellte Oberseite, wobei auch die bereits weiße Schulterpartie schwarz oder braun gewellt ist. Der Kopf und der Nacken sind eher rostbraun. Die würgertypische schwarze Gesichtsmaske, die beim adulten Vogel vom Schwarz des Kopfes verdeckt wird, ist als dunkler Bereich erkennbar. Die matt weiße Unterseite weist feine dunkle Wellen, zum Teil auch Flecken auf, die Flanken sind bei beiden Geschlechtern rötlich braun behaucht. Das Flügelfeld ist matt weiß, oft auch isabellfarben. Die Großen Armdecken sind hellbraun gerandet, ein Merkmal, das auch oft noch nach der ersten nachbrutzeitlichen Mauser erkennbar ist. Juvenile der Nordgruppe unterscheiden sich deutlich von jenen der Südgruppe. Erstere sind eher rötlich braun und bedeutend intensiver gewellt.[8]
Gelegentlich wurden Teilalbinos beobachtet.[8]
Mauser
Juvenile beginnen im Alter von etwa drei Monaten in das erste Erwachsenengefieder zu mausern. In vielen Regionen liegt der Zeitpunkt dieser Mauser zwischen Januar und Juli. Es ist eine Komplettmauser, die die meisten 6–7 Monate alten Individuen abgeschlossen haben.[9] Die hellen Randungen der Großen Armdecken, gelegentlich auch rostbraune Federpartien an den Flanken, können fallweise auch noch nach der zweiten Gesamtmauser festgestellt werden. Adulte Vögel vermausern nachbrutzeitlich einmal im Jahr ihr gesamtes Gefieder. Der Zeitpunkt der Mauser variiert entsprechend den regional unterschiedlichen Brutterminen, liegt aber meist in den südlichen Spätherbst- und Wintermonaten.
Lautäußerungen
Die Art verfügt über eine Vielzahl unterschiedlicher Rufe[10], die zum Teil sehr selektiv in eng definierten Situationen (z. B. Warnung vor Flugfeinden) eingesetzt werden. Häufigster Ruf, der sowohl im territorialen als auch sexuellen Kontext stehen kann, ist ein mäßig lautes, meist zweisilbiges, mehrfach gereihtes, krächzendes, Tscher–tschjät..., das unterschiedlich moduliert wird und meist auf der zweiten Silbe betont ist. Eindeutig sexuell motiviert sind leisere, weniger raue tschüö-tschjüt–Rufe. Heisere, oft grelle khriiie…, oder fast avokale chhiii… Rufreihen sind sowohl Aggressionslaute als auch undifferenzierte Alarmrufe. Zwischen den Partnern ist als Kontaktruf oft ein einzelnes Tsche zu hören, manchmal begleitet von leisen Pfeiftönen. Der Gesang ist ein leises, individuell sehr unterschiedliches Schwätzen, durchmischt mit gepressten Lauten, Pfiffen und vielfältigen Phrasen aus anderen Vogelgesängen und unterschiedlichen Umgebungslauten.[11]
Verbreitung und Lebensraum
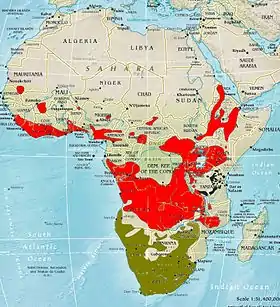
rot: Nördlicher Fiskalwürger
grün: Südlicher Fiskalwürger
dunkelblau: Reichenowwürger[12][13]


Der Südliche Fiskalwürger bewohnt bis auf den äußersten Nordosten des Landes geeignete Habitate in der Republik Südafrika, fast ganz Eswatini und Lesotho, den äußersten Süden von Mosambik, mit Ausnahme des Nordwestens und Südostens große Teile Simbabwes, den Süden und in Verbreitungsinseln aufgesplittert den Norden von Botswana, den äußersten Süden Angolas und bis auf den Nordosten und den Großteil der Wüstengebiete ganz Namibia. Davon isoliert kommt die Unterart L. c. marwitzi in mehreren Verbreitungsinseln in den Bergregionen des südwestlichen, zentralen und nordöstlichen Tansanias vor. In der zentralen Kalahari brütet die Art nicht und auch im Krüger-Nationalpark ist der Südliche Fiskalwürger selten.
Die Verbreitungsgebiete der Nord- und der Südgruppe kommen einander in einigen Regionen nahe, überlappen jedoch nur nördlich des Malawisees, wo L. humeralis capelli und L. collaris marwitzi zwar in derselben Region, räumlich aber weitgehend getrennt, sympatrisch vorkommen. Es wurden offenbar Hybride beobachtet, doch sind die Informationen darüber widersprüchlich.[8][14][15]
In diesem sowohl topographisch als auch klimatisch heterogenen Verbreitungsgebiet vermag die Art eine Vielzahl unterschiedlicher Habitate zu nutzen und zeigt eine starke Bereitschaft, vom Menschen veränderte Landschaften zu besiedeln. Seit den frühen 1900er Jahren ist sie in vielen Regionen häufiger geworden.[3] Sie ist im südlichen Afrika die mit Abstand häufigste Würgerart.[16]
Der Südliche Fiskalwürger kommt in Halbwüsten, mit Akazien bestandenen Savannen, im extensiv für Herdeviehhaltung verwendeten Grasland der östlichen Höhenlagen, im küstennahen Buschland und buschbestandenen Rändern von Marschen vor und besiedelt in unterschiedlicher Dichte die verschiedenen Landschaftstypen des südafrikanischen Velds. Er ist am Rande landwirtschaftlich genutzter Flächen, in größeren Gärten, Parks und auf Golfplätzen sowie am Rande von Plantagen regional ein häufiger Brutvogel. Wüsten meidet die Art weitgehend, kann aber in geringer Dichte nebelfeuchte Vegetationsinseln in der Namib besiedeln.[17] Auch in reinen Waldgebieten kommt L. collaris nicht vor, ebenso wie in Galeriewäldern entlang größerer Flüsse. Reine Grassavannen werden nur in den Randgebieten und kurzzeitig nach ausgedehnten Grasbränden besiedelt,[17] wenn vom Menschen geschaffene Strukturen Ansitzwarten zur Verfügung stellen. Dort, wo andere Würger wie der Gelbschnabelwürger oder der Bokmakiri, beziehungsweise europäische Migranten (Schwarzstirnwürger, Neuntöter) häufig sind, weicht L. collaris meist aus. Dies ist wahrscheinlich mit ein Grund, weshalb der Südliche Fiskalwürger in der Kalahari nicht vorkommt.[3]
Die vertikale Verbreitung reicht von küstennahen Regionen nahe dem Meeresniveau bis in Hochlagen von an die 3000 Metern.[3] Die höchstgelegenen Brutplätze liegen in den Drakensbergen und in den Gebirgslagen Tansanias.
Wichtige Requisiten eines geeigneten Territoriums sind neben einem ausreichenden Nahrungsangebot, Ansitze auf Bäumen, Büschen, Termitenhügeln, Weidezäunen oder Telegraphenmasten und eine kurze, oder fehlende Bodenvegetation, um geeignete Beutetiere erspähen zu können.
Die Paare behaupten meist das gesamte Jahr über ein Territorium. In landwirtschaftlich genutzten sowie in urbanen Gebieten lag die durchschnittliche Reviergröße meist bei einem Hektar.[18] In einem optimalen Habitat auf einem Universitätscampus in Lesotho wurden etwa 4 Paarreviere auf 10 Hektar festgestellt.[19] In Habitaten mit geringerer Bonität in größeren Höhenlagen und geringer Dichte an Ansitzen waren die Territorien mit bis zu 24 Hektar bedeutend größer. Wesentliche Variable, die neben dem Nahrungsangebot die Reviergröße bestimmen, sind Anzahl und Höhe der verfügbaren Ansitze, die Niederschlagsmenge, die Höhenlage, das Fehlen oder die Anwesenheit von Nahrungskonkurrenten, sowie die Körpermasse des Revierinhabers.[20] Der geringste gemessene Abstand zwischen zwei Nestern betrug 17 Meter, ist aber in den allermeisten Fällen um ein Vielfaches größer.[21]
Biologische Details
Die Mehrzahl der Forschungsarbeiten zum Lanius collaris–Komplex betrifft die südlichen Unterarten. Vor allem seit 2000 wurden eine Reihe von Studien publiziert, die viele Fragestellungen zur Biologie der Art behandeln. Viele der Ergebnisse waren bei Drucklegung der beiden Standardwerke über Würger von Tony Harris und Kim Franklin[22] bzw. von Norbert Lefranc und Tim Worfolk[23] noch nicht verfügbar. Panov, dem diese Arbeiten zum Teil schon vorlagen, beschäftigt sich nur am Rande mit den afrikanischen Würgerarten.[21] Der Nördliche- und der Südliche Fiskalwürger sind einander sowohl im Verhalten als auch morphologisch sehr ähnlich; viele der hier für die südliche Art wiedergegebenen Forschungsergebnisse treffen auch auf die nördliche Art zu.
Nahrung und Nahrungserwerb
L. collaris ist ein opportunistischer Jäger, der allen Beutetieren nachstellt, die er überwältigen kann. Seine Nahrung besteht vor allem aus Insekten und anderen Wirbellosen sowie zu einem weitaus geringeren Teil aus Wirbeltieren. Ob regelmäßig auch vegetarische Nahrung aufgenommen wird, ist nicht gesichert, doch wurden auf Spießplätzen auch aufgespießte Feigen festgestellt.[11] Die Zusammensetzung der Beutetiere variiert saisonal, und hängt stark von der Körpergröße und der Körpermasse des Würgers ab. Die größeren und schwereren Würger der Hochlagen erbeuten bedeutend mehr Wirbeltiere als die leichteren Individuen in den Niederungen. Die Größe der meisten Beutetiere liegt bei etwa zwei–dreifacher Schnabellänge (etwa 2 −5 Zentimeter),[24] doch vermag die Art auch bedeutend größere Tiere zu schlagen. Quantitativ kann die Wirbeltierbeute bis zu rund 10 % betragen, in Bezug auf die erbeutete Biomasse ist ihr Anteil jedoch wesentlich höher.[25] Gelegentlich verzehren Südliche Fiskalwürger auch Reste menschlicher Nahrung und Aas.[11]

Unter den Insekten dominieren Vertreter der Hautflügler, der Käfer, und der Heuschrecken. Weniger häufig werden Echte Grillen und Maulwurfsgrillen, Schmetterlinge und Schmetterlingsraupen, Libellen, Ameisen und Termiten erbeutet. Bei einem Massenauftreten von Heuschrecken oder Termiten können diese temporär zur Hauptnahrungsquelle werden. Populationen in niedriger gelegenen und feuchteren Gebieten erbeuten vor allem in den Sommermonaten eine nicht unbeträchtliche Menge an Ringelwürmern und Tausendfüßern. Nicht ins Gewicht fallen gelegentlich erbeutete Spinnen, Zecken, Schnecken und Krabben. Wirbeltiere wie kleine Singvögel und ihre Nestlinge, kleine Nagetiere, Eidechsen, junge Schlangen sowie Frösche spielen zahlenmäßig keine große Rolle, sind aber aufgrund der gegenüber Insektennahrung bedeutend höheren Energieausbeute vor allem in den Wintermonaten eine sehr wichtige Nahrungsquelle. Nur die großen Würger der Hochlandgebiete erbeuten regelmäßig Wirbeltiere.[26]
.jpg.webp)
Wie die meisten anderen Würgerarten auch ist der Südliche Fiskalwürger ein Ansitzjäger. Fast 90 % seiner Nahrung gewinnt er mit dieser effektiven und energiesparenden Jagdmethode. Als Ansitz kann alles dienen, was die Oberfläche um zumindest einen Meter überragt. Meist sind dies Bäume oder Büsche, Termitenhügel, Telegraphenmasten, Stromleitungen, Lichtmasten, Weidezäune, aber auch Weide- und Wildtiere. Die bevorzugte Höhe hängt von der Höhe der Bodenvegetation ab; je höher diese ist, desto höher müssen auch die Ansitze sein. Bei fehlender oder niedriger Vegetation liegen die Ansitzhöhen um die 4 Meter, in Gebieten mit höherem Grasbewuchs bei 10 Metern und darüber. Mit der Höhe des Ansitzes erweitert sich auch der Radius der effektiven Jagddistanz. Bei niedrigen Warten ist der Jagderfolg innerhalb von etwa 10 Metern am größten, bei höheren erweitert sich diese optimale Distanz auf bis zu 15 Meter.[27][28]
Erspäht der Würger ein Beutetier, gleitet er vom Ansitz und schlägt es am Boden. Kleine Tiere werden sofort gefressen, größere im Schnabel oder nach Falkenart mit den Krallen zum Ansitz gebracht und dort zerteilt. Bei Nahrungsüberschuss werden Beutetiere in Dornbüschen oder auf Stacheldraht aufgespießt, doch wird dieses Verhalten vom Südlichen Fiskalwürger nicht in dem Maße praktiziert wie von einigen Würgerarten der Nördlichen Hemisphäre. Vor allem größere Beutetiere, insbesondere Wirbeltiere und Würmer werden gelegentlich aufgespießt.[29] Die Effektivität der Attacken ist hoch: Etwa 45–80 % der Angriffsflüge ist erfolgreich.[28][30]
Neben dieser Hauptjagdmethode fängt der Südliche Fiskalwürger Fluginsekten in der Luft. Obwohl energieaufwändig, kann die Flugjagd bei schwärmenden Termiten kurzzeitig zur vorherrschenden Jagdart werden. Gelegentlich sammelt L. collaris Beutetiere auch direkt von Substratoberflächen (Baumstämmen, Ästen, Blättern) ab.[28][31]
Verhalten
Wie alle Vertreter der Gattung ist auch L. collaris tagaktiv. Seine Aktivitätsphase beginnt etwa eine Stunde nach Tagesanbruch und endet mit Beginn der Dämmerung, außerhalb der Brutzeit auch schon früher. Die heißesten Stunden des Tages verbringt er rastend oder mit Gefiederpflege beschäftigt im Schatten und der Deckung eines Baumes oder Busches. Außerhalb der Brutperiode wird die meiste Zeit zur Nahrungssuche, für Rast und andere Komfortverhalten (Gefiederpflege, Sonnenbaden, Staub- und Wasserbaden) und zur Behauptung des Reviers aufgewendet. In der Balz- und Brutzeit nehmen mit der Paarbildung, der Brut und der Jungenfürsorge assoziierte Aktivitäten, sowie verstärkt für agonistische Handlungen zusätzlich Zeit ein, sodass die Rastperioden, die Ruhezeiten insgesamt sowie Zeitaufwendungen für Komforthandlungen wesentlich verkürzt werden. Während der Brutzeit selbst und in den ersten Tagen der Nestlingszeit ist das Weibchen weitgehend mit dem Brüten und Hudern der Küken beschäftigt, während das Zeitbudget des Männchens mit der Nahrungsbeschaffung für sich selbst, das Weibchen und die Jungen sowie der Reviererhaltung zur Gänze ausgefüllt ist.[32]
Die Art ist in hohem Maße territorial. Meist besetzen die Männchen Territorien, die zur Brutzeit zu Paarterritorien werden und oft über mehrere Brutsaisonen hinweg Bestand haben. Diese Territorien werden von beiden Partnern, insbesondere aber vom Männchen gegenüber Artgenossen, anderen Würgerarten sowie gegenüber Nahrungskonkurrenten und potentiellen Brutparasiten verteidigt. Zu den Verhaltensweisen, die der Abgrenzung und Behauptung des Reviers zuzuordnen sind, zählen aufrechtes Sitzen an exponierten Stellen an den Reviergrenzen, meist begleitet von tschär-tschjät–Rufreihen, Überfliegen des Reviers in einem langsamen, auffälligen Flatterflug, Drohen mit gesträubten Federn und leicht gespreizten Flügeln, das bei größerer Aggression in die Buckelstellung mit Schnabeldrohen und Schnabelknappen übergeht. Verfolgungsflüge und im äußersten Fall auch physische Attacken stellen die letzte Stufe der Aggressionshandlungen dar, wobei tatsächliche Berührungskämpfe nur sehr selten beobachtet wurden.[3] Die außerbrutzeitliche Territorialität unverpaarter Weibchen ist unklar. Offenbar streichen sie umher und halten nur kurzzeitig Nahrungsreviere.[3]
Brutbiologie
In der Republik Südafrika wurden bis auf Februar in allen Monaten des Jahres frische Bruten festgestellt. Die Hauptbrutzeiten liegen jedoch in den regenreicheren und damit auch nahrungsreicheren Monaten und zwar zwischen Juni und Januar in Simbabwe, in den westlichen Teilen der Republik Südafrika im Mai sowie zwischen Juli und Dezember, beziehungsweise im April und zwischen Juni und Januar im Osten des Landes. In den übrigen Verbreitungsgebieten beginnt die Hauptbrutzeit mit Einsetzen der Hauptregenzeit.[17] Balz und Nestbau der Unterart L. c. marwitzi wurden im Dezember festgestellt. Zwei Jahresbruten sind die Regel, manche Paare brüten auch dreimal im Jahr.[33] Gelegentlich wurden auch Schachtelbruten beobachtet.[3]
Die Paarbildung vollzieht sich sehr schnell. Wenn ein Männchen ein unverpaartes Weibchen in seinem Territorium erblickt, äußert es tschüö–tschjüt–Rufe auf die ein aufgeregter, zwitschernder Gesang (oft von Flügelschlagen und Schwanzspreizen begleitet) folgt. Das Weibchen antwortet mit leisen Kontaktrufen. Wenn das Weibchen sich weiter nähert, beginnt das Männchen sofort nach Beute zu suchen. Den Futterübergaben folgen Revier- und Verfolgungsflüge, Zeigen eines Neststandortes und ritualisiertes Nestmulden und danach sehr bald die ersten Kopulationen.[33][34] Die meisten Paare bleiben die gesamte Brutsaison über zusammen, manche auch über mehrere Jahre. Partnerwechsel innerhalb einer Brutperiode kommt aber ebenfalls vor.[8] Das Nest liegt meist in Büschen oder Bäumen in Höhen zwischen 0,6 und 6 Metern. Als Nestträger kommt eine Vielzahl von Baum- und Buscharten in Frage. Den endgültigen Neststandort scheint das Weibchen zu bestimmen, das auch etwas stärker am Nestbau beteiligt ist als das Männchen. Das Nest ist ein recht umfangreicher offener Napf aus trockenen Gräsern und Zweigen, außen häufig mit Blättern, Löwenzahn–Fruchtständen und anderen Pflanzen oder auch künstlichen Materialien getarnt. Die Nester stehen zum Teil recht offen.[35]

Die Gelege bestehen aus 3–4 cremefarbenen oder beigen, vor allem um die Mitte ringförmig bräunlich oder olivgrün gefleckten Eiern. Sie werden im Tagesabstand gelegt und ausschließlich vom Weibchen ab dem vorletzten Ei bebrütet oder beschattet. In dieser Zeit und in den ersten Tagen nach dem Schlupf füttert das Männchen Weibchen und Küken allein. Das Weibchen verlässt jedoch auch gelegentlich das Nest, um selbst nach Nahrung zu suchen. Die Jungen schlüpfen nach 17 Tagen nackt und blind. Der Schlupf des gesamten Geleges erfolgt innerhalb eines oder zweier Tage. Die Küken werden in den ersten Tagen vom Weibchen gehudert und vom Männchen mit Nahrung versorgt, danach füttern beide Elternteile. Nach 15 Tagen sind die Jungen zur Gänze befiedert und verlassen kurz danach das Nest. Die nächsten drei Monaten versorgen die Eltern sie in abnehmender Intensität mit Nahrung, auch dann, wenn sie bereits eine zweite Brut begonnen haben. Mit Beginn der Mauser ins Erwachsenengefieder werden die Jungen aus dem Elternrevier vertrieben.[36][37]
Zum Bruterfolg existieren nur wenige, kleine Untersuchungen. Er scheint zwar etwas höher zu sein als bei Lanius humeralis, ist mit deutlich unter 30 % jedoch noch immer sehr niedrig. Bei erfolgreichen Bruten wurden durchschnittlich zwei Junge flügge. Minimiert wird der Bruterfolg durch ungünstige Witterung, vor allem aber durch Prädation. Eine Vielzahl von Nesträubern bedroht Gelege und Nestlinge, während Brutparasitismus durch Kuckucke und andere parasitierende Vogelarten nur eine untergeordnete Rolle spielt.[33][38]
Systematik
2011 veröffentlichten Jérôme Fuchs et al. im Journal of Biogeography eine Studie,[4] die auf molekulargenetischer Basis das bestätigte, was auf Grund verhaltensbiologischer und morphologischer Erkenntnisse schon lange Zeit vermutet wurde,[39] nämlich, dass im Lanius collaris–Artenkreis mehrere Arten involviert sind. Diesen Forschungsergebnissen folgend, trennte das IOC den Komplex in zwei Arten: Eine nördliche Gruppe mit Lanius humeralis als nominotypisches Taxon und eine südliche, mit Lanius collaris als Nominatform.[40]
Die Südgruppe mit 5 (4) Unterarten ist trotz zum Teil deutlicher morphologischer Unterschiede genetisch homogen. In den Randgebieten der Verbreitungszonen der einzelnen Unterarten (mit Ausnahme von L. c. marwitzi) kommt es häufig zu Mischbruten, die Nachkommen mit den Gefiedermerkmalen beider Elternteile hervorbringen.[41]
- Lanius c. collaris Linnaeus, 1766: Südnamibia, Süd-, Zentral- und Ostsüdafrika, Eswatini, Lesotho und Provinz Maputo im Süden Mosambiks – oben beschrieben.
- Lanius c. pyrrhostictus Holub & Pelzeln 1882 : Äußerster NO Botswanas, südliches Simbabwe, Provinz Limpopo und Mpumalanga in der Republik Südafrika und Provinz Gaza und Mosambik. Sehr ähnlich L. c. collaris – insgesamt gesättigtere Farben auf der Oberseite; Schwanz etwas kürzer und breiter. Unterseite matt weiß. Deutliche rostbraune Flanken bei den Weibchen.
- Lanius c. marwitzi Reichenow, 1901: Wird gelegentlich mit dem Namen Reichenowwürger als eigenständige Art aufgefasst.[14][15] Bergregionen Tansanias. Auffälliger weißer, relativ schmaler Überaugenstreif, der vom Schnabelansatz bis hinter die Ohrdecken reicht. Fast rein schwarze Oberseite, grauer Bürzel. Äußere Schwanzfedern weiß, nach innen hin abnehmender Weißanteil, Mittelpaar schwarz. Weibchen ohne rötlichbraune Flanken.[14]
- Lanius c. subcoronatus Smith, 1841: Südlichstes Angola, Namibia, Botswana, südwestliches Simbabwe und Nordteil der Republik Südafrika. Deutlicher, etwas breiterer Überaugenstreif als L. c. marwitzi – sonst wie die Nominatform.
- Lanius c. aridicolus Clancey, 1955: Nebelfeuchte Vegetationsinseln und Oasen in der Namib. Etwas kleiner und matter gefärbt als L. c. subcoronatus, von diesem kaum unterscheidbar und meist als conspezifisch aufgefasst.
Weitere Unterarten wie L. c. predator und L. c. vigilans werden nicht allgemein anerkannt.[8][17]
Bestand und Bedrohung
Die Art ist vor allem in Südafrika sehr gut untersucht. Sie ist die mit Abstand häufigste Würgerart des Landes, deren Bestand vor allem in von Menschen gestalteten Lebensräumen zunimmt. Außerhalb solcher Lebensräume ist sie weit verbreitet.[3][17] Sie konnte in den letzten Jahrzehnten ihren Lebensraum wesentlich erweitern. Aufgrund ihres sehr großen Verbreitungsgebietes, des stabilen, beziehungsweise zunehmenden Brutbestandes und des Fehlens aktueller Bedrohungen stuft die IUCN den Gesamtbestand von Lanius collaris mit ![]() (=least concern – nicht gefährdet) ein.
(=least concern – nicht gefährdet) ein.
Die erheblichen natürlichen Verluste durch Wettereinflüsse, Kollisionen mit Fahrzeugen und durch natürliche Feinde (vor allem verschiedene Greifvögel und Eulen, Krähen und andere Würger, sowie durch Schlangen, Hauskatzen, Schleichkatzen und Affen, in geringerem Maße infolge von Brutverlusten durch Brutparasitismus durch verschiedene Kuckucksarten),[17] können durch Mehrfachbruten gut kompensiert werden. Direkte Verfolgung durch Menschen spielt bisher keine bestandslimitierende Rolle, doch könnte sich der zunehmende Einsatz von Insektiziden langfristig negativ auf den Bestand auswirken.[42]
Literatur
- Tony Harris, Kim Franklin: Shrikes & Bush-Shrikes. Including wood-shrikes, helmet-shrikes, flycather-shrikes, philentomas, batises and wattle-eyes. Christopher Helm, London 2000, ISBN 0-7136-3861-3.
- Norbert Lefranc, Tim Worfolk: Shrikes. A Guide to the Shrikes of the World. Pica Press, 1997, ISBN 1-4081-3505-1.
- Reuven Yosef & International Shrike Working Group (2016). Common Fiscal (Lanius collaris). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (heruntergeladen von http://www.hbw.com/node/60490 am 9. Juli 2016)
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, ISBN 978-954-642-576-8.
Weblinks
Einzelnachweise
- Jérôme Fuchs, Timothy M. Crowe und Rauri C. K. Bowie: Phylogeography of the fiscal shrike (Lanius collaris): a novel pattern of genetic structure across the arid zones and savannas of Africa. In: Journal of Biogeography (J. Biogeogr.) (2011). S. 12–13
- Atlas of Southern African Birds
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 174.
- Jérôme Fuchs, Timothy M. Crowe und Rauri C. K. Bowie: Phylogeography of the fiscal shrike (Lanius collaris): a novel pattern of genetic structure across the arid zones and savannas of Africa. In: Journal of Biogeography (J. Biogeogr.) (2011). S. 1–13
- BirdLife International. 2012. Lanius collaris. The IUCN Red List of Threatened Species 2012: e.T22705074A39383043. doi:10.2305/IUCN.UK.2012-1.RLTS.T22705074A39383043.en
- S. Soobramoney, C.T. Downs und N.J. Adams: Morphological variation in the Common Fiscal Lanius collaris along an altitudinal gradient in southern Africa. In: Ostrich 2005, 76(3&4); 130–141; S. 135
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 176–177.
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 173.
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 173–174.
- Aufnahmen bei xeno-canto
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 175.
- Anm. Verfasser: Der von einigen Autoren als eigenständige Art aufgefasste Reichenowwürger zeigt nur eine sehr geringe genetische Differenz zu Lanius collaris, ist also dessen Unterart.
- Jérôme Fuchs, Timothy M. Crowe und Rauri C. K. Bowie: Phylogeography of the fiscal shrike (Lanius collaris): a novel pattern of genetic structure across the arid zones and savannas of Africa. In: Journal of Biogeography (J. Biogeogr.) (2011). S. 9–10
- Reuven Yosef & International Shrike Working Group (2016). Uhehe Fiscal (Lanius marwitzi). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (heruntergeladen von http://www.hbw.com/node/60492 am 11. Juli 2016).
- Jérôme Fuchs, Timothy M. Crowe und Rauri C. K. Bowie: Phylogeography of the fiscal shrike (Lanius collaris): a novel pattern of genetic structure across the arid zones and savannas of Africa. In: Journal of Biogeography (J. Biogeogr.) (2011). S. 9
- S. Soobramoney, C.T. Downs und N.J. Adams: Territorial behaviour and time budgets of the fiscal shrike Lanius collaris along an altitudinal gradient in South Africa. In: African Zoology Vol. 39, No. 1, April 2004. S. 137
- Reuven Yosef & International Shrike Working Group (2016). Common Fiscal (Lanius collaris). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (heruntergeladen von http://www.hbw.com/node/60490 am 11. Juli 2016).
- S. Soobramoney, C.T. Downs und N.J. Adams: Territorial behaviour and time budgets of the fiscal shrike Lanius collaris along an altitudinal gradient in South Africa. In: African Zoology 39(1); (April 2004); S. 138
- Grzegorz Kopij: Breeding-season density of Fiscal Shrike (Lanius collaris) in Lesotho. In: Biological Lett. 2004, 41(2); S. 77–85
- S. Soobramoney, C.T. Downs und N.J. Adams: Territorial behaviour and time budgets of the fiscal shrike Lanius collaris along an altitudinal gradient in South Africa. In: African Zoology 39(1); (April 2004); S. 137–142
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 198.
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000.
- N. Lefranc und Tim Worfolk: Shrikes. A Guide to the Shrikes... 1997
- Claire Louise Devereaux: Ecological factors influencing the reproductive Ecology, Territoriality and Foraging Behaviour of Fiscal Shrikes. Thesis submitted in fulfilment of the requirements for the degree of Master of Science, in the Department of Biology, University of Natal. (1999) 179 Seiten. S. 136
- S. Soobramoney, C.T. Downs und N.J. Adams: Variability in foraging behaviour and prey of the Common Fiscal Shrike, Lanius collaris, along an altitudinal gradient in South Africa. In: Ostrich 2004, 75(3): 133–140; S. 136
- S. Soobramoney, C.T. Downs und N.J. Adams: Variability in foraging behaviour and prey of the Common Fiscal Shrike, Lanius collaris, along an altitudinal gradient in South Africa. In: Ostrich 2004, 75(3): 133–140; S. 135–136
- S. Soobramoney, C.T. Downs und N.J. Adams: Variability in foraging behaviour and prey of the Common Fiscal Shrike, Lanius collaris, along an altitudinal gradient in South Africa. In: Ostrich 2004, 75(3): 133–140; S. 134–137
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 174–175.
- Claire Louise Devereaux: Ecological factors influencing the reproductive Ecology, Territoriality and Foraging Behaviour of Fiscal Shrikes. Thesis submitted in fulfilment of the requirements for the degree of Master of Science, in the Department of Biology, University of Natal. (1999) 179 Seiten. S. 150
- S. Soobramoney, C.T. Downs und N.J. Adams: Variability in foraging behaviour and prey of the Common Fiscal Shrike, Lanius collaris, along an altitudinal gradient in South Africa. In: Ostrich 2004, 75(3): 133–140; S. 135–139
- S. Soobramoney, C.T. Downs und N.J. Adams: Variability in foraging behaviour and prey of the Common Fiscal Shrike, Lanius collaris, along an altitudinal gradient in South Africa. In: Ostrich 2004, 75(3): 133–140; S. 137
- S. Soobramoney, C.T. Downs und N.J. Adams: Territorial behaviour and time budgets of the fiscal shrike Lanius collaris along an altitudinal gradient in South Africa. In: African Zoology 39(1); (April 2004); S. 140
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 176.
- Claire Louise Devereaux: Ecological factors influencing the reproductive Ecology, Territoriality and Foraging Behaviour of Fiscal Shrikes. Thesis submitted in fulfilment of the requirements for the degree of Master of Science, in the Department of Biology, University of Natal. (1999) 179 Seiten.
- Claire Louise Devereaux: Ecological factors influencing the reproductive Ecology, Territoriality and Foraging Behaviour of Fiscal Shrikes. Thesis submitted in fulfilment of the requirements for the degree of Master of Science, in the Department of Biology, University of Natal. (1999) 179 Seiten. S. 42–49
- Claire Louise Devereaux: Ecological factors influencing the reproductive Ecology, Territoriality and Foraging Behaviour of Fiscal Shrikes. Thesis submitted in fulfilment of the requirements for the degree of Master of Science, in the Department of Biology, University of Natal. (1999) 179 Seiten. S. 51–65
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 175–176.
- Claire Louise Devereaux: Ecological factors influencing the reproductive Ecology, Territoriality and Foraging Behaviour of Fiscal Shrikes. Thesis submitted in fulfilment of the requirements for the degree of Master of Science, in the Department of Biology, University of Natal. (1999) 179 Seiten. S. 65–67
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 225.
- World Birdnames IOC 6.2
- Grzegorz Kopij: Breeding-season density of Fiscal Shrike (Lanius collaris) in Lesotho. In: Biological Lett. 2004, 41(2); S. 82–83
- L.P. Quinn, B,J. de Vos, M. Fernandes-Whaley, C. Roos, H. Bouwman, H. Kylin, R. Pieters und J. van den Berg: Pesticide Use in South Africa: One of the Largest Importers of Pesticides in Africa pdf engl.