Parikh-Doering-Oxidation
Die Parikh-Doering-Oxidation ist eine Namensreaktion in der organischen Chemie, die nach ihren Entdeckern Jekishan R. Parikh und William v. E. Doering benannt wurde.
Mit der Parikh-Doering-Oxidation werden primäre und sekundäre Alkohole in Aldehyde beziehungsweise Ketone überführt. Hierbei wird wie bei der Swern-Oxidation aktiviertes Dimethylsulfoxid (DMSO) als Oxidationsmittel eingesetzt. Zur Aktivierung dient jedoch ein Addukt aus Schwefeltrioxid und Pyridin in Anwesenheit von Triethylamin.[1]
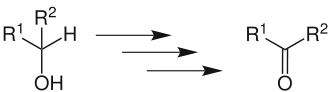
Die Reaktion kann unter milden Bedingungen, für gewöhnlich bei 0 °C, durchgeführt werden.[2]
Reaktionsmechanismus
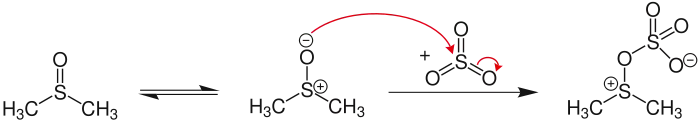
Im ersten Schritt wird das Dimethylsulfoxid (DMSO) mittels Schwefeltrioxid aktiviert.
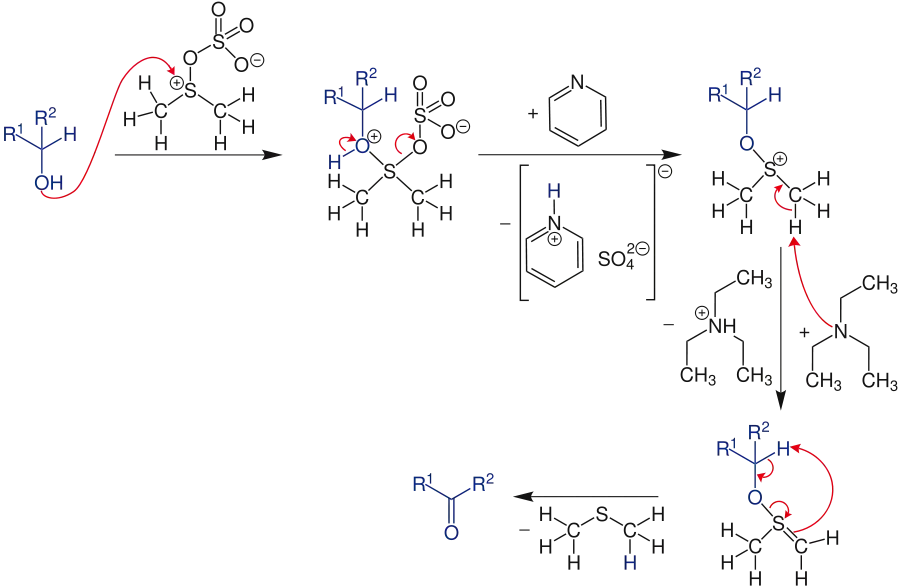
Das aktivierte DMSO wird durch den Alkohol nucleophil angegriffen. Das so entstandene Zwischenprodukt wird nun durch Pyridin deprotoniert. Zusätzlich wird durch eine Umlagerung Sulfat abgespalten, welches in einem Komplex mit dem Pyridinium abgetrennt wird. Anschließend wird das Alkoxysulfoniumion durch Triethylamin zum Sulfonium-Ylid deprotoniert. Die nun folgende β-Eliminierung über einen cyclischen Übergangszustand führt zur Abspaltung von Dimethylsulfid, sodass das Endprodukt, das Keton oder Aldehyd, entsteht.
Siehe auch
Einzelnachweise
- G. Tojo, M. Fernández: Oxidation of alcohols to aldehydes and ketones, 2. Auflage, S. 125, Springer Verlag, Berlin, ISBN 0-387-23607-4.
- J. R. Parikh and W. v. E. Doering: Sulfur Trioxide in the Oxidation of Alcohols by Dimethyl Sulfoxide, in: J. Am. Chem. Soc. 1967, 89, 5505–5507; doi:10.1021/ja00997a067.
Literatur
- Organic Syntheses Based on Name Reactions, A.Hassner & I.Namboothiri, 3. Auflage, Elsevier
- Oxidation of Alcohols to Aldehydes and Ketones, Gabriel Tojo and Marcos Fernandez, 2006, Springer Science+Business Media, Inc.