Swern-Oxidation
Bei der Swern-Oxidation handelt es sich um eine Namensreaktion in der organischen Chemie, die nach ihrem Entdecker, dem amerikanischen Chemiker Daniel Swern (1916–1982), benannt wurde. Die Reaktion ist eine milde Oxidation von primären oder sekundären Alkoholen zu Aldehyden bzw. Ketonen mit Dimethylsulfoxid, Oxalylchlorid und Triethylamin.[1][2][3] Ein Vorteil der Swern-Oxidation gegenüber Reaktionen mit Chrom-Reagenzien ist die geringere Toxizität der Reagenzien. Es ist von essentieller Bedeutung, dass die Reaktionstemperatur deutlich unter Raumtemperatur bleibt, da das in situ gebildete Reagenz sich bei höheren Temperaturen sehr schnell zersetzt. Eine Temperatur von −40 °C ist für die Reaktion ausreichend niedrig. Auch ist die weitere Oxidation zu Carbonsäuren in der Swern-Oxidation unmöglich. Nachteilig ist vor allem der sehr unangenehme Geruch des bei der Reaktion gebildeten Dimethylsulfids.
Übersichtsreaktion
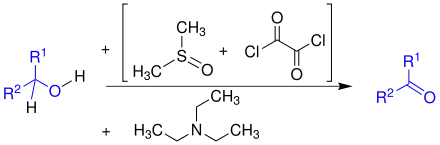
Bei der Swern-Oxidation handelt es sich um eine Oxidation von Alkoholen zu Ketonen oder Aldehyden. Als Oxidationsmittel wird aktiviertes Dimethylsulfoxid verwendet, zur Aktivierung Oxalylchlorid und als Base Triethylamin.
Mechanismus
Im ersten Schritt wird nach einem nucleophilen Angriff des Dimethylsulfoxids (DMSO) an das Oxalylchlorid und nach Abspaltung von Kohlendioxid, Kohlenmonoxid und Chlorid die aktive Zwischenstufe, das Sulfonium-Ion, gebildet.
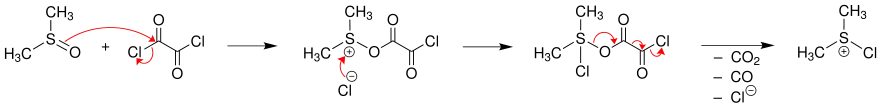
Beide Sulfonium-Ionen, die in dieser Reaktion vorkommen, sind Formen des aktivierten Dimethylsulfoxids und bilden mit einem Alkohol dasselbe Sulfoniumsalz.[4] Nach der Zugabe eines Alkohols greift dieser das Sulfonium-Ion nucleophil an. Mit der ersten Form des Sulfonium-Ions werden somit Kohlendioxid, Kohlenmonoxid und Chlorid verdrängt und mit der zweiten Form wird Chlorid abgespalten.

Die Base Triethylamin deprotoniert schließlich das Sulfonium-Ion und unter Abspaltung von Dimethylsulfid wird der Aldehyd (wenn R1 = H oder R2 = H) oder das Keton gebildet.

Einzelnachweise
- K. Omura, D. Swern: Oxidation of alcohols by „activated“ dimethyl sulfoxide. A preparative, steric and mechanistic study. In: Tetrahedron. 34, 1978, S. 1651, doi:10.1016/0040-4020(78)80197-5.
- A. J. Mancuso, D. S. Brownfain, D. Swern: Structure of the dimethyl sulfoxide-oxalyl chloride reaction product. Oxidation of heteroaromatic and diverse alcohols to carbonyl compounds. In: J. Org. Chem. 44, 1979, S. 4148–4150, doi:10.1021/jo01337a028.
- A. J. Mancuso, S.-L. Huang, D. Swern: Oxidation of long-chain and related alcohols to carbonyls by dimethyl sulfoxide „activated“ by oxalyl chloride. In: J. Org. Chem. 43, 1978, S. 2480–2482, doi:10.1021/jo00406a041.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 324–326.
Siehe auch
Weblinks
- organische-chemie.ch: Swern-Oxidation (Detaillierter Mechanismus)