Kopffüßer
Die zoologische Klasse der Kopffüßer (Cephalopoda, von altgriechisch κεφαλή kephalē „Kopf“ und ποδ- pod- „Fuß“) ist eine Tiergruppe, die zu den Weichtieren (Mollusca) gehört und nur im Meer vorkommt. Es gibt sowohl pelagische (freischwimmende) als auch benthische (am Boden lebende) Arten. Derzeit sind etwa 30.000 ausgestorbene und 1.000 heute lebende Arten bekannt.[1] Zu den Kopffüßern gehören die größten lebenden Weichtiere. Der größte bisher gefundene Riesenkalmar war 13 Meter lang. Die ausgestorbenen Ammoniten erreichten eine Gehäusegröße von bis zu zwei Metern.
| Kopffüßer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Roter Krake | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cephalopoda | ||||||||||||
| Cuvier, 1797 | ||||||||||||
| Unterklassen | ||||||||||||
|
Der Name „Cephalopoda“ wurde 1797 von Georges Cuvier eingeführt und ersetzte die ältere, von antiken Autoren wie Aristoteles und Plinius überlieferte Bezeichnung „Polypen“ (πολύπους polýpous „Vielfüßer“), die Réaumur 1742 auf die Nesseltiere übertragen hatte und die in der modernen Zoologie ausschließlich in dieser Bedeutung gebraucht wird.
Anatomie
Gliederung des Körpers
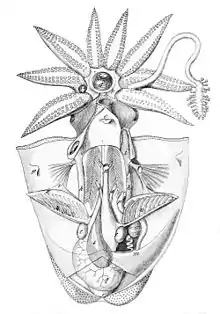
Kopffüßer besitzen einen Körper, der aus einem Rumpfteil (mit Eingeweidesack), einem Kopfteil mit anhängenden Armen und einem auf der Bauchseite gelegenen taschenförmigen Mantel besteht. Die Orientierung der Körpergliederung entspricht dabei nicht der bevorzugten Fortbewegungsrichtung. Der vordere Teil des Fußes ist bei Kopffüßern zum Trichter und zu acht, zehn oder über 90 Fangarmen (Tentakeln) entwickelt. Der Hohlraum des Mantels, die so genannte Mantelhöhle, birgt meist zwei (bei den Nautiloidea: vier) Kiemen und mündet durch ein Rohr (Hyponom oder Trichter genannt) nach außen. Der Mund ist von streckbaren Fangarmen (Tentakeln) umgeben. Am Mund befindet sich bei rezenten Arten ein papageienartiger Schnabel mit Ober- und Unterkiefer sowie eine Raspelzunge (Radula).
Schale, Hartteile und Auftriebskörper

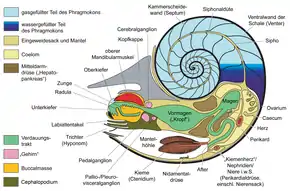
Die ursprünglicheren Arten, wie die Nautiloiden und die ausgestorbenen Ammoniten, sind außenschalig: Ein kalkiges Gehäuse aus Aragonit gibt ihnen als Außenskelett Schutz und Halt. Die Schale dieses Gehäuses ist dreischichtig. Unter dem äußeren Periostracum, dem Schalenhäutchen aus dem Glykoprotein Conchin, liegt die äußere Prismenschicht (Ostracum) aus prismatischem Aragonit. Die innere Schicht, das Hypostracum, besteht wie die Septen aus Perlmutt.
Die Gehäuse sind in die eigentliche Wohnkammer und einen Abschnitt mit gasgefüllten Kammern (Phragmokon) unterteilt. Mit Hilfe dieses gasgefüllten Teils kann das Gehäuse in der Wassersäule schwebend gehalten werden. Der heutige Nautilus (Perlboot) kann das Gehäuse aber nicht zum Auf- und Abstieg in der Wassersäule benutzen, da jeweils zu wenig Wasser in das Gehäuse hinein oder herausgepumpt werden kann (etwa fünf Gramm), sondern er bewegt sich mit Hilfe des Rückstoßprinzips des Trichters fort (auch senkrecht in der Wassersäule). Bei den ausgestorbenen Ammoniten wird neuerdings aber diskutiert, ob bei dieser Gruppe nicht doch ein Auf- und Abstieg in der Wassersäule durch Veränderung des Gas- bzw. Wasservolumens in den Kammern möglich war. Allerdings sind die Internstrukturen der Gehäuse von Nautiloidea und Ammonoidea auch sehr verschieden.
Die außenschaligen Kopffüßer sind nur noch durch die fünf oder sechs Arten der Gattung Nautilus repräsentiert. Eine Art wird von manchen Forschern auch als Vertreter einer eigenen Gattung (Allonautilus) aufgefasst. Aus dem Fossilbericht sind über 10.000 Arten von ausgestorbenen Nautiloideen (Perlboot-Artige) beschrieben worden. Die Zahl der ausgestorbenen Ammoniten ist bisher noch nicht exakt erfasst worden, dürfte jedoch in der Größenordnung von etwa 30.000–40.000 liegen.
Bei den innenschaligen Kopffüßern sind die Hartteile vom Mantel umschlossen:
- Die ausgestorbenen Belemniten haben die Wohnkammer sukzessive bis auf einen dorsalen Löffel oder Stab (Proostracum) reduziert.
- Spirula besitzt eine im Gegensatz zu Ammoniten und Nautilus in Richtung Bauch orientierte Spirale aus Kalk, die in einzelne gasgefüllte Kammern gegliedert ist.
- Die Sepien haben dazu noch die ursprünglichen Septen, die ursprünglich etwa senkrecht zur Längsachse des Gehäuses standen, stark schräg gestellt und zu einem Schulp umgebaut, der aber noch Auftriebsfunktion hat.
- Die Kalmare haben das ursprüngliche kalkige Gehäuse dagegen unter Verlust der Mineralisation und damit des Auftriebs zu einem hornigen, länglichen Streifen (Gladius) im Mantel reduziert, der den Körper nur noch stützt.
- Bei den Kraken ist das ehemalige Gehäuse bis auf knorpelähnliche Reliktstrukturen oder gar komplett reduziert.
Kalmare und Kraken haben zum Teil alternative Auftriebssysteme entwickelt (Ammoniak, ölige Substanzen etc.). In den heutigen Meeren dominieren die innenschaligen Kopffüßer (Coleoidea oder auch Dibranchiata).
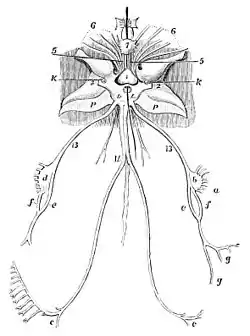
(historische Darstellung von 1876)
Nervensystem
Das Nervensystem der Cephalopoden ist das leistungsfähigste sowohl unter den Weichtieren als auch unter allen wirbellosen Tieren.[1] Dies gilt insbesondere für die modernen Kopffüßer (Coleoidea), bei denen die großen Nervenknoten (Cerebralganglien, Pedalganglien, Pleuralganglien) zu einer komplexen Struktur verschmolzen sind, die als Gehirn bezeichnet werden kann. Das Nervensystem der zehnarmigen Tintenfische (Decabrachia) zeichnet sich zudem durch Riesen-Axone aus, deren Übertragungsgeschwindigkeit an die Axone von Wirbeltieren heranreicht. Experimente mit abgetrennten Krakenarmen zeigten, dass die Arme über eigene, autonom agierende Nervenzentren verfügen, durch die bestimmte Reflexe, zum Beispiel bei der Nahrungssuche bzw. Jagd, unabhängig vom Gehirn ausgelöst werden können.[2] Die paarigen, seitlich am Kopf sitzenden Augen funktionieren bei den Nautiliden nach dem Lochkameraprinzip. Moderne Kopffüßer haben everse (mit lichtzugewandten Photorezeptoren in der Netzhaut ausgestattete) und ontogenetisch eingestülpte Linsenaugen analog zu den inversen (mit lichtabgewandten Photorezeptoren in der Netzhaut ausgestattete) und ontogenetisch ausgestülpten Linsenaugen der Wirbeltiere, was ein klassisches Beispiel für konvergente Evolution darstellt. Zur schnellen Verarbeitung der optischen Reize besitzt das Kopffüßergehirn große optische Loben.
Weiterhin besitzen Kopffüßer hochentwickelte Statozysten, die seitlich des Gehirns liegen und neben Gravitation und Beschleunigung auch relativ niedrigfrequenten Schall[3][4] wahrnehmen können.
Kopffüßer gelten als die intelligentesten wirbellosen Tiere.[5][6][7][8][9] Aus Verhaltensexperimenten geht hervor, dass die kognitiven Fähigkeiten von Kraken teilweise an die von Hunden heranreichen.[1][10][11] So sind sie zur Abstraktion (beispielsweise Zählen bis 4 oder Unterscheiden verschiedener Formen[1]) und zum Lösen komplexer Probleme (u. a. das Öffnen des Schraubverschlusses eines Glases, um an den Inhalt zu gelangen) in der Lage.
Physiologie
Fortbewegung
Als aktive Räuber verlassen sich Kopffüßer vor allem auf die Fortbewegung nach dem Rückstoßprinzip. Hierbei wird der Zwischenraum zwischen Kopf und Mantelwand, und dadurch auch das Volumen der Mantelhöhle, bei den meisten Vertretern durch das Zusammenziehen der Ringmuskeln des Mantels verringert. Infolge des entstehenden Überdruckes in der Mantelhöhle wird das Wasser durch den Trichter nach außen gezwungen, was bewirkt, dass sich der Körper in die entgegengesetzte Richtung bewegt. Durch Verändern der Stellung des Trichters kann die Fortbewegungsrichtung variiert werden. Die Seitenflossen dienen bei Kalmaren der Stabilisierung und bei Sepien, deren Seitenflossen einen großen Teil des Mantels säumen, dem „Schweben“ und Antrieb durch wellenartigen Flossenschlag. Oktopoden sind mit dem Meeresboden (Benthos) assoziiert und kriechen mit Hilfe ihrer Fangarme. Allerdings nutzen auch sie bei der Flucht den Rückstoßantrieb.
Blutkreislauf
Kopffüßer sind die einzigen Weichtiere, die ein geschlossenes Kreislaufsystem besitzen. Das Blut wird bei Coleoiden durch zwei Kiemenherzen, die an der Basis der Kiemen sitzen, zu den Kiemen gepumpt. Dies führt zu einem hohen Blutdruck und zu einem schnellen Fließen des Blutes und ist notwendig, um die relativ hohen Stoffwechselraten der Kopffüßer zu unterstützen. An den Kiemen erfolgt die Anreicherung des Blutes mit Sauerstoff. Das nun sauerstoffreiche Blut wird durch ein systemisches Herz zum Rest des Körpers gepumpt.
Atmung
Kiemen sind die primären Atmungsorgane der Kopffüßer. Eine große Kiemenoberfläche und ein sehr dünnes Gewebe (respiratorisches Epithel) der Kieme sorgen für einen effektiven Gasaustausch von sowohl Sauerstoff als auch Kohlenstoffdioxid. Da die Kiemen in der Mantelhöhle liegen, ist diese Art der Atmung an Bewegung gekoppelt. Bei Kalmaren und Oktopoden wurde ein wenn auch geringerer Teil der Atmung auf die Haut zurückgeführt.[12] Wie bei vielen Weichtieren erfolgt der Sauerstofftransport im Blut der Kopffüßer nicht durch eisenhaltige Hämoglobine (wie u. a. bei Wirbeltieren), sondern durch kupferhaltige Hämocyanine. Außerdem befinden sich Hämocyanine nicht in speziellen Zellen (wie Hämoglobine in roten Blutkörperchen), sondern liegen frei im Blutplasma vor. Sind Hämocyanine nicht mit Sauerstoff beladen, erscheinen sie durchsichtig und nehmen eine blaue Farbe an, wenn sie mit Sauerstoff binden.

Ernährung und Verdauung
Mit Ausnahme des detritusfressenden Vampirtintenfischs sind Kopffüßer aktive Räuber, die ausschließlich von tierischer Nahrung leben. Die Beute wird visuell wahrgenommen und mit den Tentakeln, welche mit Saugnäpfen ausgestattet sind, gegriffen. Bei Kalmaren sind diese Saugnäpfe mit kleinen Haken versehen. Sepien und Nautilus ernähren sich hauptsächlich von kleinen, auf dem Meeresboden lebenden Wirbellosen. Zur Beute der Kalmare gehören Fische und Garnelen, welche durch einen Biss in den Nacken paralysiert werden. Oktopoden sind nächtliche Jäger und stellen vor allem Schnecken, Krustentieren und Fischen nach. Zur wirksamen Tötung ihrer Beute besitzen Oktopoden ein lähmendes Gift, welches in die Beute injiziert wird. Nach ihrer Aufnahme mittels Papageienschnabel-artiger Kiefer (u. a. aus Chitin[13]) gelangt die Nahrung in den muskulären Verdauungstrakt. Die Nahrung wird durch peristaltische Bewegungen des Verdauungstraktes bewegt und hauptsächlich im Magen und im Blinddarm verdaut. Nach dem Passieren des Darms verlässt Unverdautes den Körper durch den Anus und gelangt beim Ausstoß des Wassers aus der Mantelhöhle durch den Trichter nach außen.

Fortpflanzung
Viele Kopffüßer verfügen über ein ausgeprägtes Sexualverhalten. Zumeist gibt das Männchen nach ausgiebigem Vorspiel seine in Spermatophoren verpackten Spermien mit einem Arm, dem Hectocotylus, in die Mantelhöhle des Weibchens. Bei Papierbooten jedoch löst sich der Hectocotylus vom Männchen und schwimmt aktiv, von chemischen Botenstoffen des Weibchens angezogen (Chemotaxis), in deren Mantelhöhle. Die Eizellen des Weibchens werden beim Austreten aus dem Eileiter befruchtet und können in Trauben (Sepien, Kraken), oder in Schläuchen (Kalmare), welche eine Vielzahl von Eiern enthalten, abgelegt werden. Das Weibchen legt voluminöse und extrem dotterreiche Eier. Während der Embryonalentwicklung ernährt sich der Embryo von der gespeicherten Energie im Dotter. Weibliche Oktopoden säubern die abgelegten Eier mit ihren Tentakeln und Wasserschüben.
Die Furchung während der Embryogenese erfolgt partiell-diskoidal und führt dazu, dass der sich entwickelnde Embryo um den Dotter wächst. Dabei wird ein Teil der Dottermasse nach innen verlagert (innerer Dottersack); ein oft größerer, mit dem inneren Dottersack verbundener Teil der Dottermasse (äußerer Dottersack) verbleibt außerhalb des Embryos. Der Schlupf erfolgt, nachdem oder auch bevor der äußere Dotter aufgebraucht wurde. Der innere Dotter dient als Nahrungsreserve für die Zeit zwischen dem Schlupf und der vollständigen Umstellung auf selbstständig erbeutete Nahrung. Nach dem Schlupf kümmern sich erwachsene Kopffüßer nicht um ihre Nachkommen.
Farbstoffe und Biolumineszenz
Kopffüßer besitzen besondere Hautzellen, die sogenannten Chromatophoren. Diese enthalten ein Pigment (Farbstoff) und sind von winzigen Muskeln umgeben, welche an diesen Hautzellen anhaften. Werden diese Muskeln angespannt, dehnt sich eine Chromatophorenzelle aus und ändert somit die Farbe an diesem Ort des Körpers. Das selektive Ausdehnen und Zusammenziehen von Chromatophoren ermöglicht die Veränderung der Farbe und des Musters der Haut. Dies spielt unter anderem bei Tarnung, Warnung und beim Paarungsverhalten eine wichtige Rolle. Beispielsweise lassen Sepien in Stresssituationen Farbstreifen wellenähnlich über den Körper laufen und können sich in Farbe und Muster einem Schachbrett anpassen.
Mit Hilfe von brauner oder schwarzer Tinte (bestehend aus Melanin und anderen chemischen Substanzen) können Kopffüßer ihre Fressfeinde erschrecken und täuschen. Die Tintendrüse liegt hinter dem Anus und entlässt die Tinte durch die Mantelhöhle und weiterhin durch den Trichter nach außen. Des Weiteren werden z. B. bei Sepia officinalis die vielen Schichten der Eihülle mit Tinte versehen, welche somit für die Tarnung der Embryos sorgt.
Innerhalb der Kalmare sind über 70 Gattungen mit Biolumineszenz bekannt. In mehreren Gattungen wird diese mit Hilfe von symbiotischen Bakterien erzeugt; in den anderen Gattungen jedoch durch eine Reaktion von Luciferin und Sauerstoff mit Hilfe des Enzyms Luciferase. Auf diese Weise biolumineszierende Zellen, sogenannte Photophoren, können der Tarnung und dem Paarungsverhalten (bei Tiefseeoktopoden) dienen. Außerdem können biolumineszierende Partikel mit der Tinte ausgestoßen werden.
Profiteur menschlicher Umweltveränderungen
Die Populationsgrößen und Verbreitungsgebiete vieler Kopffüßer-Arten sind in den letzten 60 Jahren deutlich gestiegen bzw. gewachsen. Studien legen nahe, dass der kurze Lebenszyklus der Kopffüßer ihnen ermöglicht, sich schnell an Umweltveränderungen anzupassen. Dies wird vermutlich durch beschleunigte Wachstumsphasen aufgrund ansteigender Meerestemperaturen im Zuge der Globalen Erwärmung beschleunigt. Weiter profitieren die Kopffüßer wohl von der Überfischung ihrer Fressfeinde und Nahrungskonkurrenten.[14]
Systematik
Klassifikation der Großgruppen der Kopffüßer (hierarchisch)
- Kopffüßer – Cephalopoda
- Perlboote i. w. S. – Nautiloidea i. w. S.; zum Teil auch als Altkopffüßer (Palcephalopoda) bezeichnet. Hierzu zählen auch Teile der Geradhörner (Orthocerida) und weitere, meist nicht oder nur wenig eingerollte Nautiloideen (Ascocerida, Oncocerida, Discosorida, Tarphycerida)
- Die folgenden Gruppen werden auch unter dem Begriff Neukopffüßer (Neocephalopoda) zusammengefasst.
- Ammoniten – Ammonoidea (Ammonshörner) †
- Bactriten – Bactritoidea †
- Tintenfische – Coleoidea
- Belemniten – Belemnoidea (Donnerkeile) †
- Zehnarmige Tintenfische – Decabrachia
- Posthörnchen – Spirulida (mit der einzigen rezenten Art Spirula spirula)
- Kalmare – Teuthida
- Sepien – Sepiida
- Zwergtintenfische – Sepiolida
- Achtarmige Tintenfische – Octobrachia/Vampyropoda
- Kraken – Octopoda
- Cirrentragende Kraken – Cirroctopoda
- Vampirtintenfischähnliche – Vampyromorpha (mit der einzigen rezenten Art Vampyroteuthis infernalis)
Phylogenetisches System der Großgruppen der Kopffüßer
Der Stammbaum (phylogenetisches System) der Kopffüßer ist bisher noch nicht völlig aufgeklärt. Einigermaßen sicher ist, dass die Tintenfische (Coleoidea), die Ammoniten (Ammonoidea), die Bactriten (Bactritida) und Teile der Geradhörner (hier die Unterklasse der Actinoceratoida) eine monophyletische Gruppe bilden, die auch als Neukopffüßer (Neocephalopoda) bezeichnet wird, während alle restlichen Kopffüßer als Perlboote i. w. S. (Nautiloidea i. w. S.) oder auch als Altkopffüßer (Palcephalopoda) zusammengefasst werden. Diese zweite Gruppe ist aber wahrscheinlich paraphyletisch, da mit einiger Sicherheit aus den Altkopffüßern die Neukopffüßer hervorgegangen sind.
Die Ammoniten sind im Devon aus Bactriten-ähnlichen Vorfahren entstanden. Auch die Tintenfische (Coleoidea) werden von den Bactriten abgeleitet. Die Bactriten sind daher eine para- oder polyphyletische Gruppierung, die aufgelöst werden müsste.
Die Tintenfische (Coleoidea) sind im Unterkarbon, möglicherweise schon im Unterdevon, aus Bactriten-ähnlichen Vorfahren entstanden. Innerhalb der Tintenfische stehen sich die ausgestorbenen Belemniten (Belemnoidea) auf der einen Seite und die Achtarmigen und Zehnarmigen Tintenfische auf der anderen Seite als Schwestergruppen gegenüber. Die letzteren beiden Schwestergruppen werden auch als Neutintenfische (Neocoleoidea) bezeichnet.
Quellen
Weblinks
- Tree of Life – Cephalopoda
- CephBase In: thecephalopodpage.org
- Kopffüßer im Fossilienatlas–WiKi In: mineralienatlas.de
- Tintenfisch-Archiv TEUTHIS In: tintenfische.com
- Kopffüßer (Cephalopoda) In: weichtiere.at
Zur Phylogenie der Tintenfische
- T. Berthold, T. Engeser: Phylogenetic analysis and systematization of the Cephalopoda (Mollusca). In: Verhandlungen des naturwissenschaftlichen Vereins Hamburg. new series, 29. 1987, S. 187–220.
- L. Bonnaud, R. Boucher-Rodoni, M. Monnerot: Phylogeny of Cephalopods Inferred from Mitochondrial DNA Sequences. In: Molecular Phylogenetics and Evolution. 7. 1997, S. 44–54.
- D. G. Carlini, J. E. Graves: Phylogenetic analysis of cytochrome c oxidase I sequences to determine higher-level relationships within the coleoid cephalopods. In: Bulletin of Marine Science. 64. 1999, S. 57–76.
- D. B. Carlini, R. E. Young, M. Vecchione: A Molecular Phylogeny of the Octopoda (Mollusca: Cephalopoda) Evaluated in Light of Morphological Evidence. In: Molecular Phylogenetics and Evolution. 21. 2001, S. 388–397.
- W. Haas: Trends in the Evolution of the Decabrachia. In: Berliner Paläobiologische Abhandlungen. 3. 2003, S. 113–129.
- M. Vecchione, R. E. Young, D. B. Carlini: Reconstruction of ancestral character states in neocoleoid cephalopods based on parsimony. In: American Malacological Bulletin. 15. 2000, S. 179–193.
- X. D. Zheng, J. Yang, X. Lin, R. Wang: Phylogenetic relationships among the decabrachia cephalopods inferred from mitochondrial DNA sequences. In: Journal of Shellfish Research. 23. 2004, S. 881–886.
Einzelnachweise
- Gerhard Haszprunar, Klaus-Jürgen Götting: Cephalopoda, Kopffüßer. S. 352–362 in: W. Westheide, R. Rieger (Hrsg.): Spezielle Zoologie Teil 1: Einzeller und Wirbellose Tiere. 2. Auflage. Spektrum Akademischer Verlag (Elsevier), München 2007, ISBN 978-3-8274-1575-2
- German Sumbre, Yoram Gutfreund, Graziano Fiorito, Tamar Flash, Binyamin Hochner: Control of Octopus Arm Extension by a Peripheral Motor Program. Science. Band 293, Nr. 5536, 2001, S. 1845–1848, doi:10.1126/science.1060976 (alternativer Volltextzugriff: Sensory Motor Performance Program, RIC (Memento vom 20. November 2016 im Internet Archive)); siehe dazu auch Tom Clarke: Octopus arms strike out alone. Nature News, 7. September 2001, doi:10.1038/news010913-1
- Kenzo Kaifu, Tomonari Akamatsu, Susumu Segawa: Underwater sound detection by cephalopod statocyst. Fisheries Science, Band 74, 2008, S. 781–786, doi:10.1111/j.1444-2906.2008.01589.x (alternativer Volltextzugriff: Portland State University (Memento vom 20. November 2016 im Internet Archive)).
- Marian Y. Hu, Hong Young Yan, Wen-Sung Chung, Jen-Chieh Shiao, Pung-Pung Hwang: Acoustically evoked potential in two cephalopods infered using the auditory brainstem response (ABR) approach. Comparative Biochemistry and Physiology, Part A: Molecular & Integrative Physiology. Band 153, Nr. 3, 2009, 278–283, doi:10.1016/j.cbpa.2009.02.040 (alternativer Volltextzugriff: ResearchGate).
- Ermanno Bencivenga: The trouble with cephalopoda. Common Knowledge. Band 14, Nr. 3, 2008, S. 365–373, doi:10.1215/0961754X-2008-002
- Chuan-Chin Chiao, I-Rong Lin: Visual cognition in cuttlefish Sepia pharaonis: discrimination, generalization, and amodal completion. Frontiers in Behavioral Neuroscience. Conference Abstract: Tenth International Congress of Neuroethology. 2012, doi:10.3389/conf.fnbeh.2012.27.00084
- Tim Wollesen, Bernard M. Degnan, Andreas Wanninger: Expression of serotonin (5-HT) during CNS development of the cephalopod mollusk, Idiosepius notoides. Cell and Tissue Research. Band 342, Nr. 2, 2010, S. 161–178, doi:10.1007/s00441-010-1051-z
- Marta Borgi, Augusto Vitale, Enrico Alleva: Octopus: the ocean’s intelligent invertebrate. In: Annali dell'Istituto Superiore di Sanità 47, Nr. 4, 2011, S. 477–478, doi:10.1590/S0021-25712011000400022.
- Peter Godfrey-Smith: Cephalopods and the evolution of the mind. In: Pacific Conservation Biology 19, Nr. 1, 2013, S. 4.
- Yuzuru Ikeda: A perspective on the study of cognition and sociality of cephalopod mollusks, a group of intelligent marine invertebrates1. In: Japanese Psychological Research 51, Nr. 3, 2009, S. 146–153, doi:10.1111/j.1468-5884.2009.00401.x.
- Lauren Shorser: Alien Minds: Evidence of intelligence in coleoid cephalopods. Diss. University of Otago, 2011.
- Madan and Wells (1996): Cutaneous respiration in Octopus vulgaris. J Exp Biol 199:683 2477–2483.
- S. Hunt, M. Nixon: A comparative study of protein composition in the chitin-protein complexes of the beak, pen, sucker disc, radula and oesophageal cuticle of cephalopods. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, Band 68, Nr. 4, 1981, S. 535–546.
- Gabriele Kerber: Klimawandel: Tintenfisch statt Sprotten. In: Spektrum.de. 1. Juli 2020, abgerufen am 1. Juli 2020.