Oecophylla smaragdina
Oecophylla smaragdina (auch Asiatische Weberameise) ist eine Art der Schuppenameisen aus der Gattung der Weberameisen. Charakteristisch und namensgebend für Weberameisen ist die Konstruktion eines Seidennestes, das ist ein Freinest aus Blättern, die mit von den Larven produzierten Seidenfäden „zusammengewoben“ werden.[2][3][4] Das Verbreitungsgebiet reicht von Indien bis Nordaustralien. Ihre Schwesterart Oecophylla longinoda ist im tropischen Afrika beheimatet.
_nest_in_Kinnarsani_WS%252C_AP_W_IMG_6012.jpg.webp)
| Oecophylla smaragdina | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Arbeiterin | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Oecophylla smaragdina | ||||||||||||
| (Fabricius, 1775)[1] |
Oecophylla smaragdina lebt räuberisch[5] und von tierischem Aas. Die Ameisen sind wehrhaft, sie beißen und verspritzen Ameisensäure.[6]
Beschreibung
Die Königin besitzt eine Körperlänge von 13 bis 16 mm, ist grünlich und zunächst beflügelt. Die Männchen sind 6 bis 6,5 mm lang, schwarz gefärbt und beflügelt. Die Arbeiterinnen können ziemlich verschieden gestaltet sein,[3] meist rötlich bis orange, in Nordaustralien mit grünem Hinterleib, ihre Körperlänge kann bis zu 9,5 mm betragen. Innerhalb eines Nestes leben Arbeiterinnen sehr verschiedener Körpergröße zusammen. Die Gattung ist innerhalb der Formicinae bemerkenswert durch den sehr langen und schmalen Petiolus, der nicht schuppenförmig erhaben ist, auch die Beine sind ungewöhnlich lang und schlank. Die Komplexaugen der Arbeiterinnen sind sehr groß. Die langen und schlanken Antennen sind zwölfgliedrig mit sehr langem Scapus, ihre Einlenkungsstelle liegt weit vom Rand des Clypeus entfernt, die Endglieder bilden keine Keule. Die Mandibeln besitzen zehn oder mehr Zähne, mit großem Endzahn. Die Tiere besitzen Maxillarpalpen mit fünf und Labialpalpen mit vier Segmenten. Weder am Rumpf noch auf dem Propodeum sitzen Dornen oder Zähne.[7]
Die Art kann von der zweiten Art der Gattung, Oecophylla longinoda, gewöhnlich schon anhand des Verbreitungsgebiets unterschieden werden (keine sympatrischen Vorkommen bekannt). Morphologische Unterschiede sind: Bei Oecophylla smaragdina ist der Petiolus flacher, seine ventrale Oberfläche ist eben, nicht konvex wie bei Oecophylla longinoda. Außerdem sind die Stigmen des Petiolus von oben gesehen stark hervortretend.[8]
Staat

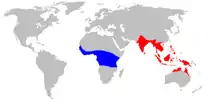
rot: Oecophylla smaragdina
(blau: Oecophylla longinoda)




Die Staaten von Oecophylla smaragdina können sehr groß sein und bis zu hundert Seidennester mit zusammen etwa 500.000 Tieren in beispielsweise 21 größeren Bäumen auf einer Fläche von 1500 m2 umfassen.[3][9] Die territoriale Abgrenzung von Staaten untereinander erfolgt über komplexe Kommunikationsmuster.[9]
Die meisten Staaten beherbergen nur eine Königin, sie sind monogyn. Einige, besonders im Norden Australiens, können auch polygyn sein und bis zu sechs Königinnen besitzen.[2][10] Die Entstehung der Polygynie wird als eine Strategie gesehen, Ausfall einer Königin durch Parasitenbefall zu kompensieren.[10][11]
Nester und Nestbau
Zum Nestbau schwärmen Arbeiterinnen der großen Morphe (sog. Majores) in geeigneten Teilen der Baumkrone aus. Hier versuchen sie, Blattränder oder -spitzen lebender, grüner Blätter zu sich herzuziehen. Gelingt dies einer Arbeiterin, beginnen andere, sie zu unterstützen. Um weiter entfernt wachsende Blätter zu der entstehenden Struktur herzuziehen, können die Tiere lange Ketten bilden, bei denen die Tiere übereinander klettern und sich dann mit ihren Mandibeln am Petiolus von Nestgenossinnen festhalten. Oft arbeiten zahlreiche solcher Ketten parallel zueinander, wodurch erhebliche Zugkräfte entwickelt werden können. Obwohl auch andere Ameisenarten Teams bilden[12] ist diese Kettenbildung nur von der Gattung Oecophylla bekannt. Sind genügend Blätter zu einer zeltartigen Konstruktion zusammengezogen, halten einige Arbeiterinnen sie wie lebende Klammern in Form. Andere beginnen damit, Larven aus benachbarten bestehenden Nestern herbeizutragen. Mit der von den Larven produzierten Seide spinnen sie die Blätter zusammen. Nur jüngere Larven des dritten Larvenstadiums geben dabei Seidenfäden ab, sie besitzen dazu stark vergrößerte Seidendrüsen. Für die übliche Funktion der Seide, den Bau von Kokons zur Verpuppung, wird diese bei Oecophylla nicht mehr eingesetzt. Die Arbeiterin trägt die bewegungslose Larve in ihren Mandibeln und bewegt sie wie ein Weberschiffchen über den Spalt vor und zurück. Zusätzlich werden Seidenwände gesponnen, um verbleibende Lücken zu verschließen. Oft werden zusätzlich tunnelartige Galerien zu andern Nestern angelegt.[13][14] Zusätzlich werden auch noch Schutzpavillons für Schildlauskolonien angelegt, von deren Ausscheidungen sich die Ameisen ernähren.[4]
Beziehungen zu anderen Organismen
Symbiose: Symphylie (Trophobiose)
Es besteht eine Symbiose in Form einer Symphylie als Trophobiose zu dem obligat myrmekophilen Bläuling Anthene emolus.[15] Bläulingweibchen werden durch die Anwesenheit von Oecophylla smaragdina zur Eiablage angeregt. Die ausschlüpfenden Larven werden von den Ameisen in Pavillons getragen, wo sie Nahrung finden und ständig gepflegt werden. Im dritten und vierten Larvalstadium sezernieren die Larven eine energiereiche Körperflüssigkeit mit ca. 200 Joule pro Raupe, welche von den Ameisen begierig aufgenommen wird. Nach der Verpuppung besteht keine Attraktivität mehr, die Schmetterlingspuppen werden aber von den Ameisen nicht angegriffen (man spricht von Probiose). Die schlüpfenden Anthene emolus genießen keinen Schutz und werden manchmal von Oecophylla smaragdina erbeutet.[15]
Oecophylla smaragdina sind aphidophil, das heißt, sie leben häufig mit myrmekophilen Schnabelkerfen trophobiotisch zusammen, die sie beschützen und von denen sie exzernierte Nährstoffe erhalten. Trophobiotische Beziehungen bestehen in Nordaustralien (Nord-Queensland) zu Pflanzenläusen (Sternorrhyncha), Zikaden (Auchenorrhyncha), Napfschildläusen (Coccidae wie Coccus sp., Milviscutulus sp.), Buckelzirpen (Membracidae wie Sextius sp.), Toxoptera aurantii, Blattläusen, Schmierläusen (Pseudococcidae wie Zitrusschmierlaus), Icerya sp. (Margarodidae), Eriococcidae, Austrotartessus sp. (Zwergzikaden, Cicadellidae) und den Bläulingsraupen (Anthene seltuttus und Arhopala centaurus).[16]
Visuelle Mimikry
Einige Gliederfüßer wie Insekten und Spinnen ahmen Oecophylla smaragdina durch anatomische Strukturen nach (Mimikry), wodurch sie Fressfeinde abschrecken oder sich den Ameisen nähern können. Sie sind häufig in der Nachbarschaft der Ameisen anzutreffen.[6]
Homodes bracteigutta ahmt als Schmetterlingsraupe mit ihren Körperenden Oecophylla smaragdina nach, als würde sie bereits als Beute davongeschleppt.[6] Möglicherweise ahmt auch der Zweiflügler Acrostichum aureum (Körpergröße 9 mm) Oecophylla smaragdina nach.[6]
Die Krabbenspinne Amyciaea lineatipes (Körpergröße 5–7 mm) und die Springspinne Myrmarachne plataleoides (Körpergröße 6–11 mm) ahmen Einzeltiere der Ameise nach. Bei Amyciaea lineatipes trägt der Hinterleib zwei Augenflecken, bei Myrmarachne plataleoides sind die Augenflecken auf den großen Cheliceren, welche den Kopf der Ameise vorgeben.[6] Beide Spinnenarten erbeuten und fressen Arbeiterinnen der Oecophylla smaragdina.[6] Diese Art der räuberischen Beziehung wird als Synechthrie oder Syllestium bezeichnet.
Olfaktorische Mimikry
Die myrmekophile Springspinne Cosmophasis bitaeniata (Keyserling) imitiert den Geruch ihres Wirtes, indem sie gleichartige Kohlenwasserstoffe produziert und sich damit tarnt.[6][17][18] Cosmophasis bitaeniata ist kein symbiotischer Ameisengast, sondern betreibt Synechthrie oder Syllestium, sie nimmt die Larven aus den Mandibeln kleinerer Arbeiterinnen der Oecophylla smaragdina und frisst sie.[19] Äußere Ähnlichkeit zwischen Cosmophasis bitaeniata und Oecophylla smaragdina besteht nicht.[6]
Beziehung zu Pflanzen, Fressfeinden und Nutzen für den Menschen
Mangroven können besser in Anwesenheit von Oecophylla smaragdina gedeihen, da herbivore Lebewesen durch die Ameisen stark kontrolliert werden.[5][20] Da die Ameisen Mangroven schützen, wurden sie auch zum Schutz bei Mangrovenanpflanzungen am Mekong eingesetzt. Bereits die Anwesenheit der Pheromone von Oecophylla smaragdina schreckt herbivore Insekten wie Rhyparida wallacei ab.[21]
Eine zentrale Rolle spielen Lianen, welche beispielsweise im Norden Australiens 68 % der Besiedelungspflanzen ausmachten, insbesondere Entada phaseoloides und Caesalpinia traceyi.[16] Auf Lianen können trophobiotische Schmierläuse besser gedeihen, als an Bäumen.
Schon lange ist Oecophylla smaragdina als Biologische Schädlingsbekämpfung in der Landwirtschaft Südostasiens und Nordaustraliens beliebt, trotz ihrer schmerzhaften Bisse.[22][23][24][25][26][27]
Die Ameisenlarven werden gern von Vögeln gefressen, z. B. durch den Orangespecht; in Thailand werden die großen Königinnenlarven auch für den menschlichen Verzehr gehandelt.[3][28]
Die Eier der Art sind im ländlichen Laos Teil der "Ant Egg Soup" und werden in diesem Sinne auch als "Dschungel-Kaviar" bezeichnet. Dafür sammeln Bauern die Eier im Spätsommer von Hand aus den Nestern und trennen sie von den Ameisen, die ihre Brut mit Bissen verteidigen.[29]
Systematik
Die Art ist eine von nur zwei rezenten Arten der Gattung Oecophylla. Diese steht innerhalb der Formicinae relativ isoliert und wird gewöhnlich als einzige Gattung (monotypisch) in einen Tribus Oecophyllini gestellt. Diese Position ist bei genetischen Analysen (Phylogenomik, Analyse der Verwandtschaftsbeziehungen mittels homologer DNA-Sequenzen) bestätigt worden.[30] Die Gattung ist seit langer Zeit nicht morphologisch revidiert worden, so dass der Status der Arten und Unterarten schlecht gesichert ist.
Synonyme
Die Art wurde erstbeschrieben unter dem Namen (Basionym) Formica smaragdina Fabricius, 1775[31]
Synonyme sind: Oecophylla virescens (Fabricius, 1775), Oecophylla macra (Guérin-Méneville, 1831), Oecophylla viridis (Kirby, 1819), Oecophylla zonata (Guérin-Méneville, 1838).
Oecophylla smaragdina ist Typusart der Gattung Oecophylla.[32]
Unterarten und deren Verbreitung
.jpg.webp)
Als Unterarten wurden benannt:
- Oecophylla smaragdina smaragdina (Nominatform)
- Oecophylla smaragdina fuscoides Karavaiev, 1933
- Oecophylla smaragdina gracilior Forel, 1911
- Oecophylla smaragdina gracillima Emery, 1893
- Oecophylla smaragdina selebensis Emery, 1893
- Oecophylla smaragdina subnitida Emery, 1892
Sieben genetisch distinkte Gruppen von Oecophylla smaragdina wurden beschrieben und durch Unterschiede ihrer mitochondrialen DNA im Cytochrom B Gen (Cytb), Cytochrom Oxidase Untereinheit I (COI) und des nukleären Opsin-Gens (LW Rh) differenziert.[33] Gruppe 1 lebt in Indien außer West-Bengalen; Gruppe 2 in Bengalen, indonesische Halbinsel, malayische Halbinsel und auf den größeren Sundainseln einschließlich Lombok und Sumbawa; Gruppe 3 auf den Philippinen; Gruppe 4 auf Flores; Gruppe 5 auf Sulawesi; Gruppe 6 auf Halmahera; Gruppe 7 auf Neuguinea und Nordaustralien. Die Gruppierung spiegelt die geologischen Möglichkeiten der Besiedelung während der Kaltzeiten wider.
Bei der Unterart in Australien sind auch die Arbeiterinnen teilweise grün gefärbt.
Einzelnachweise
- Gennady M. Dlussky, Torsten Wappler, Sonja Wedmann: New middle Eocene formicid species from Germany and the evolution of weaver ants. In: Acta Palaeontologica Polonica. 53, Nr. 4, 2008, S. 615–626. doi:10.4202/app.2008.0406.
- Ross H. Crozier, Philip S. Newey, Ellen A. Schlüns, Simon K. A. Robson: A masterpiece of evolution — Oecophylla weaver ants (Hymenoptera: Formicidae). In: Myrmecological News, Band 13, 2010, S 57–71, PDF.
- taxo4254: (Seite nicht mehr abrufbar, Suche in Webarchiven: Oecophylla smaragdina) , aufgerufen am 27. Januar 2015.
- Andreas Weißflog: Freinestbau von Ameisen (Hymenoptera: Formicidae) in der Kronenregion feuchttropischer Wälder Südostasiens. Dissertation am Fachbereich Biologie und Informatik, J. W. Goethe-Universität in Frankfurt am Main, 2001 (d-nb.info).
- Joachim Offenberg, Sopon Havanon, Sanit Aksornkoae, Donald J. MacIntosh, Mogens Gissel Nielsen: Observations on the ecology of weaver ants (Oecophylla smaragdina Fabricius) in a Thai mangrove ecosystem and their effect on herbivory of Rhizophora mucronata Lam. In: Biotropica, Band 36, Nr. 3, 2004, S. 344–351 (PDF).
- Tzi Ming Leong, Vilma D’Rozario: Mimicry of the weaver ant, Oecophylla smaragdina by the moth caterpillar, Homodes bracteigutta, the crab spider, Amyciaea lineatipes, and the jumping spider, Myrmarachne plataleoides. In: Nature in Singapore, Band 2012, Nr. 5, 6. März 2012, S. 39–56 (PDF).
- S.J.J. Schreven, E. Perlett, B.J.M. Jarrett, F.A. Harsanto, A. Purwanto, A. Azis, N.C. Marchant, M.E. Harrison (2014): A Guide to the Ants of Sabangau. The Orangutan Tropical Peatland Project, Palangka Raya, Indonesia. download
- Species: Oecophylla longinoda bei AntWeb v5.20.1, abgerufen am 30. Januar 2015
- Bert Holldobler: Territorial behavior in the green tree ant (Oecophylla smaragdina). In: Biotropica, Band 15, Nr. 4, Dezember 1983, S. 241–250.
- R. Peng, K. Christian, K. Gibb: How many queens are there in mature colonies of the green ant, Oecophylla smaragdina (Fabricius)? In: Australian Journal of Entomology, Band 37, 1998, S. 249–253. doi:10.1111/j.1440-6055.1998.tb01579.x.
- Paul Schmid-Hempel, Ross H. Crozier: Ployandry versus polygyny versus parasites. In: Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences Band 354, Nr. 1382, 1999, S. 507–515. doi:10.1098/rstb.1999.0401.
- Carl Anderson & Nigel R. Franks (2001): Teams in animal societies. Behavioral Ecology, Volume 12, Issue 5: 534–540. doi:10.1093/beheco/12.5.534
- Bert Hölldobler & Edward O. Wilson (1983): The Evolution of Communal Nest-Weaving in Ants. American Scientist,Vol. 71, No. 5: 490–499.
- Bert Hölldobler & Edward O. Wilson (1977): Weaver Ants. Scientific American Volume 237, Issue 6: 146–154.
- Konrad Fiedler, Ulrich Maschwitz: The symbiosis between the weaver ant, Oecophylla smaragdina, and Anthene emolus, an obligate myrmecophilous lycaenid butterfly. In: Journal of Natural History, Band 23, Nr. 4, 1989, S. 833–846. doi:10.1080/00222938900770441.
- Nico Blüthgen, Konrad Fiedler: Interactions between weaver ants Oecophylla smaragdina, homopterans, trees and lianas in an Australian rain forest canopy. In: Journal of Animal Ecology, Band 71, Nr. 5, 2002, S. 793–801. doi:10.1046/j.1365-2656.2002.00647.x.
- Mark A. Elgar, Rachel A. Allan: Chemical mimicry of the ant Oecophylla smaragdina by the myrmecophilous spider Cosmophasis bitaeniata: Is it colony-specific? In: Journal of Ethology, Band 24, Nr. 3, 2006, S. 239–246.
- Rachel A. Allan, Robert J. Capon, W. Vance Brown, Mark A. Elgar: Mimicry of host cuticular hydrocarbons by salticid spider Cosmophasis bitaeniata that preys on larvae of tree ants Oecophylla smaragdina. In: Journal of Chemical Ecology, Band 28, Nr. 4, 2002, S. 835–848.
- Rachel A. Allan, Mark A. Elgar: Exploitation of the green tree ant, Oecophylla smaragdina, by the salticid spider Cosmophasis bitaeniata. In: Australian Journal of Zoology, Band 49, Nr. 2, 2001, S. 129–137.
- Stefano Cannicci, Damien Burrows, Sara Fratini, Thomas J. Smith III, Joachim Offenberg, Farid Dahdouh-Guebas: Faunal impact on vegetation structure and ecosystem function in mangrove forests: a review. In: Aquatic Botany, Band 89, Nr. 2, 2008, S. 186–200. doi:10.1016/j.aquabot.2008.01.009.
- Joachim Offenberg, Mogens Gissel Nielsen, Donald J. MacIntosh, Sopon Havanon, Sanit Aksornkoae: Evidence that insect herbivores are deterred by ant pheromones. In: Proceedings of the Royal Society of London. Series B: Biological Sciences, Band 271, Suppl. 6, 2004, S. S433–S435. doi:10.1098/rsbl.2004.0210.
- R. K. Peng, K. Christian, K. Gibb: The effect of the green ant, Oecophylla smaragdina (Hymenoptera: Formicidae), on insect pests of cashew trees in Australia. In: Bulletin of Entomological Research, Band 85, Nr. 02, 1995, S. 279–284. doi:10.1017/S0007485300034374.
- Nicolas Césard: Harvesting and commercialisation of kroto (Oecophylla smaragdjna) in the Malingping area, West Java, Indonesia. In: Forest Products, Livelihoods and Conservation, 2004, Kapitel 4, S. 61–77 (PDF).
- R. K. Peng, K. Christian: Integrated pest management in mango orchards in the Northern Territory Australia, using the weaver ant, Oecophylla smaragdina,(Hymenoptera: Formicidae) as a key element. In: International Journal of Pest Management, Band 51, Nr. 2, 2005, S. 149–155.
- P. Van Mele, N. T. T. Cuc: Evolution and status of Oecophylla smaragdina (Fabricius) as a pest control agent in citrus in the Mekong Delta, Vietnam. In: International Journal of Pest Management, Band 46, Nr. 4, 2000, S. 295–301 (PDF).
- Joachim Offenberg, Decha Wiwatwitaya: Sustainable weaver ant (Oecophylla smaragdina) farming: harvest yields and effects on worker ant density. In: Asian Myrmecol, Band 3, 2009, S. 55–62 (PDF).
- Paul Van Mele: A historical review of research on the weaver ant Oecophylla in biological control. In: Agricultural and Forest Entomology, Band 10, Nr. 1, 2008, S. 13–22. doi:10.1111/j.1461-9563.2007.00350.x.
- Wissanurak Sribandit, Decha Wiwatwitaya, Santi Suksard, Joachim Offenberg: The importance of weaver ant (Oecophylla smaragdina Fabricius) harvest to a local community in Northeastern Thailand. In: Asian Myrmecology, Band 2, 2008, S. 129–138 (PDF).
- Urban Laotians pay handsomely for ant-egg soup. In: The Economist. ISSN 0013-0613 (economist.com [abgerufen am 25. August 2020]).
- Z.L. Chen, S.Y. Zhou, D.D. Ye, Y. Chen, C.W. Lu (2013): Molecular Phylogeny of the Ant Subfamily Formicinae (Hymenoptera, Formicidae) from China Based on Mitochondrial Genes. Sociobiology 60(2): 135–144. doi:10.13102/sociobiology.v60i2.135-144
- Johann Christian Fabricius: Systema entomologiae, sistens insectorum classes, ordines, genera, species, adiectis synonymis, locis, descriptionibus, observationibus. Libraria Kortii, Flensburgi et Lipsiae (Flensburg und Leipzig) 1775. 832 pp., p.828.
- Oecophylla smaragdina bei AntCat, an Online Catalog of the Ants of the World, by Barry Bolton
- N. Azuma, K. Ogata, T. Kikuchi, S. Higashi: Phylogeography of Asian weaver ants, Oecophylla smaragdina. In: Ecological Research, Band 21, Nr. 1, 2006, S. 126–136. doi:10.1007/s11284-005-0101-6.
Weblinks
- Video: Oecophylla smaragdina (Formicidae) - Nestbau und Brückenbildung, Trophobiose (Freilandaufnahmen). Institut für den Wissenschaftlichen Film (IWF) 1973, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/E-1936.