Umami
Mit dem Lehnwort umami (von japanisch うま味 umami ‚Schmackhaftigkeit‘, zu うまい umai ‚schmackhaft, würzig‘ und 味 mi ‚Essenz‘)[1] wird in der Physiologie eine Qualität des Geschmackssinnes bezeichnet,[2] die neben süß, sauer, salzig und bitter zu den grundlegenden Sinnesqualitäten der gustatorischen Wahrnehmung beim Menschen zählt. Sie wird im Deutschen meist mit herzhaft, würzig, auch fleischig oder pikant (ohne die Nebenbedeutung scharf) bezeichnet und wird als vergleichsweise lange anhaltend beschrieben.[3]

Die Wahrnehmung eines Umami-Geschmacks kann durch die Aminosäureionen Glutamat und Aspartat sowie durch die Nukleinsäureionen Inosinat und Guanosinat hervorgerufen werden. Nicht darunter fällt eine gesonderte Detektion von aus Fetten freigesetzten Fettsäuren.[4] Der Geschmacksqualität umami entsprechen in den Geschmacksknospen der Zunge bestimmte chemorezeptive Sinneszellen mit einem spezifischen Geschmacksrezeptor, bestehend aus den beiden Proteinen T1R1 und T1R3 in der Zellmembran der Geschmackszellen.[2] Die Sinnesqualität umami hilft bei der Suche nach proteinhaltiger Nahrung.
Rezeptoren der Geschmackszellen
Bei den Rezeptorproteinen dieser Geschmackssinneszellen handelt es sich um ein Heterodimer aus zwei Proteinen namens T1R1 und T1R3, ähnlich dem Rezeptor für die Geschmacksqualität süß, der aus den Proteinen T1R2 und T1R3 besteht. Alle diese Proteine sind G-Protein-gekoppelte Rezeptoren der Klasse C (C-GPCR). In diesen Rezeptoren ist eine sogenannte Venusfliegenfalle-Domäne an eine Transmembrandomäne enthalten.[5] Daneben gehören zu den Rezeptoren für den Umami-Geschmack auch die metabotropen Glutamatrezeptoren mGluR4 und mGluR1.[6][7] Der Komplex aus T1R1 und T1R3 erkennt einige Nukleotide und Aminosäuren mit hoher Spezifität, neben Asparaginsäure insbesondere Glutaminsäure.[1]
Die eine Hälfte des Rezeptors für den Umami-Geschmack, T1R3, wird auch als ein Bestandteil des Rezeptors für Süße verwendet, bei dem es mit T1R2 ein Heterodimer bildet. Der Inhibitor Lactisol setzt beim Menschen durch Bindung an T1R3 sowohl die Geschmacksempfindlichkeit für umami als auch für süß herab.[8][9] Ebenso wurden Glucane beschrieben, welche die Dauer des Geschmacks verkürzen.[3] Rezeptoren aus der Gruppe CaSR binden Calciumionen und verstärken die Sinneseindrücke umami, süß und salzig.[10][11] Die Geschmackswahrnehmung nach Aktivierung von CaSR wird als Kokumi bezeichnet.[12]
Geschmackliche Wahrnehmung
Die Signale der Geschmackszellen werden auf Endigungen zugeordneter Nervenzellen übertragen und über deren Fortsätze – als die Geschmacksfasern von Hirnnerven – zum Gehirn weitergeleitet. Die im Markhirn liegenden Kerngebiete (Nucleus tractus solitarii) dienen für den weiteren Verlauf als Umschaltstelle. Von hier aus bestehen Bahnen, über die zum einen via Pons der Hypothalamus und Regionen des limbischen Systems erreicht werden. Zum anderen führen via Thalamus Projektionen zu Arealen des Gyrus postcentralis und der Insula der Großhirnrinde. Erst auf Ebene des Cortex cerebri sind nach gängiger Auffassung Wahrnehmungen möglich, die verbal mitgeteilt werden können, etwa als „schmackhafter“ Eindruck einer Speise. Der Umami-Geschmack verstärkt sowohl den Appetit als auch das Sättigungsgefühl.[13]
Geschmacksauslösende Stoffe
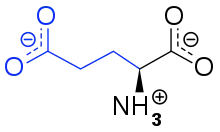
bei pH 7,4 mit der Seitenkette in blau
Umgangssprachlich vereinfachend wird von „Glutamat“ gesprochen, jedoch handelt es sich dabei um verschiedene Salze und das Anion der Glutaminsäure, die als Aminosäure ein natürlicher Baustein vieler Proteine in allen Lebewesen ist. Ein Umami-Geschmack wird vornehmlich durch Salze der Glutaminsäure hervorgerufen, genauer durch das in wässriger Lösung daraus entstehende Anion der Glutaminsäure. Glutaminsäure kommt daher sowohl in fleisch-, fisch- und milchhaltigen Lebensmitteln vor wie auch in Gemüse oder Algen. Dabei sprechen die in den zubereiteten Speisen enthaltenen freien Glutamate und in geringerem Umfang die Aspartate die Rezeptoren von Umami-Geschmackszellen an, indem sie daran gebunden werden.[14] Asparaginsäure wirkt etwa ein Viertel so stark wie Glutaminsäure in Bezug auf den Umami-Geschmack.[15] Bisher wurden 52 Peptide beschrieben, die einen Umami-Geschmack erzeugen.[16] Umami-auslösende Peptide sind hydrophil und enthalten Glutaminsäure oder Asparaginsäure.[12] Die Anionen der vergleichsweise selteneren und nicht in Proteinen vorkommenden Aminosäuren Homocysteinsäure,[17] Cystein-S-sulfonsäure[17] und Ibotensäure[15][17] haben eine ähnliche Wirkung wie Glutamat. Auch Tricholomasäure, die im Pilz Tricholoma muscarium natürlich vorkommt, erzeugt einen Umami-Geschmack.[15][18]
Der hauptsächliche Träger des Umami-Geschmacks ist das freie, durch Proteolyse aus den Proteinen herausgelöste Anion der Aminosäure Glutaminsäure. Glutaminsäure bildet das in wässriger Lösung vorkommende physiologisch relevante Glutamat-Zwitterion. Ihre Salze werden als Glutamate bezeichnet. Das Natriumsalz der Glutaminsäure heißt Mononatriumglutamat (MNG, engl. Monosodium glutamate, MSG), während das Kaliumsalz der Glutaminsäure als Monokaliumglutamat bezeichnet wird. Beide Salze dissoziieren in wässrigen Lösungen zu Natrium-Ionen beziehungsweise Kalium-Ionen und dem Anion der Carbonsäuregruppe der Glutaminsäure. Bei niedrigeren pH-Werten (durch Zugabe von Säuren) nimmt der Umami-Geschmack aufgrund der Protonierung der Carbonsäuregruppe ab.[1] Eine reine Glutamatlösung wird nicht als wohlschmeckend empfunden,[19] sondern erst in Kombination mit Aromen[20] und Kochsalz.[15]
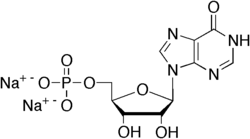
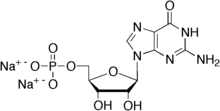
Daneben wirken auch Purin-Ribonucleotide[21] wie das in wässrigen Lösungen vorkommende Inosinmonophosphat (IMP, Inosinat), Guanosinmonophosphat (GMP, Guanosinat) und über den Abbau zu Inosinmonophosphat indirekt auch Adenosinmonophosphat (AMP, Adenosinat) synergistisch verstärkend mit Glutamaten.[14] In trockener Form liegen diese ebenfalls als Natrium- oder Kaliumsalze vor, wie auch das Glutamat und das Aspartat. Zur gustatorischen Wahrnehmung von Glutamaten können verschiedene Typen ähnlich gebauter Geschmacksrezeptoren in den Geschmackszellen der Zunge beitragen. Der Schmackhaftigkeits-Eindruck von Glutamat wird durch diese Purine verstärkt, da sie ebenfalls am Glutamat-Rezeptor andocken.[5][22][23] Die maximale Umami-Geschmackswirkung einer Mischung von Mononatriumglutamat und Natriuminosinmonophosphat wird zwischen 30 und 70 % eines der beiden Bestandteile erreicht.[24] Ohne eine Zugabe von Inosinmonophosphat liegt die untere Wahrnehmungsgrenze einer wässrigen Lösung von Mononatriumglutamat bei 0,12 g/L.[24] In Anwesenheit von 2,5 g/L (entsprechend 5 mM) Inosinmonophosphat liegt die untere Wahrnehmungsgrenze einer wässrigen Mononatriumglutamatlösung bei 0,0019 g/L.[24]
Hinsichtlich anderer Geschmacksqualitäten als umami wirken Glutamate nicht verstärkend, wenn sie in Kombination mit anderen geschmacksauslösenden Stoffen verwendet werden.[20] Tatsächlich können sich Glutamat beziehungsweise GMP und IMP abschwächend auf manche anderen Geschmacksrichtungen auswirken. So erhöht eine wässrige 5 mM Mononatriumglutamatlösung die untere Wahrnehmungsgrenze für Säuren um etwa das Doppelte, eine wässrige 5 mM Inosinmonophosphatlösung erhöht sie um etwa das Dreißigfache und die für Bitterstoffe um etwa das Vierfache.[24]
Glutamate als Geschmacksstoffe
Vorkommen von Glutamaten


Die Aminosäure Glutaminsäure kommt in allen Lebewesen als Bestandteil von Proteinen vor.[25] Dementsprechend kommen Glutamate in allen proteinhaltigen Lebensmitteln vor. Die Freisetzung der Glutaminsäure aus Proteinen erfolgt durch proteinabbauende Enzyme. Die Freisetzung aus den Zellen eines Lebensmittels wird durch Garen, Trocknen oder Fermentieren und durch die dadurch erzeugten Risse in den Zellmembranen verstärkt. Im Allgemeinen nimmt der Glutamatanteil mit dem Reifungsgrad des Lebensmittels zu.[26] Bei Käse nimmt der Glutamatanteil mit der Reifungsdauer aufgrund des Proteinabbaus durch Bakterien und Pilze zu,[24] bei luftgetrocknetem Schinken infolge der im Lebensmittel enthaltenen proteinabbauenden Enzyme im Zuge der Autolyse.
Besonders reichlich sind Glutamate vorhanden[27] in vollreifen und insbesondere getrockneten Tomaten, Fleisch, getrocknete Shiitake, Käse (insbesondere Parmesan), Würzmitteln und -saucen (z. B. Sojasauce,[28] Fischsauce,[28] Brühe, Fond, Fleischextrakt, Hydrolysate von Proteinen, Hefeextrakt, Maggi-Würze und Selleriesaat).[29]
In der menschlichen Muttermilch ist Glutaminsäure die am häufigsten vorkommende Aminosäure.[30] Eine besondere Verwendung findet Glutaminsäure in der Nahrungsmittelindustrie, wo sie, biotechnisch hergestellt, als Geschmacksverstärker eingesetzt wird. Salze der Glutaminsäure wie Mononatriumglutamat (MNG) werden auch industriell produziert und verbreitet als Zusatzstoff aus der Gruppe der Geschmacksverstärker in Lebensmitteln eingesetzt.
Insbesondere im westlichen Europa wünschen sich Verbraucher einen geringeren Einsatz solcher Stoffe, da sie von Verbrauchern nicht als natürlich angesehen werden, auch wenn sie biologisch erzeugt wurden und nach der Definition der Gesetzgeber natürlich sind.[11] Zugefügte reine Glutaminsäure oder ihre Salze werden vor allem in der asiatischen Küche sowie bei der industriellen Herstellung von vorgefertigten Lebensmitteln eingesetzt. Bei vorgefertigten Lebensmitteln soll sie den Geschmacksverlust ausgleichen, der durch Kochen, Sterilisieren und Tiefgefrieren entsteht.[31] Glutamate sind in der Lage, mögliche Geschmacksfehler zu überlagern, die durch zu lange Lagerung oder durch Verderbnis von Lebensmitteln zustande kommen können.[32] Der Weltmarkt für industriell hergestelltes Mononatriumglutamat betrug 2009 etwa 2 Millionen Tonnen.[33]
- Glutamat in Lebensmitteln
| Lebensmittel tierischen Ursprungs | Glutamat Massenanteil in % |
|---|---|
| Schinken, getrocknet | 0,337[34] |
| Entenfleisch | 0,069[34] |
| Hühnerfleisch | 0,044[34] |
| Rindfleisch | 0,033[34] |
| Schweinefleisch | 0,023[34] |
| Hühnerei | 0,023[34] |
| Lammfleisch | 0,008[34] |
| Sardine | 0,280[34] |
| Kalmar | 0,146[34] |
| Jakobsmuschel | 0,140[24] |
| Seeigel | 0,140[34] |
| Auster | 0,130[34] |
| Miesmuschel | 0,105[34] |
| Kaviar | 0,080[34] |
| Königskrabbe | 0,072[24] |
| Niboshi (getrocknete Sardinen) | 0,050[34] |
| Garnele | 0,040[34] |
| Makrele | 0,036[34] |
| Bonitoflocken | 0,036[34] |
| Thunfisch, getrocknet | 0,031[34] |
| Lachskaviar | 0,022[34] |
| Lachs | 0,020[34] |
| Krebse | 0,019[34] |
| Kabeljau | 0,009[34] |
| Hummer | 0,009[34] |
| Hering | 0,009[34] |
| Muttermilch | 0,019[24] |
| Ziegenmilch | 0,004[24] |
| Kuhmilch | 0,001[24] |
| Parmesankäse | 1–2,7[34] |
| Roquefort-Käse | 1,280[34] |
| Gruyère-Käse | 1,050[34] |
| Stilton-Käse | 0,820[34] |
| Cabrales-Käse | 0,760[34] |
| Danablu-Käse | 0,670[34] |
| Gouda-Käse | 0,460[34] |
| Camembert-Käse | 0,390[34] |
| Emmentaler-Käse | 0,308[24] |
| Cheddar-Käse | 0,182[24] |
| Lebensmittel pflanzlichen oder pilzigen Ursprungs | Glutamat Massenanteil in % |
|---|---|
| Tomate, getrocknet | 0,648[34] |
| Grüntee | 0,450[34] |
| Tomate | 0,246[24] |
| Kartoffel, gekocht | 0,180[34] |
| Kartoffel | 0,102[34] |
| Mais | 0,130[34] |
| Brokkoli | 0,115[34] |
| Erbse | 0,106[24] |
| Lotoswurzel | 0,103[34] |
| Knoblauch | 0,099[34] |
| Chinakohl | 0,094[34] |
| Sojabohne | 0,066[34] |
| Zwiebel | 0,051[24] |
| Weißkohl | 0,050[24] |
| Spargel, grün | 0,049[24] |
| Spinat | 0,048[34] |
| Kopfsalat | 0,046[34] |
| Blumenkohl | 0,046[34] |
| Spargel, weiß | 0,036[34] |
| Grüntee, geröstet | 0,022[34] |
| Zucchini | 0,011[34] |
| Paprika, grün | 0,008[34] |
| Salatgurke | 0,001[34] |
| Shiitake, getrocknet | 1,060[34] |
| Shiitake | 0,071[24] |
| Champignon | 0,042[34] |
| Trüffel | 0,009[34] |
| Walnuss | 0,658[34] |
| Erdbeere | 0,045[34] |
| Apfelsaft | 0,021[34] |
| Birne | 0,020[34] |
| Avocado | 0,018[24] |
| Kiwi | 0,005[24] |
| Weintraube, rot | 0,005[24] |
| Apfel | 0,004[24] |
| Kombu, getrocknet | 1,4–3,2[34] |
| Nori | 1,378[34] |
| Wakame | 0,009[24] |
| Lebensmittel nach Fermentation | Glutamat Massenanteil in % |
|---|---|
| Sojasauce, koreanisch | 1,264[24] |
| Sojasauce, chinesisch | 0,926[24] |
| Sojasauce, japanisch | 0,782[24] |
| Soumbala | 1,700[24] |
| Douchi (schwarze Bohnen) | 1,080[34] |
| Miso | 0,5–1[34] |
| Tempeh | 0,985[34] |
| Natto | 0,136[24] |
| Sake | 0,186[34] |
| Anchovi | 1,200[34] |
| Fischsauce, japanisch | 1,383[24] |
| Fischsauce, vietnamesisch | 1,370[24] |
| Fischsauce, thailändisch | 0,950[24] |
| Fischsauce, chinesisch | 0,828[24] |
| Garum | 0,623[34] |
Ribonucleotide in Lebensmitteln
| Lebensmittel tierischen Ursprungs | IMP Massenanteil in % | GMP Massenanteil in % | AMP Massenanteil in % |
|---|---|---|---|
| Rindfleisch | 0,070[24] | 0,004[24] | 0,008[24] |
| Schweinefleisch | 0,200[24] | 0,002[24] | 0,009[24] |
| Hühnerfleisch | 0,201[24] | 0,005[24] | 0,013[24] |
| Muttermilch | 0,0003[34] | unbekannt[34] | unbekannt[34] |
| Kalmar | unbekannt[24] | unbekannt[24] | 0,184[24] |
| Thunfisch | 0,286[24] | unbekannt[24] | 0,006[24] |
| Lachs | 0,154[34] | Spuren[34] | 0,006[34] |
| Kabeljau | 0,044[34] | unbekannt[34] | 0,023[34] |
| Makrele | 0,215[34] | Spuren[34] | 0,006[34] |
| Jakobsmuschel | unbekannt[24] | unbekannt[24] | 0,172[24] |
| Hummer | Spuren[34] | Spuren[34] | 0,082[34] |
| Garnele | 0,092[34] | Spuren[34] | 0,087[34] |
| Krabbe | 0,005[34] | 0,005[34] | 0,032[34] |
| Anchovi | 0,300[34] | 0,005[34] | unbekannt[34] |
| Sardine | 0,193[34] | unbekannt[34] | 0,006[34] |
| Seeigel | 0,002[34] | 0,002[34] | 0,010[34] |
| Lebensmittel pflanzlichen oder pilzigen Ursprungs | IMP Massenanteil in % | GMP Massenanteil in % | AMP Massenanteil in % |
|---|---|---|---|
| Tomate | unbekannt[24] | unbekannt[24] | 0,021[24] |
| Tomate, getrocknet | Spuren[34] | 0,010[34] | unbekannt[34] |
| Kartoffel, gekocht | Spuren[34] | 0,002[34] | 0,004[34] |
| Erbse | unbekannt[24] | unbekannt[24] | 0,002[24] |
| Spargel, grün | Spuren[34] | Spuren[34] | 0,004[34] |
| Nori | 0,009[34] | 0,005[34] | 0,052[34] |
| Shiitake, getrocknet | unbekannt[24] | 0,150[24] | unbekannt[24] |
| Steinpilz, getrocknet | unbekannt[24] | 0,010[24] | unbekannt[24] |
| Austernpilz, getrocknet | unbekannt[24] | 0,010[24] | unbekannt[24] |
| Morchel, getrocknet | unbekannt[24] | 0,040[24] | unbekannt[24] |
| Enoki | unbekannt[34] | 0,022[34] | unbekannt[34] |
Geschichte
Bereits im fünften Jahrhundert vor unserer Zeitrechnung beschrieb Konfuzius die Verwendung eines fermentierten Würzmittels aus Fleisch, Getreiden, Salzwasser und Ethanol in China.[35] Ab etwa 200 v.u.Z kamen zur Würzung fermentierte Sojabohnen in Gebrauch.[35] Im antiken Rom wurde eine als Garum oder Liquamen bezeichnete Würzsauce, die auch fermentierten Fisch enthielt, ab etwa dem Jahr 200 v.u.Z eingesetzt.[35][36] Seit dem 15. Jhdt. wird in Südostasien die würzige Fischsauce alltäglich verwendet.[35]

Die Bezeichnung umami geht zurück auf den japanischen Chemiker Kikunae Ikeda, der aufgrund eigener Geschmackserlebnisse neben den vier Empfindungsvermögen für Ausprägungen des Süßen, Sauren, Salzigen und Bitteren einer Speise noch eine fünfte Grundqualität des Geschmacks vermutete.[37] 1909 schlug er „Umami“ als Benennung für diese vor, nachdem er als deren wesentlichen Geschmacksträger Glutaminsäure identifiziert hatte – im Extrakt von Kombu, einer aus Japanischem Blatttang (Laminaria japonica) hergestellten Komponente des traditionellen Dashi.[38]
Noch im gleichen Jahr begannen Ikeda und ein Geschäftspartner mit der industriellen Produktion von Mononatrium-L-glutamat, gewonnen aus dem Hydrolysat von Weizenproteinen. Das Gluten wurde hierfür unter Einwirkung von Salzsäure hydrolysiert und in seine Aminosäuren aufgespalten, zu über einem Drittel Glutamin und Glutaminsäure. Das kristallisierte Salz der Glutaminsäure brachten sie als streufähiges Würzmittel auf den Markt unter dem Handelsnamen „Aji-no-moto“ (味の素 ‚Essenz des Geschmacks‘). Es fand im ostasiatischen Raum wachsenden Zuspruch, ähnlich wie zuvor „Maggi“ in Mitteleuropa. Aus dem Unternehmen ging ein Konzern hervor, der seit 1946 Ajinomoto heißt und heute weltweit agiert.[33] Die ergänzende Wirkung von Purinnukleotiden wie Inosinmonophosphat wurde erstmals 1913 von Shintaro Kodama in Extrakten von Bonitoflocken beschrieben.[39]
Literatur
- Michael Anthony, Heston Blumenthal, Alexandre Bourdas, Virgilio Martínez Véliz, David Kinch: Umami. Kodansha USA, 2014, ISBN 978-4-88996-391-5.
- Heiko Antoniewicz, Michael Podvinec, Nikolai Wojtko: Umami. Tre Torri, Wiesbaden 2018, ISBN 978-3-96033-044-8.
- Q. Chen, S. Alarcon, A. Tharp, O. Ahmed, N. Estrella, T. Greene, J. Rucker, P. Breslin: Perceptual variation in umami taste and polymorphisms in TAS1R taste receptor genes. In: American Journal of Clinical Nutrition. Band 90, Nr. 3, September 2009, S. 770–779; doi:10.3945/ajcn.2009.27462N, PMC 3136006 (freier Volltext).
Einzelnachweise
- Ole G. Mouritsen, Klavs Styrbæk: Umami. Columbia University Press, 2014, ISBN 978-0-231-16890-8. S. 2, 26, 222.
- Stefan Silbernagl, Agamemnon Despopoulos: Taschenatlas Physiologie. 8. Auflage. Thieme, Stuttgart 2012, ISBN 978-3-13-567708-8, S. 360 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Imamura, K. Matsushima: Suppression of umami aftertaste by polysaccharides in soy sauce. In: Journal of food science. Band 78, Nummer 8, August 2013, S. C1136–C1143, doi:10.1111/1750-3841.12195, PMID 23957398.
- F. Laugerette u. a.: CD36 involvement in orosensory detection of dietary lipids, spontaneous fat preference, and digestive secretions. In: J Clin Invest. 115, Nr. 11, 2005, S. 3177–3184, ISSN 0021-9738 PMC 1265871 (freier Volltext).
- Sadaf Shadan: A taste of umami. In: Nature. 457, 2009, S. 160, doi:10.1038/457160a.
- K. Yasumatsu, T. Manabe, R. Yoshida, K. Iwatsuki, H. Uneyama, I. Takahashi, Y. Ninomiya: Involvement of multiple taste receptors in umami taste: analysis of gustatory nerve responses in metabotropic glutamate receptor 4 knockout mice. In: Journal of Physiology. Band 593, Nr. 4, Februar 2015, S. 1021–1034; doi:10.1113/jphysiol.2014.284703, PMC 4398535 (freier Volltext).
- X. Li u. a.: Human receptors for sweet and umami taste. In: Proc. Natl. Acad. Sci. U.S.A. 99(7), 2002, S. 4692–4696. PMID 11917125. (PDF).
- M. Zhao, X. Q. Xu, X. Y. Meng, B. Liu: The Heptahelical Domain of the Sweet Taste Receptor T1R2 Is a New Allosteric Binding Site for the Sweet Taste Modulator Amiloride That Modulates Sweet Taste in a Species-Dependent Manner. In: Journal of molecular neuroscience : MN. [elektronische Veröffentlichung vor dem Druck] August 2018, doi:10.1007/s12031-018-1156-5, PMID 30120716.
- H. Xu, L. Staszewski, H. Tang, E. Adler, M. Zoller, X. Li: Different functional roles of T1R subunits in the heteromeric taste receptors. In: Proceedings of the National Academy of Sciences. Band 101, Nummer 39, September 2004, S. 14258–14263, doi:10.1073/pnas.0404384101, PMID 15353592, PMC 521102 (freier Volltext).
- T. Ohsu, Y. Amino, H. Nagasaki, T. Yamanaka, S. Takeshita, T. Hatanaka, Y. Maruyama, N. Miyamura, Y. Eto: Involvement of the calcium-sensing receptor in human taste perception. In: Journal of Biological Chemistry. Band 285, Nummer 2, Januar 2010, S. 1016–1022, doi:10.1074/jbc.M109.029165, PMID 19892707, PMC 2801228 (freier Volltext).
- (Österreichisches) Bundesministerium für Gesundheit (Hrsg.): Entwicklung im Bereich von Zusatzstoffen, Aromen und Enzymen. Teil 2, März 2016, S. 98ff. (PDF).
- Patrick Etiévant, Elisabeth Guichard, Christian Salles, Andrée Voilley: Flavor: From Food to Behaviors, Wellbeing and Health. Woodhead Publishing, 2016, ISBN 0081003005, S. 106.
- U. Masic, M. R. Yeomans: Umami flavor enhances appetite but also increases satiety. In: The American journal of clinical nutrition. Band 100, Nummer 2, August 2014, S. 532–538, doi:10.3945/ajcn.113.080929, PMID 24944058.
- K. Kurihara: Umami the Fifth Basic Taste: History of Studies on Receptor Mechanisms and Role as a Food Flavor. In: BioMed research international. Band 2015, 2015, S. 189402, doi:10.1155/2015/189402, PMID 26247011, PMC 4515277 (freier Volltext).
- H. N. Lioe, J. Selamat, M. Yasuda: Soy sauce and its umami taste: a link from the past to current situation. In: Journal of food science. Band 75, Nummer 3, April 2010, S. R71–R76, doi:10.1111/j.1750-3841.2010.01529.x, PMID 20492309.
- Y. Zhang, C. Venkitasamy, Z. Pan, W. Liu, L. Zhao: Novel Umami Ingredients: Umami Peptides and Their Taste. In: Journal of food science. Band 82, Nummer 1, Januar 2017, S. 16–23, doi:10.1111/1750-3841.13576, PMID 27926796.
- Hans-Dieter Belitz, Werner Grosch: Lehrbuch der Lebensmittelchemie. Springer-Verlag, 2007, ISBN 978-3-540-73202-0, S. 442.
- Waldemar Ternes, Alfred Täufel, Lieselotte Tunger, Martin Zobel: Lebensmittel-Lexikon. 4., umfassend überarbeitete Auflage. Behr, Hamburg 2005, ISBN 3-89947-165-2.
- G. K. Beauchamp: Sensory and receptor responses to umami: an overview of pioneering work. In: The American journal of clinical nutrition. Band 90, Nummer 3, September 2009, S. 723S–727S, doi:10.3945/ajcn.2009.27462E, PMID 19571221.
- E. T. Rolls: Functional neuroimaging of umami taste: what makes umami pleasant? In: The American journal of clinical nutrition. Band 90, Nummer 3, September 2009, S. 804S–813S, doi:10.3945/ajcn.2009.27462R, PMID 19571217.
- F. Zhang, B. Klebansky, R. M. Fine, H. Xu, A. Pronin, H. Liu, C. Tachdjian, X. Li: Molecular mechanism for the umami taste synergism. In: Proceedings of the National Academy of Sciences. Band 105, Nummer 52, Dezember 2008, S. 20930–20934, doi:10.1073/pnas.0810174106, PMID 19104071, PMC 2606899 (freier Volltext).
- S. Yamaguchi, K. Ninomiya: Umami and Food Palatability. In: Journal of Nutrition. 130, 2000, S. 921S-126S. PMID 10736353 (PDF)
- T. Yasuo, Y. Kusuhara, K. Yasumatsu, Y. Ninomiya: Multiple receptor systems for glutamate detection in the taste organ. In: Biological & pharmaceutical bulletin. Band 31, Nummer 10, Oktober 2008, S. 1833–1837, PMID 18827337.
- Shizuko Yamaguchi, Kumiko Ninomiya: Umami and Food Palatability. In: The Journal of Nutrition. 130, 2000, S. 921S–926S, doi:10.1093/jn/130.4.921S.
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto jr., Lubert Stryer: Stryer Biochemie. Springer-Verlag, 2017, ISBN 978-3-662-54620-8, S. 35–41.
- Kumiko Ninomiya: Natural occurrence. In: Food Reviews International. 14, 1998, S. 177–211, doi:10.1080/87559129809541157.
- Thomas Vilgis: Kochuniversität – Geschmack. Tre Torri Verlag, Wiesbaden 2010, S. 75 f.
- P. Hajeb, S. Jinap: Umami taste components and their sources in Asian foods. In: Critical reviews in food science and nutrition. Band 55, Nummer 6, 2015, S. 778–791, doi:10.1080/10408398.2012.678422, PMID 24915349.
- C. Agostoni, B. Carratù, C. Boniglia, E. Riva, E. Sanzini: Free amino acid content in standard infant formulas: comparison with human milk. In: J Am Coll Nutr. Band 19(4), 2000, S. 434–438. PMID 10963461.
- Hans Konrad Biesalski: Mikronährstoffe als Motor der Evolution. Springer-Verlag, 2015, ISBN 978-3-642-55397-4, S. 164.
- Ian Humphery-Smith, Michael Häcker: Microbial proteomics: functional biology of whole organisms. Band 49, John Wiley and Sons, 2006, ISBN 0-471-69975-6, S. 138.
- Eva Derndorfer: Lebensmittelsensorik. Facultas Verlag, 2010, ISBN 978-3-7089-0588-4, S. 33.
- Chiaki Sano: History of glutamate production American Society for Nutrition. Report der American Society for Nutrition.
- Ole G. Mouritsen, Klavs Styrbæk: Umami. Columbia University Press, 2014, ISBN 978-0-231-16890-8. S. 226–231.
- Yoshiko Yoshida: Umami taste and traditional seasonings. In: Food Reviews International. 14, 1998, S. 213–246, doi:10.1080/87559129809541158.
- Miro Smriga, Toshimi Mizukoshi, Daigo Iwahata, Sachise Eto, Hiroshi Miyano, Takeshi Kimura, Robert I. Curtis: Amino acids and minerals in ancient remnants of fish sauce (garum) sampled in the “Garum Shop” of Pompeii, Italy. In: Journal of Food Composition and Analysis, 2010. Band 23, Heft 5, S. 442–446.
- E. Nakamura: One hundred years since the discovery of the "umami" taste from seaweed broth by Kikunae Ikeda, who transcended his time. In: Chemistry, an Asian journal. Band 6, Nummer 7, Juli 2011, S. 1659–1663, doi:10.1002/asia.201000899, PMID 21472994.
- K. Ikeda: New seasonings. (japan.) In: Journal of the Chemical Society of Tokyo. Band 30, 1909, S. 820–836. Englische teilweise Übersetzung in Chemical Senses. Band 27, Nr. 9, November 2002, S. 847–849; doi:10.1093/chemse/27.9.847, PMID 12438213.
- S. Kodama: On a procedure for separating inosinic acid. In: Journal of the Tokyo Chemical Society, 1913, Band 34, S. 371–376.