Transmembranprotein
Transmembranproteine sind eine Gruppe der Membranproteine und durchqueren beide Blätter der Phospholipiddoppelschicht einer Biomembran, im Unterschied zu den einfach membranständigen Proteinen. Zu den Transmembranproteinen gehören funktionell sehr verschiedene Proteine wie zum Beispiel Transmembranrezeptoren, Porine, Ionenkanäle, Transporter, ATP-abhängige Pumpen und Zelladhäsionsmoleküle. Sie können in der Plasmamembran oder in der Membran eines Organells verankert sein und lassen sich nach ihren die Membran durchquerenden Proteinanteilen, der Transmembrandomäne, strukturell klassifizieren.
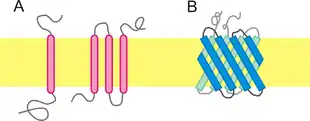
(A) α-helicale Domänen (rot) im singlepass (links) und im multipass
(B) β-Fass-Domänen (blau)
Um die Lipiddoppelschicht zu durchdringen, muss eine Polypeptidkette hydrophobe Seitenketten besitzen und ihre polare Rückgratgruppe abschirmen. Dies wird unter anderem durch die Bildung einer Sekundärstruktur erreicht, die zur Bildung von Wasserstoffbrückenbindungen beiträgt. Alle bekannten Transmembran-Segmente bestehen daher entweder aus α-Helices (sehr häufig) oder β-Fässern (selten).[1] Die vollständige Struktur ist nur bei wenigen Membranproteinen bekannt.[2]
Dabei wird unterschieden zwischen den Singlepass-Transmembranproteinen, die die Membran nur einmal durchqueren, und den Multipass-Transmembranproteinen, die die Membran mehrmals durchqueren. Die Singlepass-Transmembranproteine werden weiter unterschieden in verschiedene Typen nach Art der Verankerung und der Lage ihrer Enden. Der N-Terminus liegt extrazellulär bei Typ-1-Transmembranproteinen, die in der Zellmembran verankert sind. Bei Typ-2-Transmembranproteinen liegt hier dagegen der C-Terminus extrazellulär.
Hydrophobizität
Transmembranproteine sind im Transmembranbereich (Transmembrandomäne von etwa acht bis zwölf Aminosäuren) gehäuft aus den weniger polaren bzw. hydrophoberen Aminosäuren aufgebaut, die mit den Lipiden der Membran eine Protein-Lipid-Interaktion eingeht.
Einzelnachweise
- D. Voet, J. Voet, C. Pratt: Lehrbuch der Biochemie. 2. Auflage. Wiley-VCH, Weinheim 2010, ISBN 978-3-527-32667-9, S. 290f.
- B. Alberts u. a.: Lehrbuch der Molekularen Zellbiologie. 4. Auflage. Wiley, 2012, ISBN 978-3-527-32824-6, S. 403.