Nitrotoluole
Die Nitrotoluole bilden eine Stoffgruppe in der Chemie und sind aromatische Verbindungen mit einer Methylgruppe (–CH3) und einer Nitrogruppe (–NO2) als Substituenten am Benzolring. Durch unterschiedliche Anordnung der Substituenten (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C7H7NO2. Das Stoffgemisch entsteht bei der Nitrierung von Toluol, wobei 2- und 4-Nitrotoluol die Hauptprodukte sind. Nitrotoluole treten als Zwischenprodukte bei der TNT-Herstellung auf und können deshalb oft als Rüstungsaltlast im Boden und Grundwasser nachgewiesen werden.
Vertreter
| Nitrotoluole | ||||||||||||
| Name | 2-Nitrotoluol | 3-Nitrotoluol | 4-Nitrotoluol | |||||||||
| Andere Namen | o-Nitrotoluol, 2-Nitro-1-methylbenzol, ONT, 2-NT |
m-Nitrotoluol, 3-Nitro-1-methylbenzol |
p-Nitrotoluol, 4-Nitro-1-methylbenzol | |||||||||
| Strukturformel | 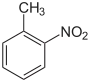 |
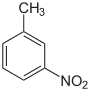 |
||||||||||
| CAS-Nummer | 88-72-2 | 99-08-1 | 99-99-0 | |||||||||
| PubChem | 6944 | 7422 | 7473 | |||||||||
| Summenformel | C7H7NO2 | |||||||||||
| Molare Masse | 137,14 g·mol−1 | |||||||||||
| Aggregatzustand | flüssig | fest | ||||||||||
| Kurzbeschreibung | gelbe ölige Flüssigkeit mit aromatischem Geruch[1] |
gelbe Flüssigkeit mit charakteristischem Geruch[2] |
gelbliche Kristalle[3] | |||||||||
| Schmelzpunkt | −4 °C[1] | 16 °C[2] | 52 °C[3] | |||||||||
| Siedepunkt | 222 °C[1] | 232 °C[2] | 238 °C[3] | |||||||||
| Löslichkeit | praktisch unlöslich in Wasser, löslich in Aceton, Benzol, Ethanol, Ether und Chloroform | |||||||||||
| GHS- Kennzeichnung |
|
|
| |||||||||
| H- und P-Sätze | 302‐340‐350‐361f‐411 | 302‐311‐332‐373‐411 | 301+311+331‐373‐411 | |||||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||||||
| 201‐202‐264‐273‐301+312‐308+313 | 280‐273‐309+310 302+352 |
261‐273‐280‐301+310‐311 | ||||||||||
| MAK-Wert | Schweiz: 2 ml·m−3 bzw. 11 mg·m−3[4] | |||||||||||
Darstellung
Bei der elektrophilen aromatischen Substitution von Toluol mit Salpetersäure ist der +I-Effekt der Methylgruppe für die Stellung des Zweitsubstituenten ausschlaggebend. Als Hauptprodukte entstehen 2-Nitrotoluol (ortho) mit 65 % und 4-Nitrotoluol (para) mit 30 %, 3-Nitrotoluol (meta) dagegen nur zu 5 %.[5]
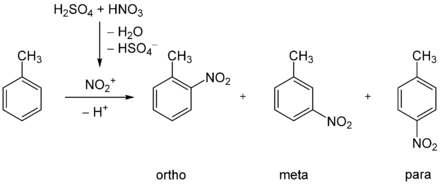
Das 3-Nitrotoluol ist aus 3-Nitro-4-aminotoluol zugänglich, indem man die Aminogruppe diazotiert und das entstandene Diazoniumsalz reduktiv mit Ethanol umsetzt (Dediazonierung).[6]
Eigenschaften
Die Siedepunkte der drei Isomere liegen nah beieinander, während sich die Schmelzpunkte deutlich unterscheiden. Das 4-Nitrotoluol, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Verwendung
Die Nitrotoluole sind Zwischenprodukte bei der Herstellung von Toluidinen, bei der organischen Synthese von Pestiziden, Arznei-, Farb- und Kunststoffen.
2- und 4-Nitrotoluol sind Zwischenprodukte bei der TNT-Herstellung, sie werden zunächst zu 2,4-Dinitrotoluol weiternitriert. 2- und 4-Nitrotoluol werden außerdem Plastiksprengstoffen als Markierungsstoff zugesetzt.[7]
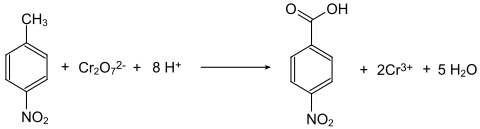
Generell sind die Nitrobenzoesäuren aus den Nitrotoluolen durch Oxidation der Methylgruppe zugänglich. So wird z. B. 4-Nitrotoluol durch Natriumdichromat in Gegenwart von konzentrierter Schwefelsäure zur 4-Nitrobenzoesäure oxidiert.[8]
Sicherheitshinweise
Die Nitrotoluole können explosive Dämpfe bilden, greifen Gummi und Kunststoffe an und sind krebserregend.
Weblinks
- seilnacht.com: Toluol.
- Versuchsvorschrift: Nitrierung von Toluol zu 2-Nitrotoluol, 4-Nitrotoluol und 2,4-Dinitrotoluol (PDF) der Sammlung Integriertes Organisch-chemisches Praktikum der Universität Regensburg, abgerufen am 12. März 2017.
Einzelnachweise
- Eintrag zu 2-Nitrotoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. November 2021. (JavaScript erforderlich)
- Eintrag zu 3-Nitrotoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juni 2018. (JavaScript erforderlich)
- Eintrag zu 4-Nitrotoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juni 2018. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Nitrotoluol (3- und 4-Isomer)), abgerufen am 4. März 2020.
- Beyer / Walter: Lehrbuch der Organischen Chemie; 19. Auflage; S. Hirzel Verlag; Stuttgart 1981; ISBN 3-7776-0356-2; S. 456.
- H. T. Clarke, E. R. Taylor: m-Nitrotoluene In: Organic Syntheses. 3, 1923, S. 91, doi:10.15227/orgsyn.003.0091; Coll. Vol. 1, 1941, S. 415 (PDF).
- Jehuda Yinon: Forensic and Environmental Detection of Explosives. John Wiley & Sons, 1999, ISBN 978-0-471-98371-2, S. 167 (eingeschränkte Vorschau in der Google-Buchsuche).
- O. Kamm, A. O. Matthews: p-Nitrobenzoic acid In: Organic Syntheses. 2, 1922, S. 53, doi:10.15227/orgsyn.002.0053; Coll. Vol. 1, 1941, S. 392 (PDF).



