Nitroniumion
Das Nitroniumion (oder Nitryl-Kation) NO2+ ist ein unter gewöhnlichen Bedingungen instabiles Kation, das durch Entfernung eines Elektrons aus dem paramagnetischen Stickstoffdioxid, oder durch Protonierung und anschließende Eliminierung von Wasser aus der Salpetersäure gebildet wird.
Trotz seiner Instabilität wird es vielseitig bei der elektrophilen Substitution anderer, insbesondere organischer Verbindungen, verwendet, vor allem in der Nitrierung von Aromaten.[1] Das Ion wird in situ gebildet, durch das Mischen von Salpetersäure und Schwefelsäure. Dabei läuft folgende Reaktion ab:
Das Nitroniumion existiert weiterhin in fester Form als Distickstoffpentoxid, N2O5, ein ionischer Feststoff bestehend aus Nitronium- und Nitrationen. Die flüssigen oder gasförmigen Formen sind allerdings immer molekular gebaut und enthalten somit keine Nitroniumionen. Einige Nitroniumsalze mit Anionen geringer Nukleophilie, wie beispielsweise Nitroniumtetrafluoroborat oder Nitroniumperchlorat (NO2+ClO4−) können isoliert werden, sind aber sehr reaktiv.
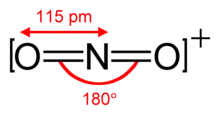
Das Nitroniumion ist isoelektronisch zu Kohlenstoffdioxid und besitzt ebenfalls die lineare Struktur mit einem ONO-Bindungswinkel von 180°.
Verwandte Spezies
Die Verbindungen Nitrylfluorid, NO2F, und Nitrylchlorid, NO2Cl, sind keine Nitroniumsalze, sondern molekulare Verbindungen, wie die niedrigen Siedepunkte (−72 °C beziehungsweise −6 °C), sowie die kurzen Stickstoff-Halogen-Bindungslängen zeigen (N-F 135 pm, N-Cl 184 pm).[2]
Die Addition eines Elektrons lässt ein neutrales Nitryl-Radikal entstehen: •NO2 – eine stabile und bekannte Verbindung: Stickstoffdioxid. Dieses steht mit seinem Dimer, dem Distickstofftetroxid (N2O4), in einem temperatur- und druckabhängigen Gleichgewicht. N2O4 liegt nicht als Radikal vor.
Die zugehörige negative geladene Spezies ist NO2−, das Nitrition.
Einzelnachweise
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 220–221, ISBN 3-211-81060-9.
- F. A.Cotton and G. Wilkinson: Advanced Inorganic Chemistry. 5th edition (1988), Wiley, S. 333.