Axiale Chiralität
Axiale Chiralität ist in der Chemie ein Spezialfall der Chiralität, bei der das Molekül kein chirales Zentrum, sondern eine Chiralitätsachse aufweist.
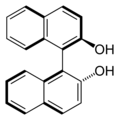 (R)-BINOL: Die Chiralitätsachse entspricht der Bindung zwischen den beiden Naphthylsystemen
(R)-BINOL: Die Chiralitätsachse entspricht der Bindung zwischen den beiden Naphthylsystemen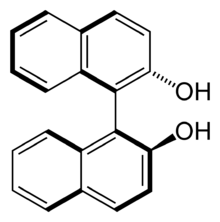 (S)-BINOL
(S)-BINOL-(%E2%80%93)-trans-Cyclooctene_Structural_Formula_V.1.svg.png.webp) (R)-(–)- trans-Cycloocten
(R)-(–)- trans-Cycloocten
Andere Namen:
(P)-(–)-trans-Cycloocten und
(–)-(E)-Cycloocten-(%252B)-trans-Cyclooctene_Structural_Formula_V.1.svg.png.webp) (S)-(+)- trans-Cycloocten
(S)-(+)- trans-Cycloocten
Andere Namen:
(M)-(+)-trans-Cycloocten und
(+)-(E)-Cycloocten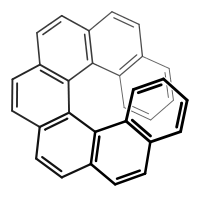 (P)-Helizität
(P)-Helizität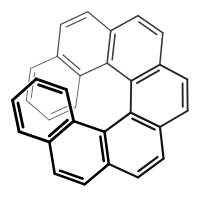 (M)-Helizität
(M)-Helizität (P)-Helizität einer Wendeltreppe im Vatikan-Museum
(P)-Helizität einer Wendeltreppe im Vatikan-Museum.jpg.webp) (M)-Helizität eines Spiegelbilds des Originals der Wendeltreppe im Vatikan-Museum
(M)-Helizität eines Spiegelbilds des Originals der Wendeltreppe im Vatikan-Museum
Vorkommen
Axiale Chiralität kommt bei atropisomeren Biarylsystemen vor, deren Rotation um die Aryl-Aryl-Bindung gehindert ist, sowie bei Dihydroanthracenon-Verbindungen.[1] Die Erscheinung wurde 1922 zum ersten Mal bei der 6,6’-Dinitrodiphensäure nachgewiesen.[2]
Des Weiteren weisen Allen-Verbindungen und Kumulene mit einer geraden Anzahl kumulierter Doppelbindungen bei unsymmetrischer Substitution axiale Chiralität auf (z. B. Propadien-Derivate). Spiroverbindungen können ebenfalls axiale Chiralität aufweisen.[3]
Auch einige trans-Cycloalkene können axial-chiral sein, beispielsweise gibt es von trans-Cycloocten zwei Enantiomere.[4] Allerdings ist die Klassifizierung als axial-chiral bei trans-Cycloalkenen umstritten.[5]
Helicale Moleküle wie beispielsweise die Helicene sind axialchiral. Aufgrund sterischer Hinderung liegen die kondensierten Benzolringe schraubenförmig um eine Achse angeordnet und können nicht in ihr Spiegelbild übergehen. Diese Art der axialen Chiralität nennt man auch Helizität.
Beispiel für die axiale Chiralität bei gesättigten, polycyclischen Kohlenwasserstoffen ist das Trinorbornan.
Die Enantiomere axial-chiraler Verbindungen werden mit den stereochemischen Deskriptoren (R) und (S), in komplizierteren Fällen auch Ra und Sa gekennzeichnet, wobei der Index „a“ für „axial“ steht. Auch die Plus (P)-/ Minus (M)-Notation ist gebräuchlich.[6]
Anwendung
Axial-chirale Liganden mit C2-Symmetrie wie BINAP [2,2'–Bis(diphenylphosphino)–1,1'–binaphthyl] werden in der enantioselektiven homogenen Katalyse eingesetzt. Durch den Einsatz geeigneter Ring-Substituenten lassen sich die sterischen und elektronischen Effekte variieren.[7][8]
Literatur
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Thieme Verlag, Stuttgart, 2005. ISBN 3135415058. (Eingeschränkte Vorschau in der Google-Buchsuche), S. 249.
Weblinks
Einzelnachweise
- Absolute stereochemistry of fungal metabolites: Icterinoidins A1 and B1, and atrovirins B1 and B2. Melvyn Gill and Peter M. Morgan Arkivoc (RI-1154C) 2004 Online Artikel.
- J. Kenner, W. V. Stubbings; A Second Form of 6,6’-Dinitrophenic Acid and its conversion into New Cyclic Systems, Journal of the Chemical Society 119 (1921) 593.
- Bernhard Testa: Grundlagen der Organischen Stereochemie, Verlag Chemie, Weinheim, 1983, S. 59–61, ISBN 3-527-25935-X.
- Bernhard Testa: Grundlagen der Organischen Stereochemie, Verlag Chemie, Weinheim, 1983, S. 64–65, ISBN 3-527-25935-X.
- Ernest L. Eliel, Samuel H. Wilen: Stereochemistry of Organic Compounds, John Wiles & Sons, 1994, S. 1172–1175, ISBN 0-471-05446-1.
- Eintrag zu axial chirality. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00547 – Version: 2.1.5.
- R. Noyori, Nobelpreisvortrag, 8. Dezember 2001.
- P. J. Walsh, M. C. Kozlowski: Fundamentals of asymmetric catalysis. Verlag University Science, S. 614 (Auszug in der Google-Buchsuche).