Quorum sensing
Als Quorum sensing wird die Fähigkeit von Einzellern bezeichnet, über chemische Kommunikation mittels hoch spezifischer Signalmoleküle die Zelldichte der Population der eigenen Art und die Komplexität der Gemeinschaft messen zu können. Auch der Kontakt der Bakterien mit höheren Lebewesen wird über QS reguliert. Bakterien können über QS schnell auf Veränderungen ihrer Umgebung reagieren, um das Überleben der Population zu sichern, Vorteile gegenüber Konkurrenten zu erlangen und um neue geeignete ökologische Nischen zu erschließen. Dabei können sie gezielt die Kommunikation anderer Bakterien stören. Das QS-System erlaubt den Mikroorganismen, sich geschützt in der Gemeinschaft, in Biofilmen, bis zu einer kritischen Zellzahl zu vermehren, um dann den Phänotyp der Population gemeinsam zu ändern. Dabei werden Gene nur dann aktiviert, wenn eine bestimmte Zelldichte, das Quorum, über- oder unterschritten wird.
| Übergeordnet |
| Homöostase der Zellanzahl in freilebenden Populationen |
| Untergeordnet |
| Interspezies-Q.S. Intraspezies-Q.S. |
| Gene Ontology |
|---|
| QuickGO |
An sich stammt der Begriff „Quorum“ aus der Zeit des römischen Reiches und bezeichnete im Senat die für eine Abstimmung benötigte geringste Zahl an Mitgliedern.
Entdeckung des QS-Systems
Das Phänomen des QS-Systems beschrieben erstmals die Wissenschaftler Kenneth Nealson, Terry Platt, und J. Woodland Hastings, als sie im Jahr 1970 an marinen biolumineszierenden Bakterien die Biolumineszenz untersuchten. Die Untersuchungen führten sie an in Kultur gehaltenen Bakterien, den Aliivibrio fischeri durch, die natürlicherweise symbiontisch in den Leuchtorganen der Tiefseefische leben. Aliivibrio fischeri (ehemals Photobacterium fischeri) biolumineszierte kurze Zeit während der exponentiellen Wachstumsphase in Suspension. Dieses Phänomen bezogen die Wissenschaftler auf eine Konditionierung des Mediums. Die damit verbundene Aktivierung der Gene induzierte die Bakterienpopulation selbst. Die Arbeitsgruppe prägte daraufhin den Begriff der Autoinduktion.[1] An der Erforschung des Quorum sensing in den 1990er Jahren war die amerikanische Professorin Bonnie L. Bassler maßgeblich beteiligt, die dafür mit Michael R. Silverman 2021 den Paul-Ehrlich-und-Ludwig-Darmstaedter-Preis erhielt. Der Begriff wurde durch Fuqua, Winans und Greenberg geprägt.[2]
Funktionen des QS-Systems
Quorum sensing wird von Bakterien genutzt, um Prozesse zu koordinieren, die ineffizient wären, wenn sie nur von einzelnen Zellen durchgeführt würden, z. B. Biolumineszenz, die Bildung von Biofilmen, die Sekretion von Antibiotika und Pathogenitätsfaktoren, die Fruchtkörperbildung bei Myxobakterien, die Sporulation bei Bacillus subtilis, die Infektion von Pflanzen[3] und anderen eukaryotischen Wirten[4] und die Beteiligung von Bakterien an Ökosystemen wie beispielsweise dem Korallenriff.[5] Durch QS wird das Verhalten der Bakterien einer Art auf engstem Raum koordiniert. Pseudomonas aeruginosa, ein Erreger von Lungenentzündung und anderen Infektionen, kann innerhalb seines Wirts leben, ohne ihn zu schädigen. Wenn er sich jedoch stark vermehrt, bilden die Zellen Biofilme, werden pathogen und können zur Erkrankung des Wirts führen.[6]
Die Zell-Zell-Kommunikation beruht auf vier wesentlichen Eigenschaften:
− Synthese der Autoinduktoren,
− Freisetzung und Ausscheidung dieser Autoinduktoren ins Medium,
− Anreichung der Autoinduktoren bis zu einer Schwellenkonzentration und
− Erkennung der Autoinduktoren durch zellspezifische Rezeptoren, die eine Regulation der Genexpression veranlassen.
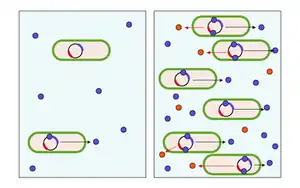
Links: Konzentration an Autoinduktormolekülen (blau) gering,
Rechts: Konzentration an Autoinduktormolekülen hoch, dadurch Synthese des bakterielles Produkt (rot).
Die Autoinduktoren, die kontinuierlich in geringen Konzentrationen von jedem Bakterium in die Umgebung diffundieren, erreichen erst ab einer bestimmten Zelldichte eine ausreichend hohe Schwellenkonzentration, die eine Änderung der bakteriellen Genexpression herbeiführt. Die dabei ausgelöste positive Rückkopplung der Signalmoleküle induziert ihre eigene Synthese. Durch die vollständige Aktivierung der bakteriellen Rezeptoren wird eine schnelle physiologische Antwort erreicht, die zu einem veränderten Phänotyp der Zellen in der Gemeinschaft führt (Abbildung). Auf diese Art wird die für die Biolumineszenz verantwortliche Luciferase induziert.[7] Die Gemeinschaft synchronisiert dabei über QS kollektiv den Phänotyp, ähnlich wie Zellen in mehrzelligen Organismen.[8] Die durch die Signalmoleküle aktivierten Rezeptoren induzieren entweder direkt die Expression der Zielgene oder leiten das Signal über eine Signaltransduktion weiter. Die Genexpression wird letztendlich durch Transkriptionsfaktoren gesteuert, die als molekulare Schalter fungieren.[9]
Die Bedeutung der Autoinduktoren im QS
Die Autoinduktoren sind allgemein frei diffundierende, amphiphile Moleküle, die über die Zellmembran von den Bakterien beständig in kleinen Mengen in die Umgebung abgegeben werden. Bei gramnegativen Bakterien sind dies vorwiegend niedermolekulare Verbindungen, während es sich bei grampositiven Bakterien um Oligopeptide handelt.[10] Über die Konzentration der abgegebenen Signalmoleküle können Bakterien die Populationsdichte und die Komplexität der Gemeinschaft messen und ab einer kritischen Konzentration den Phänotyp der Population verändern. Bakterien können in komplexen Milieus gleichzeitig über verschiedene QS-Systeme mit unterschiedlichen Autoinduktoren kommunizieren und sich im Kollektiv der jeweiligen Situation anpassen. Sie erhalten dadurch gegenüber anderen Bakterien einen Wettbewerbsvorteil.[11] So verwendet das marine Vibrio harveyi für die zwischenartliche Kommunikation und den Austausch zwischen den Gattungen drei unterschiedliche Autoinduktoren. Insgesamt können dabei bis zu 600 Gene reguliert werden.[12][13]
Die sezernierten Autoinduktoren lassen sich aufgrund ihrer chemischen Struktur und ihrer Rezeptoren verschiedenen Gruppen zuordnen:
Autoinduktor-1 (Al-1)
Autoinduktor-1 (Al-1) ist vor allem bei gramnegativen Bakterien vertreten und dient ausschließlich der innerartlichen Kommunikation. Die meisten Bakterien verwenden acylierte Homserinlaktone, (N-Acyl-Homoserinlakton, (AHL)) als Signalmolekül, einige auch Aryl-Homoserinlakton für die interspezifische Kommunikation. Die Synthese geht von der Aminosäure S-Adenosylmethionin aus. Die Länge der Alkylkette des N-Acyl-Homoserinlaktons kann variieren, Modifikationen aufweisen und dadurch zusätzlich die Stabilität sowie die Signaldynamik des Moleküls beeinflussen.[14][15] Die N-Acyl-Homoserinlaktone werden mit Hilfe der bakteriellen Enzyme aus der Familie der LuxI-Synthase, (AHL-Synthase) produziert.[16] Die hydrophoben AHL-Moleküle sind membrangängig und reichern sich in der Umgebung der Bakterien an. Nach Erreichen der Schwellenkonzentration binden AHL an cytoplasmatische Rezeptorproteine der LuxR-Familie und induzieren durch Bindung an die DNA vielfältige biologische Prozesse.[17] Dieses LuxI/LuxR-QS-System mit AHL als Signalmolekül ist für viele gramnegative Bakterien typisch.
Es gibt verschiedene Varianten des Systems, beispielsweise bei Pseudomonas aeruginosa mit dem Autoinduktor N-Butyruyl-L-Homoserinlakton und dem RhlI/RhlR-QS-System und bei Chromobacterium violaceum mit N-Hexanoyl-L-Homoserinlakton und dem Cvil/CviR-QS-System.[18]
Viele Proteobakterien besitzen zusätzlich zu dem LuxI/LuxR-QS-System weitere LuxR- homologe Rezeptoren dabei aber keine Synthasen, die der LuxI-Synthase verwandt sind. Diese Systeme bezeichnet man als LuxI-Solo. Sie ermöglichen Bakterien auf exogen produziertes AHL zu reagieren und damit eine Kommunikation mit anderen artfremden Bakterien einzugehen.[19]
Neben diesen gängigen AHL verwenden einige gramnegative pathogene Bakterien für die Kommunikation mit ihren Wirten andere Signalmoleküle, aber Rezeptoren, die mit dem LuxR-Typ homolog sind. Beispielsweise verwendet das insektenpathogene Photorhabdus luminescens 2-Pyrone oder Photopyrone als Signalmoleküle, die von der Pyronsynthase (Ppys) gebildet werden und an den LuxR-homologen Rezeptor PluR binden. Über dieses PpyS/PluR-QS-System steuert der Erreger die zur Virulenz gehörende Zellverklumpung.[20] Das insektenpathogene und humanpathogene Bakterium Photorhabdus asymbiotica besitzt ebenfalls keine LuxI-Synthase. Dieses Bakterium steuert die Kommunikation über Dialkylresorzinole und Cyclohexandione, die ebenfalls an LuxR-homologe PauR-Rezeptoren binden und damit die Virulenz über das DarA/DarB/DarC/PauR-QS-System regulieren.[21]
Autoinduktor-2 (Al-2)
Autoindutkor-2 (Al-2) kommt in gramnegativen und grampositiven Bakterien verschiedener Taxa vor und ist in die zwischenartliche Kommunikation involviert, aber nicht universell vertreten ist.[22] Chemisch handelt es sich um zyklische Furanosylboratdiester.[23] Ausgehend aus der Vorstufe, dem 4,5-Dihydroxy-2,3-Pentandion (DPD), gebildet durch das LuxS-Enzym, zerfällt DPD in wässriger Lösung in zwei Enantiomere, die sich in einem chemischen Gleichgewicht befinden. 4,5-Dihydorxy-2,3-Pentandion komplexiert mit Bor zum zyklischen Furanosylboratdiester und bildet das Signalmolekül Al-2.[24] Die Synthese von Al-2 scheint ebenfalls über positive Rückkoppelung reguliert zu werden.[25] Bei Vibrio cholerae bindet Al-2 an den periplasmatisch lokalisierten Rezeptor LuxP, der mit der Sensorkinase LuxQ interagiert, die je nach Status des QS-Systems als Kinase oder Phosphatase fungieren kann und damit beispielsweise die Expression der Gene zur Biofilmbildung an- oder ausschaltet.[26] Al-2 liefert Informationen über Stoffwechselaktivitäten der Bakterien in der Umgebung und über deren mikrobielle Besiedlung. In den Bakterienpopulationen von Escherichia coli und Salmonella typhimurium bewirken Milieubedingungen: bevorzugte Kohlenstoffquellen, niedriger pH-Wert und hohe Osmolarität, eine Induktion der Synthese von Al-2, während schlechte Bedingungen, stationäre Wachstumsphase der Bakterienpopulation, aufgebrauchte Kohlenstoffquellen, niedrige Osmolarität und ein veränderter pH-Wert, einen Abbau von Al-2 nach sich ziehen.[27]
Autoinduktor-3 (Al-3)
Autoinduktoren-3 (Al-3) kommen zusätzlich zu anderen Autoinduktoren in verschiedenen pathogenen gramnegativen Bakterien wie beispielsweise in enterohämorrhagischen Escherichia coli, (EHEC), Vibrionen und in grampositiven Erreger wie beispielsweise Staphylococcus aureus vor und werden unter Stressbedingungen induziert. Chemisch handelt es sich bei Vibrio cholerae um verschiedene Pyrazin-Metabolite, wie zum Beispiel 3,5-Dimethylpyrazin-2-ol (DPO), die aus der Aminosäure L-Threonin durch die Threonindehydrogenase gebildet werden. DPO bindet an den zytoplasmatischen LuxR-Rezeptor VqmA. Dieser Signal-Rezeptor-Komplex induziert die Transkription von VqmR einer sRNA, die mehrere mRNAs aus verschiedene QS-Systemen regulieren kann. Während VqmA einerseits die Transkriptionsfaktoren für die Biofilmbindung kontrolliert, können gleichzeitig die Transkriptionsfaktoren für die Gene der Virulenzfaktoren durch VqmA gehemmt werden.[28] Die Autoinduktoren 2,5-Dimethylpyrazin (DMP) und 3,5-disubstituierte Pyrazin-2-ol-Analogon werden aus der Vorstufe Aminoaceton synthetisiert.[29]
Autoinduktorpeptide
Die grampositiven Bakterien verwenden lineare oder zyklische Oligopeptide, Autoinduktorpeptide. Diese sehr heterogene Gruppe der Peptide werden als Präpropeptide synthetisiert und während des aktiven Transports aktiviert. Beispiele für diese Gruppe bilden das Peptidhormon oder autoinduzierendes Peptid (AIP) von Staphylococcus aureus sowie das kompetenzstimulierende Peptid (CSP) von Streptococcus mitis und Streptococcus pneumoniae.[30] Bei Staphylococcus aureus bindet das AIP an den QS-Rezeptor AgrC, einen Transmembranrezeptor mit einer Histidinkinase, die durch Phosphorylierung einen intrazellulären Transkriptionsfaktor aktiviert und damit die Genexpression induziert. Das Signal wird hier über ein Zweikomponentensystem in der Zelle weitergeben. Die vier Komponenten des QS-Systems sind genetisch in einem arg-Operon organisiert.[31]
Verschiedene Autoinduktoren bei pathogenen Bakterien
Das PhcS/PhcRQ-QS-System mit 3-Hydroxypalmitinsäuremethylester als Autoinduktor bei Ralstonia solanacearum, einem pflanzenpathogenen Bakterium führt bei Nutzpflanzen zur Bakteriellen Welke.[32] Xanthomonas campestris ein pflanzenpathogener Vertreter aus der Familie der Xanthomonadaceae, der unter anderem die Schwarzfäule bei Blütenpflanzen verursacht, verwendet für die Zellkommunikation das diffusible signal factor (DSF) Signalmolekül, eine Fettsäure.[33]
QS bei verschiedenen Bakterienarten
Die ersten Organismen, in denen Quorum sensing beobachtet wurde, sind die komplexen Myxobakterien und Spezies aus der Gattung der Streptomyceten. Am bekanntesten ist jedoch die Biolumineszenz von Vibrio fischeri. Freilebende Bakterien dieser Art erreichen nicht dieselbe Konzentration wie innerhalb dieser Organe, weshalb sie dort nicht leuchten. Streptococcus pneumoniae nutzt Quorum sensing, um Kompetenz zu erreichen.
Beim dimorphen Pilz Candida albicans wirkt Farnesol als Quorum-sensing-Molekül. Es hemmt bei hoher Populationsdichte das Hyphenwachstum.
QS bei Streptococcus mutans
Streptococcus mutans gilt als Hauptverursacher von Karies und lebt im menschlichen Zahnbelag. Sein wichtigstes Virulenzmerkmal ist die Bildung eines Polysaccharid-haltigen Biofilms, der für sein Überleben in der Mundflora und für seine Pathogenität entscheidend ist. Das Bakterium produziert Säuren und ist selbst säureresistent. S. mutans steht in ständiger Konkurrenz mit anderen Mikroorganismen in der Zahnflora.[34]
Für S. mutans sind zwei Kommunikationswege beschrieben worden. Al-2 greift in den gesamten Stoffwechsel der Bakterien ein. Einige Gene werden hoch- und andere Genen herunterreguliert. Al-2-abhängige Gene betreffen die Proteinbiosynthese, DNA-Synthese, Regulatoren der Genexpression, Kompetenz von S. mutans sowie Transportproteine. Al-2 informiert die Zelle über die bakterielle Zusammensetzung der Umgebung und die Zelldichte. Zudem wirkt Al-2 bei der Bildung von Multispezies-Biofilmen wie dem Zahnbelag mit.[35]
Daneben existiert in S. mutans ein Intraspezies-Quorum-Sensing-System, das durch das kompetenzstimulierende Signalpeptid (CSP) reguliert wird und die Produktion von Bacteriocinen, Peptidantibiotika, die die Biofilmentwicklung und die Azidität beeinflusst. Es konnte festgestellt werden, dass eine künstlich verabreichte sehr hohe Konzentration an CSP den Zelltod der S. mutans-Population auslöst. QS-Systeme könnten möglicherweise therapeutisch zur Schwächung der Biofilmbildung und damit zur Kariesbehandlung verwendet werden.[36][37]
QS bei Pseudomonas aeruginosa
Pseudomonas aeruginosa, ein gramnegatives Bakterium, ist ein Kommensale der humanen Bakterienflora und kann sich unter bestimmten Bedingungen zu einem opportunistischen Erreger verändern. Durch ihn ausgelöste Infektionen sind zum Beispiel Lungenentzündung, Septikämie, sowie Krankenhausinfektionen. Typische zellassoziierte und extrazelluläre Virulenzfaktoren sind zum Beispiel Flagellen, Pili, Lektine, Polysaccharide, Proteasen, Exoenzym S und Exotoxin A. Das mehrschichtige, hierarchisch gegliederte QS-Netzwerk besteht aus vier verschiedenen QS-Systemen, die sowohl abhängig, als auch unabhängig voneinander interagieren können.[38]
Der Autoinduktor Al-1 bei Pseudomonas aeruginosa, (PAI) ist ein N-(3-Oxododecanoyl)−Homoserinlacton (OdDHL), welcher mit den anderen Autoinduktoren gramnegativer Bakterien verwandt ist. OdDHL bindet an einen Rezeptor und aktiviert den Transkriptionsfaktor LasR.[39]
Daneben existiert das Homoserinlaktonderivat N−Butyrylhomoserinlacton (BHL), das an den Rezeptor RhlR bindet. Mit PAI zusammen regulieren diese beiden QS-Systeme bereits 10 % des bakteriellen Genoms.
Das Pseudomonas Chinolon Signal (PQS), wurde 1999 von E. C. Pesci entdeckt.[40] Chemisch handelt es sich um ein 2−Heptyl−3−Hydroxy−4−Chinolon. Es bindet an den Rezeptor PqsR, ehemals MvfR.[41]
Das integrierte QS (IQS) ist in der Lage, auf Stresssignale aus der Umgebung zu reagieren und Informationen auf das QS-Netzwerk zu übertragen. Strukturell handelt es sich um ein 2−(2−Hydroxyphenyl)−Thiazol−4−Carbaldehyd, welches an den Rezeptor IqsR bindet. IQS vermindert die Produktion weiterer Signalmoleküle aus anderen QS-Systemen. Beispielsweise werden durch Veränderungen von PQS und BHL die Bildung der Virulenzfaktoren Pyocyanin, Rhamnolipide und Elastasen beeinflusst.[42]
QS bei mit Pflanzen assoziierten Bakteriengattungen
Über QS können in verschiedenen pflanzenassoziierten Bakterien sowohl apathogene als auch pathogene Eigenschaften gesteuert werden. Zu den Mikroorganismen, die hier eine bedeutende Rolle spielen, gehören Vertreter aus den Familien der Burkholderiaceae, Rhizobiaceae, Erwiniaceae und Pseudomonadaceae. Die Vertreter aus der Gattung Burkholderia, die ubiquitär in der Natur vorkommen, sind gramnegativ und können teilweise für Pflanzen, Menschen und Tiere pathogen sein. Sie besiedeln die Rhizosphäre von einigen Kulturpflanzen und schützen diese vor dem Pathogenbefall durch Pilze und Nematoden. Die antifugalen und nematoziden Eigenschaften werden über das Cep-QS-System mit dem Autoinduktor N-Octanoyl-L-Homoserinlacton (C8-HSL) beeinflusst. Der Autoinduktor, gebildet durch die AHL Synthase CepI, bindet an das Rezeptorprotein CepR und reguliert die Bildung von Biofilmen, die Produktion extrazellulärer Proteasen und Siderophoren.[43] Die Anwesenheit von AHL produzierenden Bakterien in der Rhizosphäre kann die Expression von Abwehrgenen in der Pflanze stimulieren und damit zu einer Resistenz bei Pflanzen beitragen.[44]
Das pflanzenpathogene Bodenbakterium Agrobacterium tumefaciens aus der Familie der Rhizobiaceae besitzt die Fähigkeit im Wurzelbereich oder an der Stängelbasis von verletzten zweikeimblättrigen Pflanzen Wurzelhalsgallentumore zu bilden. Wenn A. tumefaciens Verletzungen von Pflanzen erkennt und diese infiziert, kann der horizontale Gentransfer durch Übertragung des Ti-Plasmids in die pflanzliche Zelle erfolgen und damit die Bildung des Pflanzentumors induziert werden. Diese Strategie verschafft dem Bakterium Überlebensvorteile, da die induzierten pflanzlichen Wucherungen bestimmte Nährstoffe produzieren, deren Synthese auf dem bakteriellen Ti-Plasmid kodiert sind und die vom Bakterien genutzt werden. Für die Zell-Zell-Kommunikation verwendet A. tumefaciens das QS-System vom LuxR-LuxI-Typ mit dem Autoinduktor-1 N-3-Oxooctanoyl-L-Homoserinlacton, der von der LuxI-homologen Synthase TraI synthetisiert wird und an den TraR-Rezeptor bindet. Der aktivierte Transkriptionsfaktor veranlasst unter anderem die Transkription der auf dem Ti-Plasmid lokalisierten Gene.[45][46]
Literatur
- Waters, C.M. & Bassler, B.L. (2005) Quorum sensing: cell-to-cell communication in bacteria. In: Annu. Rev. Cell. Dev. Biol. Bd. 21, S. 319–346. PMID 16212498 doi:10.1146/annurev.cellbio.21.012704.131001PDF
- Kay, E. et al. (2006): Small RNAs in Bacterial Cell-Cell Communication. In: Microbe. Bd. 1, S. 63–69. PDF
- Sun, J. et al. (2004): Is autoinducer-2 a universal signal for interspecies communication: a comparative genomic and phylogenetic analysis of the synthesis and signal transduction pathways. In: BMC Evol. Biol. Bd. 4, S. 36. PMID 15456522 doi:10.1186/1471-2148-4-36 PDF
- Jasmine Lee, Jien Wu u. a.: A cell-cell communication signal integrates quorum sensing and stress response. In: Nature Chemical Biology. 9, 2013, S. 339–343, doi:10.1038/nchembio.1225.
Einzelnachweise
- Kenneth H. Nealson, Terry Platt und J. Woodland Hastings: Cellular control of the synthesis and activity of the bacterial luminescent system. In: Journal of Bacteriology, Band 104, Nummer 1, S. 313-22, 1970, doi:10.1128/jb.104.1.313-322.1970, PMC 248216, PMID 5473898.
- W. C. Fuqua, S. C. Winans, E. P. Greenberg: Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators. In: Journal of bacteriology. Band 176, Nummer 2, Januar 1994, ISSN 0021-9193, S. 269–275, PMID 8288518, PMC 205046 (freier Volltext), (Review).
- Kathrin Riedel, Susan Schönmann und Leo Eberl: Quorum sensing in Pflanzen-assoziierten Bakterien. In: BIOspektrum, Band 11, Jahrgang 4, S. 385–388, (freier Volltext).
- Bonnie L. Bassler und Richard Losick: Bacterially speaking. In: Cell (Zeitschrift), Band 125, 2 Jahrgang, S. 237–246, 21. April 2006, doi:10.1016/j.cell.2006.04.001, (freier Volltext).
- Laura R. Hmelo: Quorum Sensing in Marine Microbial Environments. In: Annual Review of Marine Science, Band 9, S. 257–281, 3. Januar 2017, doi:10.1146/annurev-marine-010816-060656.
- Roger S. Smith und Barbara H. Iglewski: Pseudomonas aeruginosa quorum sensing as a potential antimicrobial target. In: Journal of Clinical Investigation, Band 112, Nummer 10, S. 1460–1465, 15. November 2003, doi:10.1172/JCI20364, (freier Volltext).
- Franziska S. Birmes und Susanne Fetzner: Quorum sensing Bakterielle Kommunikation: Signale und Signal-inaktivierende Enzyme. In: BIOspektrum, 22. Jahrgang, 2016, doi:10.1007/s12268-016-0681-4, (freier Volltext).
- Michael J. Federle: Autoinducer-2-based chemical communication in bacteria: complexities of interspecies signaling. In: Contributions to Microbiology, Band 16, Nummer 18, 2009, PMID 19494577, doi:10.1159/000219371.
- H. Sztaljer, A. Lemme und I. Wagner-Döbler: Quorum Sensing und Karies. In: BIOspektrum, 14. Jahrgang, S. 578–582, 2008, (freier Volltext).
- Yannick Hecher und Kai Papernfort: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Ausgabe 2, S. 136–138, März 2020, doi:10.1007/s12268-020-1344-z.
- Yannick Hecher und Kai Papenport: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Nummer 2, S. 136–138, März 2020, doi:10.1007/s12268-020-1344-z.
- Melissa B Miller, Karen Skorupski, Derrick H Lenz, Ronald K Taylor und Bonnie L Bassler: Parallel quorum sensing systems converge to regulate virulence in Vibrio cholerae. In: Cell (Zeitschrift), Band 110, Ausgabe 3, S. 303-14, 9. August 2002, doi:10.1371/journal.ppat.1008313, (freier Volltext).
- Julia C van Kessel, Steven T Rutherford, Yi Shao, Alan F Utria und Bonnie L Bassler: Individual and combined roles of the master regulators AphA and LuxR in control of the Vibrio harveyi quorum-sensing regulon. In: Journal of Bacteriology, Band 195, Ausgabe 3, S. 436-43, Februar 2013, doi:10.1128/JB.01998-12, (freier Volltext).
- Kai Papenfort und Bonnie Bassler: Quorum-Sensing Signal-Response Systems in Gram-Negative Bacteria. In: Nature Reviews Microbiology, Band 14, Nummer 9, S. 576–588, 11. August 2016, doi:10.1038/nrmicro.2016.89, PMID 27510864.
- Warren R.J.D Galloway, James T. Hodgkinson, Steven D. Bowden, Martin Welch und David R. Spring: Quorum sensing in Gram-negative bacteria: small-molecule modulation of AHL and AI-2 quorum sensing pathways. In: Chemical Reviews, Band 111, Nummer 1, S. 28–67, 12. Januar 2011, doi:10.1021/cr100109t.
- Rebecca J Case, Maurizio Labbate und Staffan Kjelleberg: AHL-driven quorum-sensing circuits: their frequency and function among the Proteobacteria. In: ISME Journal, Band 2, Nummer 4, S. 345-9, April 2008, doi:10.1038/ismej.2008.13.
- Kai Papenfort und Bonnie Bassler: Quorum-Sensing Signal-Response Systems in Gram-Negative Bacteria. In: Nature Reviews Microbiology, Band 14, Nummer 9, S. 576–588, 11. August 2016, doi:10.1038/nrmicro.2016.89, PMID 27510864.
- Nazzareno Dominelli und Ralf Heermann: Die stille Kommunikation der Bakterien Small Talk. In: Biologie in unserer Zeit, Band 50, S. 414–423, 2020, doi:10.1002/biuz.202010720, (freier Volltext).
- Sophie Brameyer, Darko Kresovic, Helge B Bode und Ralf Heermann: Dialkylresorcinole als bakterielle Signalmoleküle. In: Proceedings of the National Academy of Sciences, Band 112, Nummer 2, S. 572-7, 2015, doi:10.1073/pnas.1417685112, (freier Volltext).
- Nazzareno Dominelli und Ralf Heermann: Die stille Kommunikation der Bakterien Small Talk. In: Biologie in unserer Zeit, Band 50, S. 414–423, 2020, doi:10.1002/biuz.202010720, (freier Volltext).
- Sophie Brameyer, Darko Kresovic, Helge B Bode und Ralf Heermann: Dialkylresorcinole als bakterielle Signalmoleküle. In: Proceedings of the National Academy of Sciences, Band 112, Nummer 2, S. 572-7, 2015, doi:10.1073/pnas.1417685112, (freier Volltext).
- Michael J. Federle: Autoinducer-2-based chemical communication in bacteria: complexities of interspecies signaling. In: Contributions to Microbiology, Band 16, S. 18–32, 2009, doi:10.1159/000219371, PMID 19494577.
- Michael J. Federle. Autoinducer-2-based chemical communication in bacteria: complexities of interspecies signaling. In: Contributions to Microbiology, Band 16, S. 18–32, 2. Juni 2009, doi:10.1159/000219371, PMID 19494577.
- Helena Sztajer, André Lemme und Irene Wagner-Döbler: Streptococcus mutans Quorum Sensing und Karies. In: BIOspektrum, 14. Jahrgang, 2008.
- Helena Sztajer, André Lemme, Ramiro Vilchez, Stefan Schulz, Robert Geffers, Cindy Ying Yin Yip, Celine M. Levesque, Dennis G. Cvitkovitch, und Irene Wagner-Döbler: Autoinducer-2-regulated genes in Streptococcus mutans UA159 and global metabolic effect of the luxS mutation. In: Journal of Bacteriology, Band 190, Nummer 1, S. 401–415, 2008, doi:10.1128/JB.01086-07, PMID 17981981, (freier Volltext).
- Yannick Hecher und Kai Papenfort: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Nummer 2, S. 136–138, 2020, doi:10.1007/s12268-020-1344-z.
- Michael G. Surette, Melissa B. Miller, und Bonnie L. Bassler: Quorum sensing in Escherichia coli, Salmonella typhimurium, and Vibrio harveyi: A new family of genes responsible for autoinducer production. In: Proceedings of the National Academy of Sciences, Band 96, Nummer 4, 16. Februar 1999 S. 1639–1644, doi:10.1073/pnas.96.4.1639, (freier Volltext).
- Yannick Hecher und Kai Papenfort: Klein, gefährlich und gesprächig – Quorum sensing bei Vibrio cholerae. In: BIOspektrum, Band 26, Nummer 2, S. 136–138, 2020, doi:10.1007/s12268-020-1344-z.
- Chung Sub Kim, Alexandra Gatsios, Santiago Cuesta, Yick Chong Lam, Zheng Wei, Haiwei Chen, Regan M. Russell, Emilee E. Shine, Rurun Wang, Thomas P. Wyche, Grazia Piizzi, Richard A. Flavell, Noah W. Palm, Vanessa Sperandio und Jason M. Crawford: Characterization of Autoinducer-3 Structure and Biosynthesis in E. coli. In: ACS Central Science, Band 6, Nummer 2, S. 197–206, 22. Januar 2020, doi:10.1021/acscentsci.9b01076, PMC 7047286, PMID 32123737.
- Frederick Verbeke, Severine De Craemer, Nathan Debunne, Yorick Janssens, Evelien Wynendaele, Christophe Van de Wiele und Bart De Spiegeleer: Peptides as Quorum Sensing Molecules: Measurement Techniques and Obtained Levels In vitro and In vivo. In: Frontiers in Neuroscience, Band 11, S. 183, 12. April 2017, doi:10.3389/fnins.2017.00183, (freier Volltext).
- Joseph K. Vasquez und Helen E. Blackwell: Simplified Autoinducing Peptide Mimetics with Single-Nanomolar Activity Against the Staphylococcus aureus AgrC Quorum Sensing Receptor. In: ACS Infectious Diseases, Band 5, Nummer 4, S. 484–492, 2019, doi:10.1021/acsinfecdis.9b00002, (freier Volltext).
- Ayaka Yoshihara, Mika Shimatani, Megumi Sakata, Chika Takemura, Wakana Senuma, Yasufumi Hikichi und Kenji Kai: Quorum Sensing Inhibition Attenuates the Virulence of the Plant Pathogen Ralstonia solanacearum Species Complex. In: ACS Chemical Biology, Band 15, Nummer 11, S. 3050–3059, 2020, doi:10.1021/acschembio.0c00752.
- Franziska S. Birmes und Susanne Fetzner: Bakterielle Kommunikation: Signale und Signal-inaktivierende Enzyme. In: BIOspektrum, 22. Jahrgang, S. 251–254, 2016, doi:10.1007/s12268-016-0681-4.
- M. Dilani Senadheera, Andrew W. C. Lee, David C. I. Hung, Grace A. Spatafora, Steven D. Goodman und Dennis G. Cvitkovitch: The Streptococcus mutans vicX gene product modulates gtfB/C expression, biofilm formation, genetic competence, and oxidative stress tolerance. In: Journal of Bacteriology, Band 189, Nummer 4, 2007, S. 1451–1458, doi:10.1128/JB.01161-06, (freier Volltext).
- H. Sztajer, A. Lemme und I. Wagner-Döbler: Streptococcus mutans Quorum Sensing und Karies. In: BIOspektrum, 14. Jahrgang, 2008, (freier Volltext).
- Dilani Senadheera und Dennis G. Cvitkovitch: Quorum sensing and biofilm formation by Streptococcus mutans. In: Advances in Experimental Medicine and Biology, Band 631, S. 178-88, 2008, doi:10.1007/978-0-387-78885-2_12.
- Delphine Dufour und Céline M. Lévesque: Cell Death of Streptococcus mutans Induced by a Quorum-Sensing Peptide Occurs via a Conserved Streptococcal Autolysin. In: Journal of Bacteriology, Band 195, Nummer 1, S. 105–114, Januar 2013, doi:10.1128/JB.00926-12, (freier Volltext).
- Jasmine Lee und Lianhui Zhang: The hierarchy quorum sensing network in Pseudomonas aeruginosa. In: Protein Cell., Band 6, Nummer 1, S. 26–41, 2015, doi:10.1007/s13238-014-0100-x, PMID 25249263, (freier Volltext).
- JP Pearson, KM Gray, L Passador, KD Tucker, A Eberhard, BH Iglewski und EP Greenberg: Structure of the autoinducer required for expression of Pseudomonas aeruginosa virulence genes. In: Proceedings of the National Academy of Sciences, Band 91, Nummer 1, S. 197–201, 1994, doi:10.1073/pnas.91.1.197.
- Everett C. Pesci, Jared B. J. Milbank, James P. Pearson, Susan McKnight, Andrew S. Kende, E. Peter Greenberg, und Barbara H. Iglewski: Quinolone signaling in the cell-to-cell communication system of Pseudomonas aeruginosa. In: Proceedings of the National Academy of Sciences, Band 96, Nummer 20, S. 11229-34, 1999, doi:10.1073/pnas.96.20.11229, (freier Volltext).
- Hui Cao, Gomathi Krishnan, Boyan Goumnerov, John Tsongalis, Ronald Tompkins, und Laurence G. Rahme: A quorum sensing-associated virulence gene of Pseudomonas aeruginosa encodes a LysR-like transcription regulator with a unique self-regulatory mechanism. In: Proceedings of the National Academy of Sciences, Band 98, Nummer 25, S. 14613-8, 2001, doi:10.1073/pnas.251465298, (freier Volltext).
- Jasmine Lee und Lianhui Zhang: The hierarchy quorum sensing network in Pseudomonas aeruginosa. In: Protein Cell, Band 6, Nummer 1, S. 26–41, 2015, doi:10.1007/s13238-014-0100-x, (freier Volltext).
- Birgit Huber, Kathrin Riedel, Morten Hentzer, Arne Heydorn, Astrid Gotschlich, Michael Givskov, Søren Molin und Leo Eberl: The cep quorum-sensing system of Burkholderia cepacia H111 controls biofilm formation and swarming motility. In: Microbiology (Reading), Band 147, Jahrgang 9, S. 2517–2528, doi:10.1099/00221287-147-9-2517.
- Kathrin Riedel, Susan Schönmann und Leo Eberl: Quorum sensing in Pflanzen-assoziierten Bakterien. In: BIOspektrum, Jahrgang 11, 2005, (freier Volltext).
- C Fuqua und SC Winans: Conserved cis-acting promoter elements are required for density-dependent transcription of Agrobacterium tumefaciens conjugal transfer genes. In: Journal of Bacteriology, Band 178, Nummer 2, S. 435-40, 1996, doi:10.1128/jb.178.2.435-440.1996, (freier Volltext).
- Catharine E. White und Stephen C. Winans: Cell–cell communication in the plant pathogen Agrobacterium tumefaciens. In: Philos Trans R Soc Lond B Biol Sci., Band 362, Nummer 1483, S. 1135–1148, 2007, doi:10.1098/rstb.2007.2040, (freier Volltext).