Enterohämorrhagische Escherichia coli
Enterohämorrhagische Escherichia coli (EHEC) sind bestimmte krankheitsauslösende Stämme des Darmbakteriums Escherichia coli (E. coli), benannt nach dem Entdecker des Erregers Theodor Escherich. Das Namenspräfix enterohämorrhagisch (entero von altgriechisch ἔντερον enteron – „Darm“ und hämorrhagisch für Blutung) deutet an, dass EHEC beim Menschen blutige Durchfallerkrankungen (enterohämorrhagische Colitis) auslösen können. Es sind Verotoxin bildende Escherichia coli (VTEC) und synonym dazu Shiga-Toxin bildende Escherichia coli (STEC) welche Krankheitsbilder beim Patienten hervorrufen.
| Klassifikation nach ICD-10 | |
|---|---|
| A04 | Sonstige bakterielle Darminfektionen |
| A04.3 | Darminfektion durch enterohämorrhagische Escherichia coli |
| ICD-10 online (WHO-Version 2019) | |
Erreger

E. coli ist ein weitverbreitetes gramnegatives Stäbchenbakterium. Mehrere nicht-pathogene Stämme sind Bestandteil der normalen Darmflora des Menschen. Es gibt jedoch einige serologisch unterscheidbare Stämme, die beim Menschen Darmerkrankungen auslösen. Außer den hier behandelten EHEC, die 1977 erstmals beschrieben wurden, gibt es weitere pathogene E. coli: enteropathogene E. coli (EPEC), enterotoxinbildende E. coli (ETEC) und enteroinvasive E. coli (EIEC), enteroaggregative E. coli (EAEC)[1] sowie diffus adhärente E. coli (DAEC).
Enterohämorrhagische E. coli-Bakterien (EHEC) haben mehrere Besonderheiten, die ihre pathogene Potenz erhöhen: Erstens können sie sich durch ein spezielles Hüllenprotein (Adhäsin) an die Epithelzellen der Darmwand anheften. Zweitens besitzen sie durch eine Phageninfektion ein Gen für die Produktion eines Toxins, das Ähnlichkeit mit dem neurotoxischen und nekrotisierenden Toxin des Bakteriums Shigella dysenteriae hat und als Shiga-Toxin 2 oder auch Vero-Toxin bezeichnet wird (der Name Vero-Toxin leitet sich von Vero-Zellen ab, einer Zellkultur aus Affennieren, an der das Toxin als erstes getestet wurde). Schließlich produzieren die EHEC-Stämme auch noch ein plasmidcodiertes Hämolysin (blutzellenzerstörendes Toxin). Auf die drei häufigsten Serogruppen O157, O103 und O26 verteilten sich fast 60 % der Erreger. Der Buchstabe „O“ (nicht die Ziffer „Null“) steht hier für die jeweiligen als Oberflächenantigene wirkenden Lipopolysaccharide der äußeren Zellmembran der Bakterien. Essenziell für die Virulenz ist außerdem das Vorhandensein des Sensorproteins QseC.
Enterohämorrhagische E. coli-Bakterien sind Shiga-Toxin produzierende E. coli (STEC), oder genauer: Shiga-like-Toxin produzierende E. coli (SLTEC) oder Vero-Toxin produzierende E. coli (VTEC). EHEC werden jedoch nur die pathogenen Stämme genannt.
Übertragung
Der Erreger und die von ihm verursachten Infektionserkrankungen treten weltweit auf. Das Hauptreservoir des Erregers bilden Wiederkäuer, vor allem Rinder, aber auch Schafe, Ziegen, Rehe und Hirsche, in deren Darm sie regelhaft vorkommen, ohne bei ihnen Erkrankungen auszulösen.
Die Übertragung der Erreger erfolgt auf vielfältige Art und Weise überwiegend durch die direkte oder indirekte orale Aufnahme von Fäkalspuren.[2] Der Erreger kann mit der Nahrung, insbesondere mit rohem Fleisch oder Rohmilch[3] aufgenommen werden. Eine Infektion ist auch über fäkalienverseuchtes Trink- oder Badewasser möglich. Mit Tierausscheidungen kontaminiertes Trinkwasser verursachte im Jahr 2000 im kanadischen Walkerton mehr als 2000 Erkrankungen und 18 Todesfälle.[4] Außerdem sind eine Infektion von Mensch zu Mensch sowie eine Übertragung durch Tier-Mensch-Kontakte möglich. Fliegen können Vektoren von EHEC darstellen.[5] Eine Übertragung von Mensch zu Mensch wurde in Familien, Kindertagesstätten, Altenheimen und Krankenhäusern nachgewiesen.[6] Bereits weniger als 100 Bakterien können für eine Ansteckung genügen.[2]
Epidemiologie
In verschiedenen Staaten der Welt gab es große Ausbrüche von Erkrankungen an EHEC vor allem durch den Serotyp O157:H7: So 1982, als in den USA viele Menschen nach dem Verzehr von nicht ausreichend erhitzten Hamburgern erkrankten,[8] 1996 in Japan mit etwa 9000 erkrankten Schulkindern nach dem Verzehr von Rettich-Sprossen, und 2006 ausgehend von Kalifornien in 26 Bundesstaaten der USA.[9]
In Deutschland wurde 2003 ein kontinuierlicher Anstieg der Meldezahlen seit Einführen der bundesweiten Meldepflicht im Jahr 1998 festgestellt.[10] Dabei spielte jedoch vermutlich auch eine zunehmend vollständige Erfassung der Erkrankungsfälle eine Rolle. Mehr als die Hälfte der übermittelten Fälle betraf Kinder unter fünf Jahren. Die geographische Verteilung der Erkrankungen variiert stark. Die Flächenbundesländer mit den höchsten Inzidenzen sind Bayern, Rheinland-Pfalz und Niedersachsen. Nur in knapp der Hälfte der übermittelten Fälle liegen Angaben zur Serogruppe vor, daher haben diese Zahlen zur Epidemiologie der unterschiedlichen Serogruppen in Deutschland nur eine begrenzte Aussagekraft. Auf die drei häufigsten Serogruppen O157, O103 und O26 verteilten sich fast 60 % der Erreger mit Angaben zur Serogruppe. Etwa 15 Prozent der Fälle wurden im Rahmen von Häufungen übermittelt. Auch zur Epidemiologie der EHEC-Infektionen besteht noch erheblicher Forschungsbedarf.
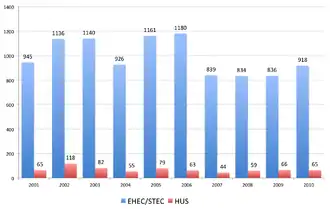
Im Jahr 2001 wurden 65 Fälle des hämolytisch-urämischen Syndroms (HUS) an das Robert Koch-Institut (RKI) in Berlin gemeldet, im Jahr 2002 waren es mit 118 fast doppelt so viele, 2003 waren es 82 Fälle. Zu dem Anstieg der Fallzahlen im Jahr 2002 trugen zwei überregionale Häufungen von HUS-Erkrankungen bei, die in Zusammenarbeit zwischen dem RKI und den betroffenen Landesgesundheitsbehörden untersucht wurden. Beide Häufungen wurden durch die sonst sehr selten festgestellte „Sorbitol-fermentierende Variante“ von EHEC O157:H− verursacht, die bereits 1988 und 1996 zu Ausbrüchen in Bayern geführt hatte. Eine im Dezember 2002 durchgeführte Fallkontrollstudie ergab Hinweise auf einzelne Produkte als mögliche Risikofaktoren (selbst gepresster Apfelsaft und ein Joghurtprodukt); die definitive Ursache des Ausbruchs konnte jedoch nicht geklärt werden.[11]
Im Jahr 2008 hatte es im Raum Diepholz vermehrt EHEC-Ausbrüche gegeben, wobei es sich um einen klassischen Ausbruch gehandelt hat, der durch den Genuss von Rohmilch verursacht wurde.[12]
2009 wurden in Deutschland insgesamt 836 EHEC-bedingte Durchfallerkrankungen ohne HUS an das Robert Koch-Institut gemeldet, 44 % der Erkrankten waren Kinder unter fünf Jahren.[13] In Folge der COVID-19-Pandemie in Deutschland und der damit einhergehenden Hygienemaßnahmen lag die Zahl der in den Kalenderwochen 10 bis 32 registrierten EHEC-Erkrankungsfälle im Jahr 2020 im Mittel 46 Prozent unter den Werten der Vorjahre.[14]
Ab Mai 2011 kam es zuerst in Norddeutschland (Hamburg, Schleswig-Holstein), später auch in anderen Bundesländern und Staaten zu erhöhten Fallzahlen des hämolytisch-urämischen Syndroms (HUS), die sich zu einer Epidemie ausweiteten und durch den Stamm O104:H4 ausgelöst wurden, siehe HUS-Epidemie 2011.
Krankheitsverlauf, Komplikationen
Eine Infektion kann symptomfrei verlaufen. Andernfalls tritt nach einer Inkubationszeit von typischerweise drei bis vier Tagen, vereinzelt aber auch nach zwei bis zu zehn Tagen,[15] eine Gastroenteritis (Magen-Darm-Grippe, Brechdurchfall) auf, die sich zu einer enterohämorrhagischen Colitis entwickeln kann. Die Toxine zerstören die Zellen der Darmwand und der Blutgefäßwände, insbesondere in Gehirn und Nieren.[16] Neben den Shiga-Toxinen gibt es bei EHEC weitere Virulenzfaktoren wie LEE-codierte Proteine, das EHEC-Hämolysin, das CDT (cytolethal distending toxin), die Serinprotease EspP und Eisenaufnahmeproteine, weshalb die verschiedenen von EHEC verursachten Krankheitsbilder als multifaktorielle Prozesse anzusehen sind.[16]
Als schwere Komplikation von EHEC-Darminfektionen ist auch das meldepflichtige enteropathische hämolytisch-urämische Syndrom (HUS) mit oder ohne neurologischen Komplikationen möglich. Ein HUS kann in etwa 85 Prozent der Fälle auf eine EHEC-/STEC-Infektion zurückgeführt werden, kommt aber auch bei Shigellen oder anderen Erregern vor. Neuere Untersuchungen haben gezeigt, dass die thrombotisch-thrombozytopenische Purpura (TTP), die üblicherweise auch in diesem Zusammenhang genannt wurde, ein anderes Krankheitsbild mit unterschiedlicher Ursache ist, deshalb wird sie durch die amtliche Statistik nicht mehr erfasst und auch hier nicht mit aufgeführt.
Die Ausscheidung der Bakterien erfolgt typischerweise in einem Zeitraum von fünf bis zwanzig Tagen, kann sich insbesondere bei Kindern jedoch auch über mehrere Monate erstrecken. In dieser Zeit ist eine Ansteckung weiterer Personen möglich.
Diagnose
Die Diagnose erfolgt durch eine Polymerase-Kettenreaktion (PCR) mit Primern, die an EHEC-spezifische DNA-Abschnitte binden und somit der DNA-Polymerase die Replikation der für EHEC typischen Gene (stx1, stx2) ermöglichen. Die Produkte der PCR können somit auf EHEC-typische DNA überprüft werden. In VO (EG) 2073/2005 schreibt die Europäische Union dies als Referenzverfahren für Lebensmittelhersteller mit Verweis auf DIN CEN ISO/TS 13136 vor.[17]
Ergänzend werden die vom Erreger produzierten Toxine Shiga-Toxin 1 und 2 nachgewiesen. Als Methoden können dazu Enzymimmunoassays[18] oder massenspektrometrische Methoden[19] herangezogen werden. Neben den klassischen chromatographisch/massenspektrometrischen Kopplungstechniken kommt auch vermehrt die MALDI-TOF-Analytik zum Einsatz,[20] die hochspezifische analytische Aussagen ermöglicht.
Quick-Wert (INR) und PTT sind unauffällig. Die Blutungszeit ist verlängert aufgrund der bestehenden Thrombozytopenie.
Therapie
Eine Bekämpfung des Erregers durch Antibiotika ist nicht erfolgversprechend, da dadurch die Ausscheidung der Bakterien verlängert[21][22] oder der Krankheitsverlauf durch eine erhöhte Toxinbildung verschlimmert werden kann.[23][24] Die Behandlung erfolgt symptomorientiert durch Ersatz des Wasser- und Elektrolytverlustes, der bei schweren Durchfällen auftritt. Die Darmbewegung hemmende Medikamente wie Loperamid sind nicht angezeigt, um die Ausscheidung von Erregern und Toxin nicht zu behindern.[25] Die Komplikation HUS muss intensivmedizinisch behandelt werden, beispielsweise durch Bluttransfusionen, Anregung der Urinausscheidung mittels Diuretika, Blutwäsche in Form von Hämofiltration und Plasmaaustausch.[22][24] Krankenhauspatienten werden unter Beachtung allgemeiner Hygienemaßnahmen isoliert untergebracht.[26]
Seit 2009 gibt es einige wenige Fallberichte über den Einsatz des monoklonalen Antikörpers Eculizumab bei Kindern mit HUS, die nicht auf Plasmapherese reagierten, sowie bei einem atypischen HUS nach Nierentransplantation.[27][28][29] Aufgrund dieser Berichte wird seit dem 28. Mai 2011 in einigen Kliniken in Deutschland Eculizumab bei schweren Verläufen mit HUS, die unter Plasmapherese keine Tendenz zur Besserung zeigen, versuchsweise eingesetzt. Ob und wie weit diese Maßnahme zum Erfolg führt, lässt sich nach Aussage von Rolf Stahl, Universitätsklinikum Hamburg-Eppendorf, erst etwa 3–4 Wochen nach Therapiebeginn sagen.[30]
Meldepflicht
In Deutschland sind der Verdacht oder Nachweis einer EHEC-Infektion nach § 6 des Infektionsschutzgesetzes (IfSG) meldepflichtig, wenn entweder a) ein HUS vorliegt, b) zwei oder mehr Personen erkrankt sind und der Verdacht eines epidemiologischen Zusammenhangs besteht oder c) ein Erkrankter im Lebensmittel- oder Gaststättengewerbe tätig ist. Ebenso ist der direkte oder indirekte Nachweis von Escherichia coli, enterohämorrhagische Stämme (EHEC) namentlich meldepflichtig nach § 7 IfSG, soweit der Nachweis auf eine akute Infektion hinweist. Meldepflichtig sind die feststellenden Ärzte bzw. Labore usw. (§ 8 IfSG).
Auch für Infektionen von Haustieren mit Verotoxin bildenden Escherichia coli besteht in Deutschland Meldepflicht.[31]
In der Schweiz ist der positive laboranalytische Befund einer enterohämorrhagischen Escherichia coli-Infektion (EHEC, STEC, VTEC) für Ärzte, Spitäler usw. meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Ebenso ist der positive oder negative laboranalytische Befund vom Erreger enterohämorrhagische Escherichia coli (EHEC, STEC, VTEC) für Laboratorien meldepflichtig und zwar nach dem EpG i. V. m. der Epidemienverordnung und Anhang 3 der Verordnung des EDI.
Enterohämorrhagische Escherichia coli bei Tieren
Bei Absetzern verursacht der Erreger die Ödemkrankheit der Schweine.
Weiterführende Literatur
Aus medizinischer Sicht
- Hugh Pennington: Escherichia coli O157. Review-Artikel in: The Lancet, Band 376, 2010, S. 1428–1435, doi:10.1016/S0140-6736(10)60963-4
- F. Tornuk, H. Cankurt, I. Ozturk, O. Sagdic, O. Bayram, H. Yetim: Efficacy of various plant hydrosols as natural food sanitizers in reducing Escherichia coli O157:H7 and Salmonella Typhimurium on fresh cut carrots and apples. In: International journal of food microbiology [elektronische Veröffentlichung vor dem Druck] April 2011, ISSN 1879-3460. doi:10.1016/j.ijfoodmicro.2011.04.022, PMID 21592604.
- E. Franz, A. H. van Bruggen: Ecology of E. coli O157:H7 and Salmonella enterica in the primary vegetable production chain. In: Critical reviews in microbiology Band 34, Nummer 3–4, 2008, S. 143–161, ISSN 1549-7828. doi:10.1080/10408410802357432, PMID 18728991 (Review).
- M. A. Rendón, Z. Saldaña, A. L. Erdem, V. Monteiro-Neto, A. Vázquez, J. B. Kaper, J. L. Puente, J. A. Girón: Commensal and pathogenic Escherichia coli use a common pilus adherence factor for epithelial cell colonization. In: Proceedings of the National Academy of Sciences of the United States of America Band 104, Nummer 25, Juni 2007, S. 10637–10642, ISSN 0027-8424. doi:10.1073/pnas.0704104104, PMID 17563352, PMC 1890562 (freier Volltext).
- S. H. Ali: A socio-ecological autopsy of the E. coli O157:H7 outbreak in Walkerton, Ontario, Canada. In: Social science & medicine (1982) Band 58, Nummer 12, Juni 2004, S. 2601–2612, ISSN 0277-9536. doi:10.1016/j.socscimed.2003.09.013, PMID 15081208. (Review).
- K. G. Campellone, J. M. Leong: Tails of two Tirs: actin pedestal formation by enteropathogenic E. coli and enterohemorrhagic E. coli O157:H7. In: Current Opinion in Microbiology Band 6, Nummer 1, Februar 2003, S. 82–90, ISSN 1369-5274. PMID 12615225. (Review).
- K. Nowack: Mechanismen der Apoptose in proximalen Tubulusepithelzellen der Niere (LLC-PK1) – Ein pathologisches Modell für das hämolytisch-urämische Syndrom (HUS). (PDF; 2,1 MB) Dissertation, Albert-Ludwigs-Universität, Freiburg im Breisgau 2002.
- T. G. Obrig: Shiga toxin mode of action in E. coli O157:H7 disease. In: Frontiers in bioscience Band 2, Dezember 1997, S. d635–d642, ISSN 1093-4715. PMID 9392626 (Review).
- D. A. Greenwald, L. J. Brandt: Recognizing E. coli O157:H7 infection. In: Hospital practice Band 32, Nummer 4, April 1997, S. 123–129, ISSN 2154-8331. PMID 9109811. (Review).
- P. M. Griffin, R. V. Tauxe: The epidemiology of infections caused by Escherichia coli O157:H7, other enterohemorrhagic E. coli, and the associated hemolytic uremic syndrome. In: Epidemiologic reviews Band 13, 1991, S. 60–98, ISSN 0193-936X. PMID 1765120. (Review).
Weblinks
- EHEC-Infektionen – Informationen des Robert Koch-Instituts
- Erkrankungen durch Enterohämorrhagische Escherichia coli (EHEC) (PDF; 64 kB) Robert Koch-Institut, RKI-Ratgeber für Ärzte
- DGIM warnt vor EHEC-Durchfallbakterium. Deutsche Gesellschaft für Innere Medizin, Pressemitteilung, Mai 2011
- Neue Erkenntnisse zum EHEC-Ausbruch. Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL), Pressemitteilung
- Im Bockshorn – Die EHEC-Krise im Frühsommer 2011. (PDF; 806 kB) Foodwatch, 05/2012.
Einzelnachweise
- Wolfgang F. Caspary, Manfred Kist, Jürgen Stein: Infektiologie des Gastrointestinaltraktes. Springer, Berlin / Heidelberg 2006, ISBN 3-540-41359-6, S. 224 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Erkrankungen durch Enterohämorrhagische Escherichia coli (EHEC), Fassung vom Januar 2008 (Memento vom 27. Mai 2011 im Internet Archive) RKI-Ratgeber für Ärzte; abgerufen am 29. Mai 2011.
- Rohmilch – ein unterschätztes Risiko? Niedersächsisches Landesamt für Verbraucherschutz und Lebensmittelsicherheit, abgerufen am 3. Dezember 2021.
- Peter Schindler: Fäkale Verunreinigungen im Trinkwasser. (Memento vom 26. Juni 2011 im Internet Archive; PDF; 174 kB) Beitrag im FLUGS-Seminar: Wasser – Reservoir des Lebens. Aktuelle Fragen zu Wasserversorgung und -hygiene, Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit, März 2004.
- Maike Förster: Gefährliche Plagegeister – Fliegen als Überträger von Mikroorganismen. (Memento vom 15. August 2011 im Internet Archive; PDF; 308 kB) In: Rundschau für Fleischhygiene und Lebensmittelüberwachung, 7/2009, S. 4–6
- Infektionen durch Enterohämorrhagische Escherichia coli (EHEC). In: Epidemiologisches Bulletin, 31/1999 (PDF; 65 kB) Robert Koch-Institut
- SurvStat (Memento des Originals vom 27. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Robert Koch-Institut, Datenstand: 27. Mai 2011
- EHEC-Epidemie 1982 in den USA durch infizierte Hamburger. fleischwirtschaft.de
- Ein Gramm EHEC kann gesamte Menschheit infizieren. Welt Online; EHEC-Epidemien 1996 in Japan und 2006 in den USA
- K. Alpers u. a (RKI): Zoonotische Infektionen beim Menschen. Übersicht über die epidemiologische Situation in Deutschland. In: Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. Nr. 7, 2004, S. 627 (edoc.rki.de [PDF; 368 kB]).
- Epidemiologisches Bulletin 22/2003 (PDF; 163 kB) Robert Koch-Institut
- welt.de WELT Online, 19. Mai 2008
- Infektionsepidemiologisches Jahrbuch für 2009. (PDF; 1,4 MB) Robert Koch-Institut, Berlin 2010, S. 68–69.
- Die Auswirkungen der COVID-19-Pandemie und assoziierter Public-Health-Maßnahmen auf andere meldepflichtige Infektionskrankheiten in Deutschland (MW 1/2016 – 32/2020). (PDF) In: rki.de. Robert Koch-Institut, 18. Februar 2021, abgerufen am 13. Februar 2021 (Online-Vorab-Veröffentlichung aus dem Epidemiologischen Bulletin).
- Erkrankungen durch Enterohämorrhagische Escherichia coli (EHEC). RKI-Ratgeber für Ärzte, Fassung vom Juni 2011; abgerufen am 1. Januar 2013.
- Helge Karch, Alexander Mellmann, Martina Bielaszewska: Epidemiologie und Pathogenese von Infektionen mit enterohämorrhagischen Escherichia coli. In: Berliner und Münchener Tierärztliche Wochenschrift. Band 122, Nr. 11/12, 2009, S. 417–424 (online). doi:10.2376/0005-9366-122-417 (zurzeit nicht erreichbar)
- Burkhard Schütze: Eigenkontrollen erhöhen die Sicherheit – Moderne Analytik zum Nachweis von EHEC in Lebensmitteln. In: FleischWirtschaft, 10/2014, ISSN 0015-363X, ladr-lebensmittel.de (PDF)
- LM Clotilde, C 4th Bernard, GL Hartman, DK Lau, JM Carter: Microbead-based immunoassay for simultaneous detection of Shiga toxins and isolation of Escherichia coli O157 in foods. In: J Food Prot., 2011 Mar, 74(3), S. 373–379, PMID 21375872
- F Kondo, H Saito, R Hayashi, H Onda, S Kobayashi, M Matsumoto, M Suzuki, Y Ito, H Oka, T Nakanishi, A Shimizu: Identification of Shiga toxins in Shiga toxin-producing Escherichia coli using immunoprecipitation and high-performance liquid chromatography-electrospray ionization mass spectrometry. In: Analyst., 2003 Nov, 128(11), S. 1360–1364, PMID 14700230
- CK Fagerquist, O. Sultan: Induction and identification of disulfide-intact and disulfide-reduced β-subunit of Shiga toxin 2 from Escherichia coli O157:H7 using MALDI-TOF-TOF-MS/MS and top-down proteomics. In: Analyst., 2011 Apr 21, 136(8), S. 1739–1746, PMID 21336382
- DEGAM: S1-Leitlinie EHEC / HUS (Stand 10. Juni 2011). (PDF; 107 kB) (Nicht mehr online verfügbar.) Archiviert vom Original am 14. Januar 2012; abgerufen am 2. Juni 2011.
- Peter Layer, Ulrich Rosien: Praktische Gastroenterologie. Elsevier, Urban&Fischer, München 2008, ISBN 978-3-437-23371-5, S. 359 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang F. Caspary, Manfred Kist, Jürgen Stein: Infektiologie des Gastrointestinaltraktes. Springer, Berlin / Heidelberg 2006, ISBN 3-540-41359-6, S. 232 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieter Adam: Die Infektiologie. Springer, Berlin / Heidelberg 2003, ISBN 3-540-00075-5, S. 1032 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- Niklaus E. Gyr, Fritz Koller: Internistische Notfälle: sicher durch die Akutsituation und die nachfolgenden 48 Stunden. Georg Thieme Verlag, Stuttgart 2003, ISBN 3-13-510607-1, S. 321 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hygienemaßnahmen bei stationären Patienten mit hämolytisch-urämischem Syndrom (HUS) bzw. blutigen Durchfällen durch Enterohämorrhagische Escherichia coli (EHEC). (PDF) Robert-Koch-Institut, abgerufen am 1. Januar 2013.
- Anne-Laure Lapeyraque et al.: Eculizumab in Severe Shiga-Toxin–Associated HUS. In: N Engl J Med, 2011, 364, S. 2561–2563, doi:10.1056/NEJMc1100859
- Ralph A. Gruppo, Russel P. Rother: Eculizumab for Congenital Atypical Hemolytic–Uremic Syndrome. In: N Engl J Med, 2009, 360, S. 544–546, doi:10.1056/NEJMc0809959
- C.F. Larrea, F. Cofan et al.: Efficacy of eculizumab in the treatment of recurrent atypical hemolytic-uremic syndrome after renal Transplantation. In: Transplantation, 2010, 89, S. 903–904, PMID 20386298
- UKE versorgt derzeit 64 Patienten, die das HU-Syndrom entwickelt haben (Memento vom 2. Juni 2011 im Internet Archive) Pressemitteilung vom 28. Mai 2011
- § 1 und Anlage der Verordnung über meldepflichtige Tierkrankheiten (TKrMeldpflV) in der Fassung der Bekanntmachung vom 11. Februar 2011 (BGBl. I S. 252), zuletzt geändert durch Artikel 381 der Verordnung vom 31. August 2015 (BGBl. I S. 1474)