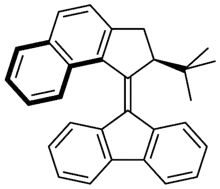
Molekularer Schalter
Ein molekularer Schalter ist ein Molekül, das zwischen zwei oder mehr elektronischen Zuständen reversibel verschoben werden kann.[1] Die Moleküle werden zwischen den verschiedenen Zuständen verschoben, je nach Umwelteinfluss, wie Änderungen des pH-Wertes, des Lichtes, der Temperatur, des elektrischen Stromes, der Mikroumgebung oder der Anwesenheit eines Liganden. In einigen Fällen ist die Kombination von mehreren Einflüssen erforderlich. Die älteste Form synthetischer molekularer Schalter sind pH-Indikatoren, die in Abhängigkeit vom pH-Wert unterschiedliche Farben zeigen. Im Moment sind synthetische molekulare Schalter auf dem Gebiet der Nanotechnologie von Interesse für die Anwendung bei molekularen Computern. Molekulare Schalter sind auch in der Biologie wichtig, da viele biologische Funktionen darauf basieren, beispielsweise die optische Sinneswahrnehmung mit dem Auge. Sie sind die einfachsten Beispiele für molekulare Maschinen.
Photochrome molekulare Schalter
Eine umfangreich untersuchte Substanzklasse sind photochrome Verbindungen, die in der Lage sind, zwischen Elektronenkonfigurationen hin- und herzuschalten, sobald sie mit Licht einer bestimmten Wellenlänge bestrahlt werden. Jeder Zustand hat ein spezifisches Absorptionsmaximum, das mittels UV/VIS-Spektroskopie charakterisiert werden kann. Beispiele für diese Substanzklasse sind: Azobenzol, Diarylethan, Ditionylethan, Fulvene, Stilbene, Spiropyrane und Phenoxynaphthochinone.
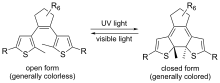 Schaltvorgang in Dithienylethan
Schaltvorgang in Dithienylethan
Chiroptische molekulare Schalter sind eine spezielle Untergruppe, bei der ein Schalten zwischen Enantiomeren stattfindet. Dies weist man eher durch Zirkulardichroismus (mit einem Polarisationsspektrometer) als durch einfache Spektroskopie nach.[2] Sterisch gehinderte Alkene, wie die unten gezeigten, ändern ihre Helizität als Antwort auf eine Bestrahlung mit zirkular polarisiertem Licht.
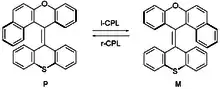 Sterisch gehinderte Alkene
Sterisch gehinderte Alkene
Chiroptische molekulare Schalter zeigen eine Bewegung, die als synthetischer molekularer Motor betrachtet wird:[3]
Molekulare Wirt-Gast-Schalter
In der Wirt-Gast-Chemie unterscheiden sich die metastabilen Zustände in ihrer Affinität zu Gästen. Einige frühe Beispiele für solche Systeme basieren auf der Kronenether-Chemie. Der erste schaltbare Wirt wurde 1978 von Desvergne und Bouas-Laurent beschrieben.[4][5] Sie synthetisierten einen Kronenether über eine photochemische Anthracen-Dimerisierung. Obwohl der Kronenether kein Schalter im engeren Sinne ist, ist diese Substanz in der Lage, nach einer photochemischen Reaktion Kationen aufzunehmen, die nach dem Zusatz von Acetonitril wieder freigesetzt werden.
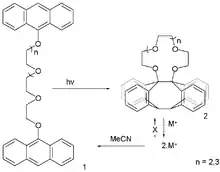 Anthracen-Krone, Desvergne 1978
Anthracen-Krone, Desvergne 1978
Bereits 1980 stellten Yamashita et al.[6] einen Kronenether dar, der schon Anthracen-Einheiten enthielt (ein Anthracenophan) und untersuchten die Ionenaufnahme photochemisch.
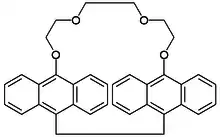 Anthracen-Krone, Misumi 1980
Anthracen-Krone, Misumi 1980
Ebenfalls 1980 synthetisierte Shinkai eine Anthracen-Einheit als Photo-Antennenmolekül mit einer Azobenzolgruppe.[7] und wies erstmals die Existenz von Molekülen mit ein-aus-Schaltern nach. In diesem Molekül löst Licht eine cis-trans-Isomerisierung der Azogruppe aus, woraus eine Ringvergrößerung resultiert. Das bedeutet, dass der Kronenether in der trans-Form bevorzugt Ammonium-, Lithium- und Natrium-Ionen bindet, während er in der cis-Form Kalium und Rubidium aufnimmt. In der Dunkelreaktion findet die Rückreaktion der Isomerisierung statt.
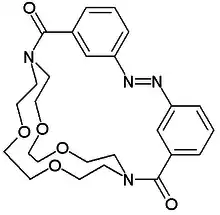 Molekularer Schalter, Shinkay 1980
Molekularer Schalter, Shinkay 1980
Shinkai nutzt diesen Hinweis auf Ionentransport, um die biochemische Reaktion von Monensin und Nigericin zu kopieren:[8][9] In einem zwei-Phasen-System werden die Ionen in der einen Phase, initiiert durch Licht, aufgenommen und in der anderen Phase im Dunklen wieder freigesetzt.
Mechanisch ineinandergreifende molekulare Schalter
Einige der am meisten entwickelten molekularen Schalter basieren auf mechanisch ineinandergreifenden molekularen Architekturen, wobei der bistabile Zustand in der Position des Makromoleküls variiert. 1991 wies Stoddart[10] auf ein Pendelmolekül hin, das, basierend auf Rotaxan zwischen zwei Dockingstationen pendelt wie eine Perle auf der Schnur. Stoddart sagte voraus, dass aus dem Pendel eine molekulare Maschine wird, wenn die Stationen ähnlich sind wie die von außen angeregten Stationen. 1993 wurde Stoddart von Fritz Vögtle, dem Pionier der supramolekularen Chemie, überholt, der einen molekularen Schalter entwickelt hat, der nicht auf Rotaxan, sondern auf Catenan basiert.[11][12]
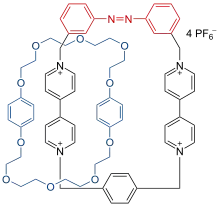

Diese Verbindung basiert auf einem Zwei-Ring-System: ein Ring hält den photoschaltbaren Azobenzol-Ring und zwei Dockingstationen und der andere Ring ist ein Polyether mit zwei aromatischen Ringen mit einer Bindungsaffinität zu den Paraquat-Einheiten. In diesem System zeigt die NMR-Spektroskopie, dass die azo-trans-Form des Polyethers frei um den Partner-Ring rotieren kann, die Rotation aber gestoppt wird, sobald Licht die Isomerisierung zur cis-Form initiiert.
1994 modifizierten Kaifer und Stoddart ihr molekulares Pendel[13] in der Weise, dass eine elektronenarme vierfachgeladene Cyclophan-Kation-Perle die Wahl zwischen zwei Dockingstationen hat: einem Biphenol und einem Benzidin. Bei Raumtemperatur in Lösung zeigt die NMR-Spektroskopie, dass die Perle mit einem Tempo pendelt, das sich auf der NMR-Zeitskala befindet. Reduziert man die Temperatur auf 229 K, zeigen die Signale, dass die Benzidin-Station mit 84 % bevorzugt wird. Jedoch bei Zugabe von Trifluoressigsäure werden die Stickstoffatome des Benzidinrings protoniert, so dass die Perle permanent an der Biphenol-Station fixiert wird. Den gleichen Effekt erhält man bei einer elektrochemischen Oxidation, bei der das Benzidin-Radikalion gebildet wird, und natürlich sind beide Prozesse reversibel.
Im Jahre 2007 wurden Pendel in einer experimentellen DRAM-Schaltung verwendet.[14] Die Schaltung besteht aus 400 Schichten Silicium-Nanometer-Eletroden (16 nm Breite bei 33 nm Zwischenraum) überkreuzt durch weitere 400 Titan-Nanometer-Elektroden mit ähnlichen Dimensionen, die eine einfache Schicht des Rotaxans umfassen, wie unten gezeigt:
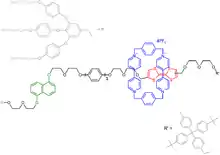
Jeder Bit des Gerätes besteht aus einer Silikon- und einer Titan-Querstange mit 100 Rotaxan-Molekülen, die den Raum zwischen ihnen rechtwinklig angeordnet ausfüllen. Der hydrophile Stopper auf der linken Seite (grau) ist speziell gefertigt, um das Silikonkabel (hydrophil gemacht durch Phosphor-Dotierung) zu verankern, während der hydrophobe Tetraphenylmethan-Stopper entsprechend die hydrophobe Titan-Elektrode befestigt. Im Grundzustand befindet sich der Paraquat-Ring um die Tetrathiafulven-Einheit (rot) herum und bewegt sich zu der Naphthalin-Einheit (grün), sobald die Fulvalen-Einheit durch Strom oxidiert wird. Wenn das Fulvalen zurückreduziert wird zur metastabilen Leitfähigkeit, wird Zustand 1 wieder gebildet, der mit einer Halbwertszeit von ungefähr einer Stunde in den Grundzustand zurückfällt. Das Problem eines Defekts wird umgangen durch Verwendung einer defekt-toleranten Architektur, die man im Teramac-Projekt findet. Auf diese Weise erhält man einem Schaltkreis von 160.000 bits in der Größenordnung eines Leukozyten, das sind 1011 bits pro Quadratzentimeter.
Lichtemittierende organische Transistoren
Wissenschaftler haben lichtemittierende organische Transistoren realisiert, die durch Lichtpulse ferngesteuert werden können. Dazu werden lumineszierende Polymere mit photoschaltbaren Molekülen kombiniert. Organische lichtemittierende Transistoren, eine Art Symbiose aus organischem Transistor (OTFT) und organischer Leuchtdiode (OLED), sind Schlüsselkomponenten für verschiedene optoelektronische Anwendungen im Displaybereich.[15]
Literatur
- Ben Feringa, W.R. Brown: Molecular switches, Wiley-VCH 2011, ISBN 978-3-527-63442-2
- W. Velema, W. Szymanski, B. Feringa: Pharmakology: Beyond Proof of Principle, J. Am. Chem. Soc 2014, 136 (6), 2178-2191, doi:10.1021/ja413063e
- Lili Hou, Xiaoyan Zhang, Giovanni F. Cotella, Giuseppe Carnicella, Martin Herder, Bernd M. Schmidt, Michael Pätzel, Stefan Hecht, Franco Cacialli & Paolo Samorì: Optically switchable organic light-emitting transistors, Nature Nanotechnology (2019), 18. Februar 2019, DOI: 10.1038/s41565-019-0370-9.
Einzelnachweise
- Jean-Pierre Sauvage, Valeria Amendola (Hrsg.): Molecular machines and motors. Springer, Berlin/Heidelberg/New York 2001, ISBN 3-540-41382-0.
- Angela Mammana, Gregory T. Carroll, Ben L. Feringa: Circular Dichroism of Dynamic Systems: Switching Molecular and Supramolecular Chirality. In: Nina Berova, Prasad L. Polavarapu, Koji Nakanishi, Robert W. Woody (Hrsg.): Comprehensive Chiroptical Spectroscopy. John Wiley & Sons, Inc., 2012, ISBN 978-1-118-12039-2, S. 289–316, doi:10.1002/9781118120392.ch8.
- Ben L. Feringa, Richard A. van Delden, Nagatoshi Koumura, Edzard M. Geertsema: Chiroptical Molecular Switches. In: Chemical Reviews. Band 100, Nr. 5, 1. Mai 2000, ISSN 0009-2665, S. 1789–1816, doi:10.1021/cr9900228.
- Jean-Pierre Desvergne, Henri Bouas-Laurent: Cation complexing photochromic materials involving bisanthracenes linked by a polyether chain. Preparation of a crown-ether by photocycloisomerization. In: Journal of the Chemical Society, Chemical Communications. Nr. 9, 1. Januar 1978, doi:10.1039/C39780000403.
- Henri Bouas-Laurent, Alain Castellan, Jean-Pierre Desvergne: From anthracene photodimerization to jaw photochromic materials and photocrowns. In: Pure and Applied Chemistry. Band 52, Nr. 12, 1980, S. 2633–2648 (iupac.org [PDF; abgerufen am 18. September 2015]).
- Isamu Yamashita, Mieko Fujii, Takahiro Kaneda, Soichi Misumi, Tetsuo Otsubo: Synthetic macrocyclic ligands. II. Synthesis of a photochromic crown ether. In: Tetrahedron Letters. Band 21, Nr. 6, 1980, S. 541–544, doi:10.1016/S0040-4039(01)85550-7.
- Seiji Shinkai, Takahiro Nakaji, Yoshihiro Nishida, Toshiyuki Ogawa, Osamu Manabe: Photoresponsive crown ethers. 1. Cis-trans isomerism of azobenzene as a tool to enforce conformational changes of crown ethers and polymers. In: Journal of the American Chemical Society. Band 102, Nr. 18, 1. August 1980, S. 5860–5865, doi:10.1021/ja00538a026.
- Seiji Shinkai, Takahiro Nakaji, Toshiyuki Ogawa, Kazuyoshi Shigematsu, Osamu Manabe: Photoresponsive crown ethers. 2. Photocontrol of ion extraction and ion transport by a bis(crown ether) with a butterfly-like motion. In: Journal of the American Chemical Society. Band 103, Nr. 1, 1. Januar 1981, S. 111–115, doi:10.1021/ja00391a021.
- Seiji Shinkai: Switch-functionalized systems in biomimetic chemistry. In: Pure and Applied Chemistry. Band 59, Nr. 3, 1987, S. 425–430 (iupac.org [PDF; abgerufen am 18. September 2015]).
- Pier Lucio Anelli, Neil Spencer, J. Fraser Stoddart: A molecular shuttle. In: Journal of the American Chemical Society. Band 113, Nr. 13, 1. Juni 1991, S. 5131–5133, doi:10.1021/ja00013a096.
- Fritz Vögtle, Walter Manfred Müller, Ute Müller, Martin Bauer, Kari Rissanen: Photoswitchable Catenanes. In: Angewandte Chemie International Edition in English. Band 32, Nr. 9, 1. September 1993, S. 1295–1297, doi:10.1002/anie.199312951.
- Andrew C. Benniston, Anthony Harriman: A Light-Induced Molecular Shuttle Based on a [2]Rotaxane-Derived Triad. In: Angewandte Chemie International Edition in English. Band 32, Nr. 10, 1. Oktober 1993, S. 1459–1461, doi:10.1002/anie.199314591.
- Richard A. Bissell, Emilio Córdova, Angel E. Kaifer, J. Fraser Stoddart: A chemically and electrochemically switchable molecular shuttle. In: Nature. Band 369, Nr. 6476, 12. Mai 1994, S. 133–137, doi:10.1038/369133a0.
- Jonathan E. Green u. a.: A 160-kilobit molecular electronic memory patterned at 1011 bits per square centimetre. In: Nature. Band 445, Nr. 7126, 25. Januar 2007, S. 414–417, doi:10.1038/nature05462.
- Pressebericht der Humboldt-Universität Berlin