Siderophore
Die Siderophore (gr. Eisenträger) sind eine Stoffgruppe von rund 200 eisenbindenden niedermolekularen Verbindungen und Oligopeptiden, die von aeroben Bakterien, Pilzen und Pflanzenwurzeln gebildet und in das umgebende Medium ausgeschieden werden. Nach der Komplexierung der Eisen-Ionen werden die beladenen Siderophore von den Zellen der Produzenten über spezifische Transportsysteme wieder aufgenommen. Eine Besonderheit der Siderophore ist ihre geringe molare Masse von 300 bis 2.000 Dalton. Manche Pflanzen bilden ebenfalls Eisen komplexierende Substanzen. Diese werden Phytosiderophore genannt.[1]
Vorkommen in der Natur
Bekannte Siderophore sind die Enterobactine, die von Enterobakterien hergestellt werden, die Ferrioxamine der Actinobakterien, die Pyoverdine in Pseudomonas, die Mycobactine und Exocheline der Mycobakterien, die Ferrichrome der Pilze und die citrathaltigen Siderophore bei Pilzen und Bakterien. Siderophore werden nur von aeroben Bakterien, Pilzen und Pflanzenwurzeln gebildet und konnten in teils hohen Konzentrationen im Boden und Meerwasser nachgewiesen werden.
Eigenschaften und biologische Bedeutung
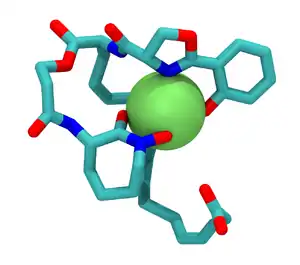
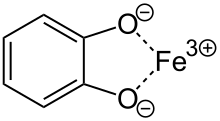
Siderophore sind kleine Moleküle, die zu den Catecholaten, Hydroxamaten oder zu den α-Hydroxy/α-Ketocarbonsäuren gehören. Daneben gibt es gemischt-funktionelle Siderophore, die auch Stickstoff-Liganden besitzen, sowie kurze Peptide mit ungewöhnlichen Modifikationen (wie die Pyoverdine). Allen diesen ist gemeinsam, dass sie einen mehrzähnigen Liganden bilden, der ein Metallion mit sechs, selten vier Zentren bindet. Die geringe Größe der Moleküle erlaubt es ihnen, die Zellwand von Bakterien, Pilzen oder Pflanzen zweimal durch relativ enge Kanäle zu durchqueren. Die Eisentransportproteine höherer Lebewesen (beispielsweise Transferrin) besitzen eine molare Masse von etwa 80.000 Dalton (Siderophore 300 bis 2.000).
Eisentransport und -speicherung
Siderophore binden sehr selektiv Eisen(III)-Ionen, die dann in die Zellen transportiert werden können. Trotz der großen Menge an in der Natur vorkommendem Eisen besitzt dies eine sehr geringe Bioverfügbarkeit, da es meist als unlöslicher Hydroxokomplex vorliegt. Die hohe Affinität der Siderophore zu Fe(III)-Ionen erlaubt es ihnen, die geringe Bioverfügbarkeit dieses Ions auszugleichen. Da die Komplexbindungskonstante der Siderophore für Fe(II)-Ionen sehr viel geringer ist als für dreiwertiges Eisen, wird das Metallion in der Zelle nach Reduktion zu Eisen(II) aus dem Komplex gelöst. Weitere Bedeutung kommt diesen Molekülen als Lagersystem für Eisen zu; d. h., die mit Eisen beladenen Siderophore können innerhalb der Zellen gelagert werden.
Pathologie
| Komplex | Stabilitätskonstante bei pH 7 |
|---|---|
| Fe(III)-Enterobactin | 1056 |
| Fe(III)-Ferrioxamin E | 1032 |
| Fe(III)-Ferrichrom A | 1029 |
| Fe(III)-Transferrin A | 1024 |
| Fe(III)-EDTA | 1025 |
Enterobactin und andere bakterielle Siderophore bilden wesentlich stabilere Komplexe mit Eisen(III) als die Siderophore des Menschen. Sie sind daher in der Lage, im menschlichen Körper Eisen von Hämoglobin (nach Hämolyse) und Transferrin „zu stehlen“.[2]
Biosynthese
Die Produktion der Siderophore wird über einen speziellen Regelkreis an die Eisenkonzentration innerhalb der Zelle gekoppelt. Das Protein FUR (ferric uptake regulator) bindet Zink(II)- und Eisen(II)-Ionen, verändert dadurch seine Konformation und fungiert so als aktiver Repressor der Eisenaufnahmegene.[3] Ist in der Zelle nicht mehr genügend zweiwertiges Eisen vorhanden, so wird die Siderophor-Produktion angeregt und die Zell-Transportkanäle für Eisen werden geöffnet.
Für die Synthese an sich werden meist Aminosäuren als Basis verwendet, welche durch große modulare Multienzymkomplexe der Nichtribosomalen Peptidsynthetasen (NRPS) fließbandartig zusammengebaut werden zu dem nichtribosomalen Peptid; der Prozess hat Ähnlichkeiten mit der Fettsäuresynthese durch Carrier-Enzyme.
Anwendung als Chelatoren
Es ist bekannt, dass Pyoverdine, die sehr variabel aufgebaut sein können, auch als Chelatoren für Schwermetalle wie Uran und Thorium fungieren können.[4]
Beispiele
Literatur
- M. Miethke, M. A. Marahiel: Siderophore-based iron acquisition and pathogen control. In: Microbiol. Mol. Biol. Rev.. 71, Nr. 3, September 2007, S. 413–51. doi:10.1128/MMBR.00012-07. PMID 17804665. PMC 2168645 (freier Volltext).
- J. H. Crosa, C. T. Walsh: Genetics and assembly line enzymology of siderophore biosynthesis in bacteria. In: Microbiol. Mol. Biol. Rev.. 66, Nr. 2, Juni 2002, S. 223–49. PMID 12040125. PMC 120789 (freier Volltext).
- J. Gobin, M. A. Horwitz: Exochelins of Mycobacterium tuberculosis remove iron from human iron-binding proteins and donate iron to mycobactins in the M. tuberculosis cell wall. In: J. Exp. Med.. 183, Nr. 4, April 1996, S. 1527–32. PMID 8666910. PMC 2192514 (freier Volltext).
- J. Gobin, C. H. Moore, J. R. Reeve, D. K. Wong, B. W. Gibson, M. A. Horwitz: Iron acquisition by Mycobacterium tuberculosis: isolation and characterization of a family of iron-binding exochelins. In: Proc. Natl. Acad. Sci. U.S.A.. 92, Nr. 11, Mai 1995, S. 5189–93. PMID 7761471. PMC 41874 (freier Volltext).
- G. A. Snow: Mycobactins: iron-chelating growth factors from mycobacteria. In: Bacteriol Rev. 34, Nr. 2, Juni 1970, S. 99–125. PMID 4918634.
- N. Noinaj, N. C. Easley u. a.: Structural basis for iron piracy by pathogenic Neisseria. In: Nature. Band 483, Nummer 7387, März 2012, S. 53–58, doi:10.1038/nature10823, PMC 3292680 (freier Volltext), PMID 22327295.
Weblinks
- Siderophores bei der Universität Tübingen
Einzelnachweise
- S. M. Kraemer, D. E. Crowley, R. Kretzschmar: Geochemical Aspects of Phytosiderophore‐Promoted Iron Acquisition by Plants. In: Advances in Agronomy. Band 91. Academic Press, 2006, S. 1–46, doi:10.1016/S0065-2113(06)91001-3.
- Joseph W. Lengeler, G. Drews, Hans Günter Schlegel: Biology of the prokaryotes. Thieme, Stuttgart 1999, ISBN 3-13-108411-1, S. 183 ff.
- Georg Fuchs, Hans Günter Schlegel, Thomas Eitinger: Allgemeine Mikrobiologie. 10., unveränderte Auflage. Georg Thieme Verlag, Stuttgart 2017, ISBN 978-3-13-241885-1.
- J. R. Brainard, B. A. Strietelmeier, P. H. Smith , P. J. Langston-Unkefer: Actinide binding and solubilization by microbial siderophores. In: Radiochim. Acta. 58–59, 1992, S. 357–363. doi:10.1524/ract.1992.5859.2.357.