Hirntumor
Als Hirntumor oder Gehirntumor, auch Gehirngeschwulst, werden Tumoren des neuroektodermalen Gewebes des zentralen Nervensystems bezeichnet. Andere intrakranielle Tumoren, wie zum Beispiel Meningeome, zählen nicht zu den Hirntumoren im engeren Sinne. Da sie jedoch ab einer gewissen Größe durch die Raumforderung[1] immer auch Hirnstrukturen beeinflussen, werden sie zu den Hirntumoren im weiteren Sinne gerechnet.
| Klassifikation nach ICD-10 | |
|---|---|
| D33 | Gutartige Neubildung des Gehirns und Zentralnervensystems |
| D33.0 | Gehirn, supratentoriell |
| D33.1 | Gehirn, infratentoriell |
| D33.2 | Gehirn, nicht näher bezeichnet |
| D33.3 | Hirnnerven |
| D33.4 | Rückenmark |
| D33.7 | Sonstige Teile des Zentralnervensystems |
| D33.9 | Zentralnervensystem, nicht näher bezeichnet |
| D43 | Neubildung unsicheren oder unbekannten Verhaltens des Gehirns und des Zentralnervensystems |
| D43.0 | Gehirn, supratentoriell |
| D43.1 | Gehirn, infratentoriell |
| D43.2 | Gehirn, nicht näher bezeichnet |
| D43.3 | Hirnnerven |
| D43.4 | Rückenmark |
| D43.7 | Sonstige Teile des Zentralnervensystems |
| D43.9 | Zentralnervensystem, nicht näher bezeichnet |
| C71 | Bösartige Neubildung des Gehirns |
| C71.0 | Zerebrum, ausgenommen Hirnlappen und Ventrikel |
| C71.1 | Frontallappen |
| C71.2 | Temporallappen |
| C71.3 | Parietallappen |
| C71.4 | Okzipitallappen |
| C71.5 | Hirnventrikel |
| C71.6 | Zerebellum |
| C71.7 | Hirnstamm |
| C71.8 | Gehirn, mehrere Teilbereiche überlappend |
| C71.9 | Gehirn, nicht näher bezeichnet |
| C72 | Bösartige Neubildung des Rückenmarkes, der Hirnnerven und anderer Teile des Zentralnervensystems |
| C72.1 | Cauda equina |
| C72.2 | Nn. olfactorii (I. Hirnnerv) |
| C72.3 | N. opticus (II. Hirnnerv) |
| C72.4 | N. vestibulocochlearis (VIII. Hirnnerv) |
| C72.5 | Sonstige und nicht näher bezeichnete Hirnnerven |
| C72.8 | Gehirn und andere Teile des Zentralnervensystems, mehrere Teilbereiche überlappend |
| C72.9 | Zentralnervensystem, nicht näher bezeichnet |
| C79.3 | Sekundäre bösartige Neubildung des Gehirns und der Hirnhäute |
| ICD-10 online (WHO-Version 2019) | |
Die meisten Hirntumoren treten sporadisch, das heißt ohne erkennbaren familiären Zusammenhang, auf. Im Rahmen einiger neurokutaner Syndrome (Phakomatosen) kommen Hirntumoren gehäuft vor. Hierzu zählen unter anderem Neurofibromatose, Tuberöse Sklerose und von Hippel-Lindau-Syndrom. Sehr selten sind Li-Fraumeni-Syndrom, Turcot-Syndrom und das Rhabdoid-Prädispositionssyndrom.
Die Diagnose wird über bildgebende Verfahren und eine Hirnbiopsie gestellt. Die Behandlung richtet sich nach der Lokalisation des Tumors, der Größe, dem Ursprungsgewebe und dem Allgemeinzustand des Patienten. Typischerweise steht an erster Stelle die operative Entfernung des Tumors (Resektion, ggf. Wachkraniotomie), bei bösartigen Tumoren unter Umständen gefolgt von einer Bestrahlung und/oder Chemotherapie.
Formen und Einteilung
Der Hirntumor oder auch Gehirntumor umfasst eine Fülle verschiedener Tumorerkrankungen im Gehirn. Die ursprüngliche Bedeutung des Wortes Tumor stammt aus dem Lateinischen und bedeutet „Schwellung“. Ein Hirntumor ist eine Zellwucherung des Gehirns oder, im weiteren Sinne, der umgebenden Strukturen wie der Hirnhäute oder Hirnnerven. Dabei wachsen entartete Zellen (Krebszellen) ungebremst im Gehirngewebe und bilden Geschwulste. Während gutartige Gehirntumoren in der Regel langsam wachsen und sich deutlich gegenüber gesundem Gewebe abgrenzen, wachsen bösartige Gehirntumoren schneller und dringen zugleich aggressiv in das umliegende Gehirngewebe hinein. Die umgebenden, gesunden Gehirnzellen werden dabei teilweise oder ganz zerstört. Mitunter können sich gutartige Gehirntumoren im Verlauf der Erkrankung zu bösartigen Tumoren verwandeln. Im Unterschied zu vielen anderen Tumorerkrankungen kann auch der gutartige Hirntumor lebensbedrohend werden, weil der Schädel die Ausweichmöglichkeiten des gesunden Gehirngewebes begrenzt. Der Tumor drückt verstärkt auf die empfindlichen Gehirnzellen und schränkt deren Funktion ein oder schädigt sie. Gutartige und bösartige Hirntumoren gehören zu den seltenen Tumorformen. Sie machen ungefähr zwei Prozent aller Krebserkrankungen aus. Bei Kindern treten sie vergleichsweise häufiger in Erscheinung als bei Erwachsenen. Der Arzt unterscheidet grundsätzlich zwischen einem primären und einem sekundären Hirntumor. Während sich der primäre Hirntumor aus den Gehirnzellen oder den Zellen der Hirnhäute entwickelt, bilden sich sekundäre Gehirntumoren immer infolge von Tochtergeschwulsten (Metastasen) anderer Krebserkrankungen. Diese siedeln sich von der ursprünglichen Krebserkrankung (z. B. Lungenkrebs, Hautkrebs) ab und wandern über die Blut- oder Lymphbahnen sowie das Nervenwasser (Gehirnflüssigkeit, Liquor) in das Gehirngewebe ein. Sekundäre Gehirntumoren sind also Geschwulste, die sich beispielsweise aus entarteten Haut- oder Lungenzellen im Gehirn entwickeln.
Neben der Einteilung in die Kategorien gut- oder bösartig sowie primär oder sekundär klassifizieren Mediziner den Hirntumor anhand des verursachenden Gewebetyps. Denn das Gehirn besteht über die eigentlichen Nervenzellen hinaus aus verschiedenen, anderen Zelltypen:
- Neurinome: Tumoren aus Nervenzellen
- Meningeome: Tumoren aus Zellen der Hirnhäute
- Gliome: Tumoren aus Gliazellen des Gehirns, die das Stütz- und Versorgungsgerüst für die Nervenzellen bilden
- Lymphome: Tumoren aus bestimmten Zellen des Immunsystems, sogenannten Lymphozyten
- Medulloblastome: Tumoren aus embryonalen (unreifen und undifferenzierten) Zellen im Gehirn
- Ependymome: Tumoren aus Zellen, die das Deckgewebe des Nervensystems bilden
- Mischtumoren: Tumoren aus verschiedenen Zelltypen im Gehirn
Neuroonkologie und Ursachen
Risikofaktoren und Ursache für die Entstehung von Hirntumoren sind überwiegend unbekannt, die Neuroonkologie beschäftigt sich mit den Ursachen und den klinischen Eigenschaften, mit der Erkennung und Behandlung von Hirntumoren. Nach derzeitigem Wissensstand führen weder Umweltfaktoren, Ernährungsgewohnheiten, seelische Belastungen, Stress noch elektromagnetische Felder im Frequenzbereich des Mobilfunks zu einem höheren Hirntumor-Risiko. Auch besteht kein Zusammenhang zwischen Hirnverletzungen und dem Auftreten von Hirntumoren.
Einzig die direkte, radioaktive Bestrahlung des Kopfes im Kindesalter, wie sie mitunter für die Behandlung anderer ernsthafter Erkrankungen notwendig wird, steigert das Risiko geringfügig, als Erwachsener an einem Hirntumor zu erkranken. In sehr seltenen Fällen ist die Erkrankung erblich bedingt und geht mit Erbkrankheiten einher, wie der Neurofibromatose Typ 1 und 2, dem Turcot-Syndrom, dem Hippel-Lindau-Syndrom und dem Li-Fraumeni-Syndrom.
Bei der Neurofibromatose vom Typ 1 (Morbus Recklinghausen) treten neben anderen Tumoren auch Gliome auf, insbesondere pilozytische Astrozytome, Hirntumoren, die häufig (beidseitig) am Sehnerv liegen. Charakteristisch für den Neurofibromatose-Typ-2 sind beidseitig gelegene Akustikusneurinome, Tumoren des Rückenmarks oder multiple Meningeome. Das Turcot-Syndrom kann bei Kindern zu Medulloblastomen, bei Erwachsenen zum Glioblastom führen. Mit dem Hippel-Lindau-Syndrom sind hauptsächlich Hämangiome im Bereich des Kleinhirns und Rückenmarks assoziiert, mit dem Li-Fraumeni-Syndrom neben ganz unterschiedlichen Tumoren auch Astrozytome und Plexuskarzinome.
Symptome
Die Symptome bzw. Anzeichen, die ein Hirntumor auslösen kann, sind sehr vielfältig und abhängig von der Lokalisation des Tumors. Sie treten einzeln oder in Kombination auf und werden in vier Hauptgruppen unterteilt:
Hirndruckzeichen
- Kopfschmerz (neu auftretend, besonders nachts und morgens)
- Übelkeit und Erbrechen
- Bewusstseinsstörung (Benommenheit bis zum Koma)
- Stauungspapille (Ödem der Netzhaut des Auges)
- verlangsamter Puls
Neurologischer Ausfall
- Taubheitsgefühl (in einer Körperhälfte, an einzelnen Gliedmaßen)
- Muskelschwäche und Lähmungserscheinung
- Schwindel
- Schwerhörigkeit
- Sprachstörung
- Sprechstörung
- Schluckstörung
- Sensibilitätsstörung (z. B. bezüglich Hitze, Kälte, Druck oder Berührung)
- Sehstörung (z. B. verschwommen Sehen, Gesichtsfeldausfälle)
Epileptische Anfälle
- einfache fokale Anfälle
- komplexe fokale Anfälle
- generalisierte Anfälle
Psychische Veränderungen
- Persönlichkeitsveränderung (z. B. leichte Reizbarkeit, erhöhte Ablenkbarkeit)
- Veränderung der psychischen Gesundheit (Depression, Apathie, Angst)
- Beeinträchtigung des Gedächtnisses (Konzentrationsstörungen, Vergesslichkeit)
- Desorientierung
Heilung
Bei einem Hirntumor lässt sich der Verlauf nicht grundsätzlich vorhersagen. Bei manchen Tumorarten sind die Heilungschancen günstig, bei anderen gilt eine Heilung als unwahrscheinlich. Die Erfolgsaussichten bei der Behandlung eines Hirntumors hängen unter anderem von folgenden Faktoren ab:
- Lage des Hirntumors
- Art der Tumorzellen und damit verbundenes Wachstumsverhalten
- Empfindlichkeit der Tumorzellen auf Strahlen- und Chemotherapie
Diagnostik
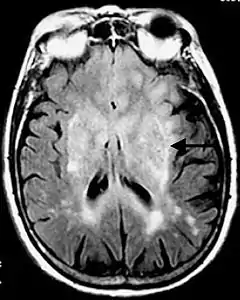
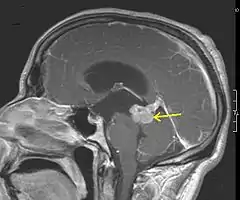
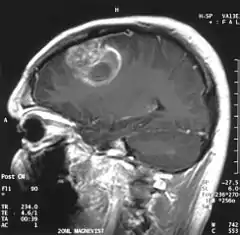
Bei Verdacht auf einen Hirntumor steht eine Reihe von diagnostischen Verfahren zur Verfügung. Nach Anamneseerhebung und klinischer Untersuchung können bildgebende und gewebsanalytische Methoden eingesetzt werden, um eine gezielte Diagnose stellen zu können. Zu den präoperativen, diagnostischen Verfahren zählen:
Computer-Tomographie (CT)
Bei einer Computertomographie (CT) handelt es sich um eine computergestützte Auswertung von mehreren, aus verschiedenen Richtungen aufgenommenen Röntgenbildern, um ein dreidimensionales Abbild des betroffenen Objekts zu erhalten. Dies ermöglicht, im Gegensatz zu herkömmlichen Röntgenaufnahmen, Aussagen über die Volumenstruktur eines durchleuchteten Körpers zu treffen.
Der Vergleich von ausgesandter und empfangener Strahlenintensität gibt Aufschluss über die Abschwächung (Absorption) durch das zu untersuchende Gewebe, wobei der Absorptionsgrad in Grauwerten und mit Hilfe des Hounsfield-Index angegeben wird.
Magnetresonanztomographie (MRT)
Die Magnetresonanztomographie (MRT), auch Kernspintomographie genannt, ist ein diagnostisches Schnittbildverfahren zur Darstellung von Organen und Geweben mit Hilfe von Magnetfeldern. Im Tomographen wird ein starkes Magnetfeld angelegt, wobei sich die Atomkerne (meist Wasserstoffkerne/Protonen) des menschlichen Körpers anhand des magnetischen Feldes ausrichten. Es folgt eine gezielte Änderung dieser Anordnung durch einen Frequenzimpuls, welcher die Atomkerne aus den Magnetfeldlinien lenkt und ihre Taumelbewegung synchronisiert.
Funktionelle Magnetresonanztomographie (fMRT)
Die funktionelle Magnetresonanztomographie (fMRT) im engeren Sinn bezeichnet Verfahren, welche aktivierte Hirnareale (meist basierend auf der Blutoxygenierung) mit hoher räumlicher Auflösung darstellen können.[2] Die Verwendung der Methode kann unter anderem bei der Planung einer neurochirurgischen Operation sinnvoll sein, um beispielsweise einen Tumor von der für Bewegungen wichtigen Hirnregion abzugrenzen.[3] So kann mit Hilfe der fMRT gegebenenfalls der am besten geeignete Zugangsweg zum Tumor gefunden werden oder überprüft werden, ob ein Eingriff überhaupt sinnvoll und möglich ist.
Magnetresonanzspektroskopie (MRS)
Die Magnetresonanzspektroskopie (MRS) ist ein diagnostisches Verfahren zur Darstellung von biochemischen Prozessen bzw. Stoffwechselvorgängen. Hauptsächlich werden dabei die Techniken der Magnetresonanztomographie genutzt. Während beim MRT die Signale des Wasserstoffatoms analysiert werden, sind es beim MRS zusätzlich die Signale von Zucker, Neurotransmittern oder deren Stoffwechselprodukten.
Positronen-Emissions-Tomographie (PET)
Die Positronen-Emissions-Tomographie (PET) findet bei stoffwechselbezogenen Fragestellungen der Neuroonkologie ihre Anwendung. Tumorzellen weisen im Vergleich zu gesunden Körperzellen eine erhöhte Stoffwechselrate auf, was sich in einem gesteigerten Bedarf an Glukose und Aminosäuren widerspiegelt. Diese Eigenschaft von Tumoren macht man sich in der PET zunutze. Der Patient bekommt schwach radioaktiv-markierte Substanzen (Tracer) verabreicht, welche den körpereigenen Metaboliten entsprechen und von den Zellen als solche aufgenommen, jedoch nicht verstoffwechselt werden. Dies ermöglicht die Visualisierung von Zellen und Geweben (v. a. sich schnell ausbreitende Tumore) mit erhöhter Stoffwechselaktivität.
Hirnbiopsie
Die Kenntnis der Histologie ist im Therapiekonzept jeder Tumorerkrankung von entscheidender Bedeutung. Selbst durch die heute zur Verfügung stehenden Methoden der CT, MRT und PET mit höchster Bildgebungsqualität kann die Diagnostik nicht vollständig gesichert werden. In den meisten Fällen ist die weitere Behandlungsplanung von Patienten eng an die histologische Tumordiagnose gebunden. Dabei stellt die durch die Schnittbildgebung gestützte stereotaktische Tumorbiopsie wegen der großen Genauigkeit und der geringen Komplikationsrate ein neurochirurgisches Standardverfahren zur Sicherung der Diagnose dar. Dem Patienten wird hierfür zunächst ein Stereotaxiering mit vier Lokalisatoren am Kopf angebracht. Diese Lokalisatoren beschreiben einen rechteckigen Raum, in dem jeder Punkt durch eine genaue, computerermittelte Angabe der Höhe, Breite und Tiefe beschrieben werden kann. In seltenen Fällen können heute schon Diagnose und Verlaufskontrolle von Therapien auch bereits mit risikoarmen Methoden der sog. Liquid Biopsy (Flüssigbiopsie) aus Blut, zerebrospinaler Flüssigkeit oder auch Urin erfolgen.[4]
Behandlung
Zur Therapie von primären Hirntumoren und Hirnmetastasen stehen hauptsächlich Verfahren der operativen Entfernung, der Strahlen- und der Chemotherapie zur Verfügung. Neben diesen klassischen drei Möglichkeiten gibt es zusätzlich Therapiekonzepte und moderne Ansätze, die im Rahmen klinischer Studien getestet werden oder auch als individueller Heilversuch zur Anwendung kommen können.
Neurochirurgie
Die Neurochirurgie umfasst die Diagnose und operative Behandlung von Erkrankungen, Fehlbildungen und Verletzungen des zentralen Nervensystems (ZNS). Je nach Lage und Größe des Hirntumors sowie dem Zustand und der Symptome des Patienten kann ein Hirntumor weitestgehend entfernt (auch mittels Wachkraniotomie bei bestimmten Hirntumoren) oder auch nur teilentfernt werden. Mitunter ist die neurochirurgische Behandlung gar nicht möglich, der Tumor also inoperabel. Dies ist insbesondere dann der Fall, wenn der Tumor direkt in funktionstragenden Arealen liegt, die durch eine Operation stark beeinträchtigt oder sogar zerstört werden würden.
5-Aminolävulinsäure/Fluoreszenzgestütztes Operieren
Um diffus wachsende, schwer vom umliegenden gesunden Hirngewebe abgrenzbare maligne Gliome möglichst radikal entfernen zu können, kann die Resektion unter der Gabe von 5-Aminolävulinsäure (5-ALA) sinnvoll sein. Hierbei muss der Patient vor dem neurochirurgischen Eingriff eine Lösung aus 5-ALA trinken. Durch einen Enzymdefekt in der Tumorzelle reichert sich die Substanz selektiv hauptsächlich dort an. Während der Operation kann der Neurochirurg dann ein Blaulicht zuschalten, das die Tumorzellen in rot-violetter Farbe fluoreszieren lässt. Der klinische Wert des 5-ALA-Verfahrens wurde in einer internationalen, randomisierten, kontrollierten Studie untersucht. Diese konnte zeigen, dass unter der Gabe von 5-ALA doppelt so viele hirneigene Tumoren radiologisch komplett entfernt wurden und dementsprechend weniger Fälle mit einem postoperativen Resttumor auftraten (35 % unter 5-ALA vs. 50 bis 70 % ohne 5-ALA).
Wachkraniotomie
Bei Tumoren im Bereich der Sprachzentren kann die Operation auch beim wachen, schmerzfreien Patienten erfolgen, um die Sprachfunktion während der Tumorentfernung zu überwachen. Ziel ist hierbei, die benachbarten funktionstragenden Hirnregionen nicht zu schädigen und alle Hirnfunktionen zu erhalten.
Dextroscope Virtual Reality
Die dreidimensionale Operationsplanung im virtuellen Simulator zur präoperativen Simulation des am besten geeigneten minimal invasiven Zugangs und zur Planung der geeigneten OP-Strategie.[5][6]
Navigierte Hirnstimulation
Die „navigierte Hirnstimulation“ (Navigated Brain Stimulation, Abk. NBS) ist ein Verfahren zur Beurteilung der exakten Lokalisation des primären motorischen Kortex. Mit der Methode kann bereits vor der Operation eine individuelle Karte des Bewegungszentrums erstellt werden. Um einen Hirntumor zu operieren, ist es bislang gängige Praxis, die umliegenden Hirnregionen während des Eingriffs zu reizen. Erfolgt darauf eine Reaktion des Patienten, weiß der Chirurg, wo sich Regionen für Sprache und Bewegung befinden. Die Lage dieser Areale kann sich von Mensch zu Mensch unterscheiden. Dadurch erfährt der behandelnde Arzt erst während der Operation, wo die kritischen Gebiete angesiedelt sind. Im Vergleich dazu kann der Neurochirurg mit Hilfe der navigierten Hirnstimulation schon vor der Operation Informationen über wichtige Areale sammeln und die Operationsstrategie optimieren. Das NBS-System stellt die Standard-MRT-Bilder vom Gehirn des Patienten mithilfe einer Kamera und am Patienten angebrachter Fixpunkte in 3D dar. Durch die Stimulation mit einer Magnetspule wird das Bewegungszentrum millimetergenau lokalisiert. Da die Daten aus dem NBS-System in das Neuronavigationsgerät und das Operationsmikroskop eingespielt werden können, stehen sie auch während des neurochirurgischen Eingriffs zur Verfügung. Im Vergleich zur direkten Stimulation des Kortex während der Operation kann Operationszeit eingespart und das Behandlungsergebnis möglicherweise optimiert werden. Derzeit laufen Studien zur Anwendung des NBS auch für Operationen im Sprachzentrum und anderen funktionell wichtigen Arealen.
Neuroendoskopische OP – intrakraniell
Durch Verwendung eines schmalen Neuroendoskops kann das erweiterte Hirnkammersystem inspiziert werden.
Hierzu wird das Endoskop über ein kleines Bohrloch in der Schädeldecke in das Ventrikelsystem eingeführt. Durch verschiedene Winkeloptiken kann jeder Bereich der Hirnkammern vom Endoskop eingesehen werden. Das Einführen von Instrumenten in den Arbeitskanal des Endoskops (kleine Fasszangen, Ultraschallsonden, Koagulations- und Ballonkatheter) erlaubt die Durchführung verschiedener Eingriffe. Den Liquorfluss blockierende Membranen, Septen oder Zysten können eröffnet und gefenstert werden (Septostomien, Zystenwandresektionen und -entleerungen). Tumoren, die im Bereich der Hirnkammern wachsen, können inspiziert und Tumorproben zur feingeweblichen und molekularen Artdiagnose entnommen werden (endoskopische Biopsie). Im Falle eines Verschlusshydrozephalus (Hydrocephalus occlusus) können die inneren Liquorräume am Boden des III. Ventrikels mit den äußeren Liquorräumen, dem Subarachnoidalraum verbunden werden (Ventrikulostomie). Auf diese Weise kann eine freie Liquorpassage zwischen den inneren und äußeren Räumen wiederhergestellt und eine Implantation von Ableitungssystemen (Shuntimplantation) umgangen werden.
Endosonographie und Neuronavigation
Zur Kombination von Neuroendoskopie und moderner Ultraschalltechnik wurden Ultraschallsonden entwickelt, die durch den Arbeitskanal des Endoskops in die Hirnkammern eingebracht werden können. Die Ultraschallsonden erlauben über die Betrachtung der Hirnkammerwände hinaus die Untersuchung des an die Hirnkammern angrenzenden Hirngewebes (Endosonographie). Des Weiteren ermöglichen sie durch kontinuierliche Bilderzeugung eine sichere Steuerung des Endoskops im Ventrikelsystem. Die Neuronavigation ermöglicht die Übertragung von strukturellen und funktionellen Bilddaten (MRT, CT, MR-Angiographie, PET) in das OP Gebiet, welches eine exakte Orientierung und ein genaues Ansteuern von Zielstrukturen ermöglicht. Die Integration des Endoskops in die Neuronavigation gewährleistet die exakte Positionierung des Endoskops und eine sichere Steuerung im Gehirn.
Endoskopisch assistierte Mikroneurochirurgie
Durch Anwendung minimal invasiver Zugänge kann die Belastung des Patienten durch den operativen Eingriff vermindert werden. Kleinere Zugänge verringern andererseits das Sichtfeld des Operateurs. Das eingeschränkte Gesichtsfeld kann durch die assistierte Verwendung der Neuroendoskopie in der offenen Neurochirurgie (Operation durch Öffnung des Schädeldaches) erweitert werden. Das Endoskop, welches mit verschiedenen Winkeloptiken ausgestattet werden kann, wird durch die Schädelöffnung (Trepanation) in das OP-Gebiet eingebracht. Der Operateur kann um wichtige Strukturen herum, also gleichsam „um die Ecke“ sehen. Die endoskopisch assistierte OP-Technik kommt u. a. in der Versorgung von Gefäßwandaussackungen (Aneurysmen), nach Hirnblutung oder in der Entfernung von Tumoren an der Schädelbasis zum Einsatz.
Roboter-assistierte mit computerassistierter Chirurgie
Seit Jahren werden international beispielsweise stereotaktische Biopsien mit dieser Handhabungstechnik durchgeführt.[7][8]
Neurophysiologisches intraoperatives Monitoring
Um bei neurochirurgischen Operationen funktionell wichtige Hirnareale und Sinnesnerven zu schonen, bedient man sich elektrophysiologischer Methoden. So können Prozesse in der Sprachregion in örtlicher Betäubung am wachen Patienten unter Stimulation des Sprachzentrums vorgenommen werden. Durch Ausnutzung der Phasenumkehr bei der Stimulation sensibler Bahnen kann das Bewegungszentrum besser lokalisiert werden und Lähmungen der Extremitäten vorgebeugt werden. Bei der Entfernung von Tumoren am Hör- und Gleichgewichtsnerven werden die akustische Leitungsbahn und der sich in unmittelbarer Nachbarschaft befindliche motorische Gesichtsnerv funktionell überwacht. Damit kann das Hörvermögen in Abhängigkeit von der Tumorgröße erhalten werden und auch die gefürchtete Gesichtslähmung tritt nicht oder nur flüchtig auf. Bei Patienten geben die Ableitungen von Hirnstrombild und die Registrierung von Sinnesreizen (evozierte Potentiale) wichtige Hinweise auf Zustand und Prognose, aber auch OP-Entscheidungen können davon beeinflusst werden.
Multimodales Monitoring
Als multimodales Monitoring wird eine umfassende intraoperative elektrophysiologische Überwachung verschiedener Körperfunktionen, wie z. B. Bewegung oder Sprache bezeichnet. Bei bestimmten Erkrankungen wird dies auch bei sogenannten Wachoperationen, bei denen der Patient unter Aufhebung eines Teils der Narkose verschiedene Parameter erfüllen muss, eingesetzt.[9]
Hirnkartierung oder Brain mapping
Die im letzten Jahrhundert entwickelten Konzepte einer interindividuell konstanten anatomischen Lokalisierung sprachaktiver Areale haben sich nicht halten können, im Gegensatz etwa zum sensomotorischen Cortex, der nahezu keine interindividuelle Variabilität aufweist und oft bereits kernspintomographisch eindeutig zu lokalisieren ist.
Deshalb wurde bei Tumorlokalisationen in oder in der Nähe sprachaktiver Zentren bisher entweder von einer Operation abgesehen, um eine erhebliche Minderung der Lebensqualität des Patienten durch schwere Sprachstörungen (Aphasien) zu vermeiden, oder der Tumor wurde nur teilreseziert in Bereichen weitab vermuteter sprachaktiver Zentren.
OP-Techniken mit intraoperativer elektrophysiologischer Lokalisierung („brain mapping“ oder „electrical stimulation mapping“) sprachaktiver Areale wurden erstmals von Penfield et al. bei Epilepsiechirurgischen Eingriffen vorgestellt. Eine modifizierte Technik wird in einigen neurochirurgischen Zentren heute bei Patienten mit niedergradigen Gliomen oder anderen Läsionen in der Nähe von vermuteten funktions- kritischen, „spracheloquenten“ Arealen angewendet, um durch ein intermittierendes Funktionsmonitoring (elektrische Stimulation corticaler funktionssensitiver Areale und Mapping) die individuelle Lokalisation sprachaktiver Areale exakt zu lokalisieren und somit operationsbedingte neurologische und neuropsychologische Defizite möglichst zu vermeiden. Das „brain mapping“ stellt derzeit vermutlich das sicherste Verfahren zum Nachweis funktioneller Hirnareale dar.[10]
Jedoch ist eine derartige Testung am wachen Patienten trotz schmerzfreier Durchführung mit einer starken psychischen Belastung verbunden und kommt aus unserer Sicht nur für einzelne Patienten in Betracht. Da es sich bei der menschlichen Sprache um ein sehr komplexes Phänomen handelt, können sowohl durch apparative bildgebende Untersuchungen als auch bei der intraoperativ Stimulation unter Verwendung unterschiedlicher Paradigmen immer nur bestimmte Teilaspekte bzw. Funktionen lokalisiert werden. Die Definition „adäquater“ Paradigmen zur prä- und intraoperativen Sprachtestung wird momentan im Bereich der neuropsychologischen Forschung sehr kontrovers diskutiert.
Navigierte transkranielle Magnetstimulation (nTMS)
Die navigierte transkranielle Magnetstimulation (nTMS) kartiert Hirntumoren vor der OP, um zu testen, ob Hirnbereiche für Bewegung oder Sprache betroffen sind.[11]
Hochfeld-Kernspintomographie/Offene Magnetresonanztomografie
Routinemäßige Eingriffe, wie beispielsweise Biopsien, periradikuläre Therapien oder die Katheteranlage für die Brachytherapie werden am offenen Magnetresonanztomographen durchgeführt.
Pädiatrische Hirntumorchirurgie
Die Hirntumoren des Zentralnervensystems bilden neben den Erkrankungen des blutbildenden Systems die häufigsten Neoplasie im Kindesalter. Die häufigste Lokalisation befindet sich in der hinteren Schädelgrube. Es kommen jedoch auch Kinder zur Aufnahme, deren Tumoren in den Hirnkammern des Großhirns oder im Bereich der vorderen Schädelbasis liegen. Die pädiatrische Neurochirurgie stellt spezielle Anforderungen an den Neurochirurgen und bildet ein Spezialgebiet in der Neurochirurgie. Bei Kindern wird nach Möglichkeit stets eine vollständige Tumorexstirpation angestrebt. Postoperativ werden routinemäßig MRT-Kontrollen vorgenommen, die das Ausmaß der Tumorexstirpation dokumentieren. Dies ist eine wichtige Voraussetzung, um objektiv die postoperative Ausgangssituation für u. U. notwendige weitere Therapiemodalitäten darzustellen. Sofern es die Diagnose des Tumors erfordert, werden Strahlen- und/oder Chemotherapie nach bundesweit anerkannten Studienprotokollen durchgeführt. Die Behandlung des Hydrozephalus ist ein weiteres Schwerpunktgebiet in der pädiatrischen Neurochirurgie. Neben einer individuellen ventilgesteuerten Shuntoperation kann durch die endoskopische Ventrikulozisternostomie heute vielfach auf eine Shuntimplantation verzichtet werden. Auch vielkammerige Fehlbildungshydrocephali können so erfolgreich therapiert werden.
Stereotaxie und die „Funktionelle Stereotaxie“
Bei stereotaktischen Eingriffen werden mit Hilfe verschiedener Sonden oder Kanülen punktuelle Hirnoperationen durchgeführt. Grundlage dafür ist ein dreidimensionales Koordinatensystem, das im Ergebnis bildgebender Diagnostik (z. B. durch Computertomographie oder Magnetresonanztomographie) eine millimetergenaue „Vermessung“ des Gehirns ermöglicht. Da die Operation mit einer minimalen Gewebetraumatisierung einhergeht, kann sie in der Regel in örtlicher Betäubung vorgenommen werden. Um eine größtmögliche Genauigkeit zu erzielen, werden besondere Anforderungen an die apparative Ausstattung gestellt.
Bei der tiefen Hirnstimulation wird mit Hilfe eines voll implantierbaren Impulsgenerators über stereotaktisch eingeführte Elektroden eine elektrische Stimulation genau definierter Hirnstrukturen Stereotaxie vorgenommen. Die Stimulationsparameter können nach der Implantation telemetrisch verändert werden, um bei fortschreitender Grundkrankheit die Wirksamkeit der Therapie zu erhöhen oder Nebenwirkungen zu reduzieren.
Strahlentherapie
Bei Strahlentherapie wird energiereiche Strahlung (z. B. aus Photonen oder Elektronen) genutzt, um den Zellteilungsprozess zu stören und die Tumorzellen am Wachstum zu hindern. Beschleunigte, energiegeladene Teilchen treffen auf den Tumorbereich und können das Erbgut der Zellen schädigen. Tumorgewebe ist strahlenempfindlicher als Normalgewebe. Diese Eigenschaft wird bei der Strahlentherapie genutzt, indem Tumorgewebe stärker geschädigt wird als das gesunde Gewebe. Die Strahlentherapie wird nach einem Bestrahlungsplan durchgeführt und erfolgt entweder als alleinige Therapie oder in Kombination mit chirurgischen und chemotherapeutischen Behandlungsverfahren.
Brachytherapie
Der Name Brachytherapie leitet sich von dem griechischen Wort „brachys“ ab, das „kurz“ bedeutet. Kurz ist bei diesem Verfahren der Abstand von Tumor und Strahlenquelle, denn letztere wird direkt in das Gehirn eingesetzt. Diese meist vorübergehende Implantation radioaktiver Körnchen (Seeds, wenige mm lang) erfolgt über dünne Nadeln, die in ein stereotaktisches 3D-Rahmensystem eingebunden sind. Hierzu wird ein kleines Bohrloch im Bereich des Schädels benötigt. Die Brachytherapie ermöglicht durch die direkte Nähe zum Tumor bei geringer Reichweite und somit steilem Dosisabfall die Verabreichung einer hohen lokalen Dosis, bei einer geringeren Einwirkung auf das gesunde Umgebungsgewebe.
Cyberknife
Beim Cyberknife handelt es sich um einen Photonen ausstrahlenden Linearbeschleuniger, der auf einem Industrieroboter befestigt wird. Dieser kann sich dreidimensional im Raum bewegen und drehen, so dass er jede beliebige Position einnehmen kann.
Zur Planung der Bestrahlung wird ein CT vom Kopf des Patienten angefertigt und an das Positionierungssystem des Cyberknife übergeben. Dieses berechnet mit Hilfe von zwei Achsen die genaue Lage des Tumors und leitet die Koordinaten an den Roboter weiter, der während der Behandlung fortlaufend die Lage des Patienten abgleicht. Daher kann bei dieser Behandlungsmethode auf die Befestigung eines Rahmens am Kopf des Patienten verzichtet und trotz kleinerer Bewegungen während der Bestrahlung eine hohe Genauigkeit erzielt werden.
Intensitätsmodulierte Strahlentherapie
Die Intensitätsmodulierte Radiotherapie (IMRT) ist eine Weiterentwicklung der computergestützten dreidimensionalen Bestrahlung. Die Bestrahlungsplanung basiert auf der Schnittbildgebung einer Computertomographie, die eine dreidimensionale Volumenrekonstruktion der zu bestrahlenden Zielvolumina und Risikostrukturen erlaubt. Im Unterschied zur konventionellen 3D-Planung, bei der die Intensität der einzelnen Bestrahlungsfelder über die gesamte Feldfläche konstant ist, werden diese bei der IMRT noch einmal in mehrere kleine Segmente zerlegt. Durch die Überlagerung dieser unregelmäßigen Teilfelder werden sogenannte intensitätsmodulierte Strahlenfelder erzeugt, die zur gewünschten Dosisverteilung führen. Technisch wird diese Modulation u. a. durch Lamellenblenden ermöglicht, die unabhängig voneinander durch das Feld fahren. Somit sind manche Bereiche des gesamten Bestrahlungsfeldes kürzer geöffnet, manche länger. Daraus resultiert ein „Dosisgebirge“. Die IMRT-Bestrahlungsplanung nutzt besondere Algorithmen zur Berechnung der Dosisverteilung.
Eingesetzt wird die intensitätsmodulierte Strahlentherapie, wenn das Zielvolumen eine sehr komplexe Form aufweist oder neben dem Tumor in kurzer Distanz wichtige, kritische und strahlenempfindliche Strukturen liegen. In solchen Fällen ermöglicht die IMRT eine exakte Anpassung der Dosis an das Zielvolumen, in dem sich die Tumorzellen befinden. Somit wird das umliegende Gewebe bestmöglich geschont, wodurch sich die Nebenwirkungen der Behandlung reduzieren lassen. Meist findet die IMRT nur dann Anwendung, wenn die Schonung des gesunden umgebenden Gewebes auf andere, einfachere Art nicht möglich ist.[12]
Gamma Knife
Das Gamma-Knife besteht aus einem halbkugelförmigen Helm, auf dem rund 200 einzelne Kobalt-60-Strahlenquellen angeordnet sind. Diese senden Gammastrahlung aus, also energiegeladene Teilchen, die Gewebe durchdringen. Vor der Behandlung wird mit Hilfe eines Rahmens, der am Kopf des Patienten befestigt wird, die genaue Position des Tumors bestimmt. Unter Umständen ist auch eine Kombination mit anderen bildgebenden Verfahren wie MRT oder PET sinnvoll. Anschließend werden die einzelnen Strahlenquellen mit hoher Genauigkeit auf den Tumor ausgerichtet. Die von jeder einzelnen Quelle geformten Strahlen überlagern sich punktförmig und ergeben zusammen die benötigte Gesamtdosis. Diese wird so bemessen, dass der Tumor hochdosiert bestrahlt werden kann, während das umliegende Gewebe eine niedrige, weniger schädliche Dosis erreicht. Während der Behandlung wird der Patient mehrmals in das Bestrahlungsgerät gefahren, wobei jedes Mal ein anderer Punkt bestrahlt wird. Alle behandelten Punkte zusammen ergeben nach einer Behandlungsdauer von 30–120 Minuten den kompletten Tumor.
Geeignet ist die Behandlung mit dem Gamma-Knife für Metastasen, Akustikus-Neurinome und Neurinome anderer Hirnnerven, Meningeome, Hypophysenadenome sowie Chordome und Chondrosarkome.
Tomotherapie
Bei der Tomotherapie sind CT-Bildgebung und Bestrahlungsgerät kombiniert. Mit einem rotierenden Beschleuniger können sowohl CT-Bilder erzeugt als auch Tumoren bestrahlt werden. Durch die unmittelbare Bildgebung vor der Bestrahlung wird die Lagerung des Patienten überprüft und gegebenenfalls eine Korrektur des Zielvolumens durchgeführt. Die Rotation des Bestrahlungsgerätes wird kombiniert mit einem kontinuierlichen Tischvorschub, was zu einer spiralförmigen Verabreichung der strahlentherapeutischen Dosis führt. So können kleine ebenso wie große Tumoren präzise und intensitätsmoduliert bestrahlt und dabei die umliegenden strahlenempfindlichen Organe relativ dazu geschont werden.
Protonentherapie/Schwerionen- und Protonen-Gantry
Die Protonentherapie verwendet Protonenstrahlen, die zum Beispiel in einem Synchrotron oder Zyklotron erzeugt, beschleunigt und gezielt auf den Tumor geschossen werden. Das Verfahren wird insbesondere bei Patienten angewandt, bei denen die herkömmliche Röntgenbestrahlung nicht ausreichend genutzt werden kann, weil der Tumor entweder zu tief im Körper oder aber von empfindlichen Organen umgeben ist. Die Protonentherapie ermöglicht eine optimierte Dosisverteilung innerhalb der zu bestrahlenden Region.
Antiprotonische Stereographie
Die Antiprotonische Stereographie (ASTER) ist ein hypothetisches bildgebendes und therapeutisches Verfahren. In der ASTER werden Antiprotonen zunächst in einem Strahl in den Körper geschossen und annihilieren dort, nachdem sie von Atomkernen eingefangen worden sind.
Fibertracking
Moderne magnetresonanztomographische Verfahren erlauben neben einer hochauflösenden Darstellung der Struktur des Gehirnes auch eine Analyse der Konnektivität, also der Verbindungen zwischen den einzelnen Bereichen und Zentren. Das Fibertracking beschreibt die Visualisierung von Bahnsystemen beziehungsweise Faserbündeln, die funktionelle Zentren im Gehirn (z. B. die motorische Sprachproduktion und das Sprachverständnis) untereinander verbinden. Die Darstellung dieser Bahnsysteme wird Fibertracking genannt. Man kann diese in die präoperative Zugangsplanung einbeziehen oder auch direkt in das Operationsmikroskop des Operateurs während der Operation einblenden lassen. Das Verfahren nutzt einen Effekt aus, den fließendes Wasser auf die kernspintomographische Bildgebung ausübt. In einem Wasserglas beispielsweise kann Wasser in alle Richtungen gleichmäßig fließen. Eine Bevorzugung irgendeiner Richtung besteht dabei nicht. Man könnte so bei einer Kernspintomographie des Wasserglases an jedem Punkt eine so genannte «Isotropie» messen. Im Gehirn befindet sich Wasser zum einen in Blutgefäßen, zum anderen findet es sich auch im Gewebe innerhalb der Nervenzellen und den darum liegenden Bindegewebszellen. In größeren Faserbündeln kann Wasser also bevorzugt in Richtung der Fasern fließen. Man spricht von einer «fokalen Anisotropie». Diese lässt sich durch spezielle kernspintomographische Messungen für jeden Punkt im Gehirn bestimmen und wird durch einen «Eigenvektor» beschrieben. Eine Weiterentwicklung stellte die 1999 erstmals von Pajevic und Pierpaoli gezeigte Farbkodierung dar, bei der Fasern in Kopf-Fuß-Richtung blau dargestellt, Fasern in Links-rechts-Richtung rot dargestellt und Fasern in Vorn-hinten-Richtung grün dargestellt sind. Dadurch war es möglich, beispielsweise die Pyramidenbahn als starke tief blaue Struktur darzustellen. Bei Tumoren, die sich in der Nähe funktioneller Bahnen befinden, ist das Fibertracking ein standardisierter Bestandteil der Operationsplanung. Dies betrifft vor allem Tumoren nahe dem Sprach-, Seh- und Bewegungszentrum. Bereits im Vorfeld der Operation wird die Darstellung der Bahnsysteme beim Patienten individuell geplant und in die Zugangsplanung mit einbezogen.[13]
Tumortherapiefelder
Tumortherapiefelder (TTFields) oder auch Alternating Electric Field Therapy bezeichnet sind elektrische Wechselfelder, welche beim Tumortyp Glioblastom die Zellteilung stören sollen.[14]
Therapeutische Hyperthermie
Die Behandlung findet in einem Magnetfeldapplikator ('Nano-Activator') statt, welcher ein für normales Gewebe ungefährliches Magnetwechselfeld erzeugt. Durch dieses Feld werden eingebrachte Nanopartikel in Schwingung versetzt, wodurch Wärme direkt im Tumorgewebe entsteht. Abhängig von der erreichten Temperatur und der Behandlungsdauer wird der Tumor zerstört oder für eine begleitende Strahlen- oder Chemotherapie sensibilisiert. Diese Therapie ermöglicht ggf. verlängerte rückfallfreie Überlebenszeiten für Patienten mit Glioblastome-Rezidiv.[15][16]
Bei den Nanopartikeln handelt es sich um sehr kleine, in Wasser gelöste Teilchen aus Eisenoxid mit einer Hülle aus Aminosilanen und einem Durchmesser von ca. 15 Nanometer. Die Partikel werden durch ein Magnetfeld, welches bis zu 100.000 Mal in der Sekunde seine Polarität wechselt, in Schwingung versetzt.
In Abhängigkeit von den erreichten Temperaturen im Tumor und der Behandlungsdauer werden die Tumorzellen entweder irreparabel geschädigt, oder sie werden empfindlicher gegenüber einer begleitenden Radio- oder Chemotherapie.[17]
Boost
In der Strahlentherapie wird der Begriff sowohl für die wiederholte Bestrahlung verwendet[18] als auch für eine nebenwirkungsarme lokale Strahlendosiserhöhung zur Verbesserung der Ansprechrate einer Strahlentherapie.
Chemotherapie
Krebszellen haben die Eigenschaft, sich vermehrt zu teilen und dadurch Geschwülste bzw. Tumoren zu bilden. Chemotherapien bzw. Zytostatika setzen genau hier an. Sie stören die Zellteilung, indem sie sich beispielsweise in die Erbsubstanz von Krebszellen integrieren. Auch können sie für die Zellteilung wichtige Stoffwechselabläufe blockieren. Da sich allerdings auch gesunde Zellen teilen, kommt es durch Zytostatika auch zu Nebenwirkungen, und zwar vor allem dort, wo sich gesunde Zellen auch vermehrt teilen, z. B. in Haut, Schleimhäuten, Haaren und blutbildenden Zellen im Knochenmark. Die meisten dieser Nebenwirkungen klingen nach Beendigung der Chemotherapie wieder ab. In den letzten Jahren werden bei Krebserkrankungen auch immer häufiger sogenannte zielgerichtete Medikamente kombiniert. Dazu zählen insbesondere Antikörper und Kinaseinhibitoren. Je nach Tumorart werden diese Medikamente einzeln oder in Kombination mit Zytostatika eingesetzt. Oft trägt eine Kombination der Medikamente zu einer noch effektiveren Tumorbehandlung bei. Die Wahl der Medikamentenkombination hängt wesentlich von der Art der Krebserkrankung und dem Krankheitsstadium, in dem sich der Patient befindet, ab. Eine Chemotherapie kann in unterschiedlichen Stadien von Krebserkrankungen sinnvoll sein. Zum Teil wird sie vor oder nach der operativen Entfernung eines Tumors eingesetzt (sog. neoadjuvante bzw. adjuvante Behandlung), zum Teil in Kombination mit einer Strahlentherapie und in anderen Fällen auch unabhängig von Operation oder Strahlentherapie.
Darreichungsform einer medikamentösen Therapie
Die meisten Zytostatika werden mittels Infusion über eine Vene verabreicht. Nur wenige Zytostatika können auch als Tablette eingenommen werden. Häufig wird Patienten empfohlen, für die Gabe von Zytostatika einen sog. Port implantieren zu lassen. Ein Port ist ein kleines Reservoir, das in einem ambulanten chirurgischen Eingriff unter die Haut in der Nähe des Schlüsselbeins eingesetzt wird, und eine Verbindung zu großen Venen hat. Dieses Reservoir kann von der Ärztin/dem Arzt punktiert werden, um daran die Infusion mit Zytostatika anzuschließen.
Klinische Studien
Experimentelle Therapieverfahren
Die sogenannten biologischen Therapien bekämpfen Hirntumorzellen durch selektive Beeinflussung ihrer physiologische Eigenschaften oder durch Modulation der physiologischen Umgebung der Tumorzellen. Dazu zählen Gentherapie, Immuntherapie, antiangiogenetische Therapie, sowie Immunotoxintherapie, um nur die bisher am weitesten entwickelten experimentellen Methoden zu nennen. Die tumorselektive Wirkung dieser Methoden in Kombination mit dem ausgezeichneten biologischen Sicherheitsprofil scheinen vielversprechend zu sein, allerdings fehlt immer noch der für eine standardisierte klinische Anwendung erforderliche und nur in großen Studien zu gewinnende Nachweis ihrer Wirksamkeit. Eine unkritische oder unbegründet optimistische Betrachtung der tatsächlichen Effizienz dieser Methoden sollte daher zum jetzigen Zeitpunkt auf jeden Fall vermieden werden.
Immuntherapie
Krebsimmuntherapie bzw. Tumorimpfungen können den Körper im Kampf gegen den Krebs unterstützen. Die Immuntherapie hat zum Ziel, das Immunsystem des Patienten gegen den eigenen Tumor zu sensibilisieren und die Tumorabtötung durch körpereigene Immunzellen (Lymphozyten) einzuleiten. Es werden generell aktive und passive Immuntherapiemethoden unterschieden. Zu den passiven Verfahren zählt die systemische oder lokal-intratumorale Anwendung sogenannter biological response modifiers (BRM), meistens in sehr kleinen Mengen im menschlichen Körper vorkommende natürliche Substanzen, welche das Immunsystem beeinflussen können, z. B. Interferone und Interleukine. Diese Substanzen stimulieren tumorabtötende Immunzellen und sind dadurch in einigen Fällen imstande, eine immunologisch vermittelte Tumorkontrolle herbeizuführen. Zu den aktiven Immuntherapiemethoden Tumorvakzinen, welche einen auf der Basis in Kultur gehaltener patienteneigener Tumorzellen hergestellten Impf-stoff darstellen und meisten unter der Haut des Patienten mehrfach eingespritzt werden. Praktische Erfolge bei der Antitumor-Vakzinierung von Hirntumorpatienten ließen sich bisher im Unterschied zu Patienten mit anderen Tumortypen wie z. B. Hautkrebs (Melanom) noch nicht dokumentieren.
Mäuse mit menschlichen Präsentationsmolekülen
Künftig wollen Mediziner die Behandlungsergebnisse mittels einer Tumorimpfung verbessern. Dazu müssen sie Proteinstrukturen finden, die sich bei Krebszellen und gesunden Zellen unterscheiden. In der Regel sind es Genmutationen im Erbgut der Tumorzellen, die solche Unterschiede bewirken. Sie bringen veränderte Proteine hervor, die von den Immunzellen erkannt werden können. Bei ihrer Suche hatten Forscher Erfolg: Sie entdeckten eine Mutation, die ihnen die Entwicklung eines Impfstoffs ermöglichte. Ihr liegt ein „Schreibfehler“ im Erbgut zugrunde: In einem Enzym namens Isocitrat-Dehydrogenase 1 (IDH1) ist an einer bestimmten Position eine Aminosäure vertauscht. Dort bauen die Krebszellen anstelle der im Original-Bauplan vorgesehenen Aminosäure Arginin zumeist ein Histidin ein. Diese Veränderung zeigt sich bei über 70 Prozent der Gliome. Eine so häufige und hochspezifische Mutation ließ die Immunologen aufhorchen. „Der Aminosäure-Austausch verleiht dem Protein in den Krebszellen neuartige immunologische Eigenschaften, die von den Abwehrzellen erkannt werden können“, urteilt Prof. Michael Platten. „Bei keiner anderen Tumorart tritt mit einer solchen Häufigkeit dieselbe Mutation auf.“ Mit einem Antikörper, den Plattens Kollege Andreas von Deimling entwickelte, lässt sich das veränderte Protein nachweisen. Wie sich zeigte, ist es auf allen Zellen eines Glioms vorhanden, bei dem die Mutation entstand. „Das bedeutet, dass wir mit einer Impfung, die das Immunsystem des Patienten gegen die veränderte IDH1 scharf macht, den Tumor bekämpfen könnten, ohne gesunden Zellen zu schaden“, resümiert Platten. Als Impfstoff baute eine Forschergruppe aus dem DKFZ und mehreren Universitäten den IDH1-Abschnitt mit den vertauschten Aminosäuren nach, und zwar in Form eines Peptids. So werden kleine Moleküle genannt, die aus Aminosäuren aufgebaut sind. Seine Struktur gestalteten sie so, dass es exakt in eines jener Moleküle auf der Oberfläche der Tumorzellen passt, die die Zielstrukturen für die Immunzellen tragen. Ohne einen solchen „Präsentierteller“ beginnt keine Abwehrreaktion. Um herauszufinden, ob der Impfstoff auch beim Menschen wirkt, griffen die Forscher zu einem Trick: Sie statteten Mäuse mit Präsentationsmolekülen aus, die vom Menschen stammten. Dann impften sie die Tiere mit dem Peptid, das sie diesen einfach unter die Haut spritzten. In der Folge ließen sich Immunzellen und Antikörper nachweisen, die das veränderte IDH1 der Tumorzellen erkannten, nicht aber das normale Enzym gesunder Körperzellen Diese Immunreaktion stoppte das Wachstum von Krebszellen mit der IDH1-Mutation in den Versuchstieren. Die Funktion des normalen Enzyms dagegen, das in gesunden Körperzellen eine Rolle im Energiestoffwechsel spielt, wurde durch die Impfung nicht beeinträchtigt. „Das ist ein gutes Zeichen dafür, dass eine Impfung mit dem Peptid das körpereigene Immunsystem im Kampf gegen die Krebszellen unterstützen kann“, meint Platten. Wenn es gegen den Krebs geht, möchte Helmut Salih, Leitender Oberarzt am Universitätsklinikum Tübingen, schneller schießen. „Die Medikamente müssten wirken wie Zauberkugeln“, zitierte Salih Paul Ehrlich, einen der frühen „Medizinpäpste“ in Deutschland, der unter anderem eine medikamentöse Behandlung der Syphilis entwickelte. Diese Kugeln treffen immer, wogegen heutige Krebstherapien eher Schrotschüssen gleichen, die neben dem Ziel auch viele andere Strukturen zerstören. Salihs Zauberkugeln sind Antikörper, die er mit Kollegen zur Behandlung von Leukämien entwickelt.[19]
Das Kombinieren von Acetylsalicylsäure in Immuntherapien ebenfalls bei Mäusen wirken äußerst erfolgreich behaupten britische Forscher.[20]
Gentherapie
Gentherapie im engeren Sinne bedeutet die künstliche Veränderung des Gensatzes erkrankter Körperzellen, zu denen auch Tumorzellen gerechnet werden. Besonders modifizierte Viruspartikel oder auch physikalisch definierte Partikel (Liposomen, Goldpartikel), auch Vektoren genannt, dienen als Gen-Übertragungswerkzeuge. Die bislang am häufigsten benutzten Gentherapie-Vektoren wurden von Retroviren abgeleitet. Auf der Grundlage anderer Virustypen, z. B. Adenovirus, werden zurzeit weitere Gentherapie-Vektoren der neuen Generation konstruiert, welche größere Mengen genetischer Information auch in nicht-teilende Zellen (z. B. ruhende Tumorzellen) einschleusen können und im Körper des Patienten wesentlich stabiler und zugleich nebenwirkungsärmer sind. Da besonders hochgradige Gliome schnell wachsen und das umgebende normale Hirngewebe rasch infiltrieren, scheint allerdings eine lokale intratumorale Gentherapie mittels Vektor-Einzelinjektionen als alleinige Behandlungsoption nicht sehr geeignet zu sein. Demgegenüber ist diese Art der Gentherapie als Zusatzoption zur neurochirurgisch-radiotherapeutischen Standardbehandlung sinnvoll und könnte möglicherweise auch die Wirksamkeit einer Chemotherapie verbessern.
Immunotoxintherapie
Es handelt sich hier um eine neue Methode zur selektiven Abtötung von Hirntumorzellen auf der Basis von Unterschieden im Aufbau ihrer Zellmembran im Vergleich zu normalen Hirnzellen. Ein Immunotoxin wird hergestellt durch die künstliche Verbindung einer toxischen Substanz bakteriellen oder pflanzlichen Ursprungs mit einem für den Tumor spezifisches Eiweiß (Protein). Die inaktive Form eines Immunotoxins wird nach erfolgter Bindung in die Tumorzelle aufgenommen und dort durch weitere Stoffwechselprozesse aktiviert, wodurch die betroffenen Zellen schnell abgetötet werden. Die Immunotoxintherapie wird bei Patienten mit malignen Gliomen mittels im Tumor stereotaktisch implantierter Katheter über mehrere Tage durchgeführt. Durch die längere Wirkung des Immunotoxins sollte es möglich sein, nicht nur die Haupttumormasse, sondern auch restliche Gliomzellen in einiger Entfernung vom sichtbaren Tumorrand abzutöten und eine lang anhaltende Tumorkontrolle zu erreichen.
Radioimmuntherapie
Diese Methode beruht auf der Tatsache, dass maligne Hirntumorzellen auf ihrer Oberfläche häufig das Protein Tenascin exprimieren. Gegen Tenascin konnte ein Antikörper hergestellt werden, an welchen ein radioaktives Element (131-Iod oder 188-Rhenium) gekoppelt wird. Verabreicht man diesen „strahlenden“ Antikörper in die durch die chirurgische Tumorentfernung entstandene Höhle, so wandert er in das umliegende Gewebe und bindet an verbliebene Hirntumorzellen. Die radioaktiven Isotope besitzen eine Strahlungsenergie, die ausreicht, um auf kurze Entfernungen Zellen zu zerstören. Durch den Antikörper wird die Radioaktivität gezielt an die Tumorzelle herangebracht und kann diese unter Schonung des gesunden Hirngewebes abtöten. Voraussetzung für die Behandlung ist das Vorhandensein eines sogenannten Reservoirs (Ommaya-Reservoir), welches unter der Kopfhaut liegt und mit einem dünnen Katheter verbunden ist, dessen Spitze in die Operationshöhle hineinreicht. Der radioaktiv markierte Antikörper kann über das Reservoir in die Operationshöhle gespritzt werden. Je nach Ansprechen auf die Radioimmuntherapie kann diese bis zu dreimal wiederholt werden. Da der Antikörper in geringem Maß auch über die Blutbahn aufgenommen wird, kann es zumindest theoretisch zu einer Beeinträchtigung der Knochenmarksfunktion und damit der Blutbildung kommen.
Onkolytische Viren
Die Behandlung eines Glioblastoms mit onkolytischen Viren könnte durch die Blockade bestimmter Immunzellen verbessert werden.
Hemmung der Tumorblutgefäßbildung (Neoangiogenese-Hemmung)
Die Hemmung der Ausbildung neuer Blutgefäße im Tumor (Neoangiogenese) hat bereits Einzug in die Therapie bösartiger Hirntumoren gehalten: Der stark gesteigerte Stoffwechsel und Sauerstoffbedarf in einem rasch wachsenden Tumor können nur gedeckt werden, wenn der Tumor selbst Blutgefäße dazu anregt, zu wachsen und neue Verästelungen auszubilden. Dazu sendet er Botenstoffe in das umgebende Gewebe, die an spezielle Antennenmoleküle (Rezeptoren) auf Blutgefäßzellen andocken und diese dadurch zum Wachstum veranlassen. Sowohl die Botenstoffe selbst als auch deren Rezeptoren können therapeutisch gehemmt werden. Mehrere klinische Studien, die dieses Therapiekonzept bei bösartigen Gliomen überprüft haben, verliefen allerdings negativ.
Die Ergebnisse großer Studien, die die Wirksamkeit des monoklonalen Antikörpers Bevacizumab gegen den Gefäßbotenstoff VEGF bei Glioblastomen untersuchen, werden derzeit unterschiedlich beurteilt. Eine Zulassung für Bevacizumab bei Hirntumoren in Deutschland steht noch aus. Dennoch wird die Substanz auf der Basis einer jeweils individuell zu beantragenden Kostenübernahme durch die Versicherer in Deutschland bei Glioblastomen häufig eingesetzt.[21]
Beeinflussung von Zellsignalwegen
Tumorzellen zeichnen sich aus durch eine Störung von biologischen Signalwegen innerhalb der Zelle und in der Kommunikation mit anderen Zellen. Dies betrifft Programme zur Steuerung von Zellteilung, zur Zellspezialisierung (Differenzierung) und zur Einleitung eines geplanten (programmierten) Zelltodes (Apoptose). Einige Substanzen, die nach wissenschaftlichen Erkenntnissen geeignet sind, in diese Signalwege korrigierend einzugreifen, befinden sich in der klinischen Erprobung. Dazu zählen unter anderen 13-cis-Retinolsäure, Hemmer der Bildung des Tumornekrosefaktors beta und Signalmoleküle zur Auslösung des programmierten Zelltodes.
CUSP9
CUSP9 ein Medikamentencocktail – Wissenschaftler, darunter der Ulmer Neurochirurg Professor Marc-Eric Halatsch, haben einen „Medikamentencocktail“ entwickelt, mit dem sich die Überlebenszeit von Patienten mit einem Rezidiv womöglich verbessern lässt. Fast alle Bestandteile des so genannten CUSP9-Protokolls sind bereits zur Therapie anderer Krankheiten zugelassen.[22]
Intraoperative Optical Imaging (IOI)
Eine neue Untersuchungstechnik, die Hirnaktivität mittels Lichtstrahlen in Bilder umwandelt, könnte Tumoroperationen am Gehirn künftig noch sicherer machen. Ziel einer Krebsoperation am Gehirn ist es, den Tumor vollständig zu beseitigen – idealerweise wird auch noch ein kleiner Teil des benachbarten gesunden Gewebes mit entfernt, um Zellnester zu erfassen, die sich dort eingenistet haben. Andererseits wollen die Operateure gesundes Gewebe schonen, wenn es für wichtige Funktionen wie Gefühl, Sprache, Bewegung oder Sehen zuständig ist.
Hirntumorgewebe ist inzwischen gut identifizierbar, zum Beispiel mit Farbstoffen, Magnetresonanztomographie, Computertomographie oder Ultraschall. „Bis heute können wir aber gesundem Gewebe leider nicht ansehen, für welche Funktionen es zuständig ist“, erklärte Gabriele Schackert, Direktorin der Klinik und Poliklinik für Neurochirurgie am Universitätsklinikum Dresden. Dies wäre aber wichtig, um noch gezielter operieren zu können.[23][24][25]
Hirnaktivität geht üblicherweise mit einer Mehrdurchblutung einher. Das verändert wiederum die Lichtabsorption, wenn die Hirnoberfläche mit einer Lampe bestrahlt wird – vermehrte Hirnaktivität steigert die Absorption. Dieses Phänomen nutzt das IOI. „In unserer Studie gaben wir leichte Stromimpulse an den Medianus-Nerven ab, der an der Innenseite des Unterarms verläuft und das Gefühl in der Hand vermittelt“, so Schackert. Reflexartig leitete der Nervus medianus die Impulse an seine übergeordnete Zentrale im Hirn weiter, die für das Gefühl zuständig ist. Sie war nun ebenfalls aktiviert und damit stärker durchblutet. Eine Kamera, die im Operationsmikroskop integriert ist, filmt bei der IOI die lichtbestrahlte Hirnoberfläche während dieses Vorgangs.
Vor der Kamera sitzt ein Filter, der bevorzugt Wellenlängen passieren lässt, in denen das Blut eine starke Absorption zeigt. Ein Computer setzt die Informationen in Bilder um. Innerhalb von zehn bis 15 Minuten entsteht so eine zweidimensionale Karte, in der die aktivierte Hirnregion zu erkennen ist. „Die Bilder sind genau und zuverlässig“.
Zuvor war es den Dresdner Forschern gelungen, durch eine Reizung des Sehnervs – sie leuchteten dem Patienten ins Auge – das Sehzentrum zu lokalisieren. „Damit können wir erstmals wichtige Hirnfunktionen annähernd in Echtzeit erkennen“, so Schackert. Sollte das IOI sich im klinischen Alltag bewähren, wäre dies ein wichtiger Fortschritt für die Sicherheit der Patienten.
Roboter-Tentakel
Bei Hirnoperationen mit dem Schlangenroboter muss dem Patienten kein Loch mehr in den Kopf gebohrt werden. Deshalb ist der Eingriff viel schonender und die Heilung kürzer. Auch bei OPs im Bauchraum sollen bald flexible Roboterarme minimalinvasive und den Patienten weniger belastende Operationen ermöglichen.
Der schlangenförmige Roboter ist aus mehreren dünnen Schläuchen aufgebaut, die ineinandergesteckt sind, ähnlich einer Autoantenne. Er besteht aus einer Nickel-Titan-Legierung, die superelastisch ist. So lässt sich der Roboter dehnen und verformen, kann dennoch jederzeit wieder in seine Ursprungsform zurückkehren. Vor ihrem Einsatz werden die einzelnen Schläuche gebogen. Ein spezielles Computerprogramm berechnet für jeden Patienten individuell, welche Krümmungen zur Anatomie des geplanten Einsatzortes passen.[26][27]
Entfernung durch neuen Laser, „SRS-Mikroskopie“
Ein Laser wird auf das Gewebe abgefeuert. Die Eigenschaften des Lichtstrahls verändern sich durch das Gewebe, auf das er trifft. Die unterschiedliche chemische Zusammensetzung von Krebszellen und normalem Gewebe bedeutet, das damit auch die genauen Umrisse eines Tumors erkennbar werden. Klinische Tests mit Patienten sind bereits sehr erfolgreich durchgeführt worden.[28]
Forscher der University of Michigan Medical School und der Harvard University haben ermittelt, dass vor allem das deutliche Sichtbarmachen aller Umrisse von Tumoren entscheidend ist. Seit jeher sind Chirurgen bei Operationen an Gehirntumoren besonders vorsichtig, da das Entfernen des umgebenden Gewebes zu Beeinträchtigungen führen könnte. Das in Science Translational Medicine vorgestellte Verfahren setzt einen Laser ein, um die Chemie des Gewebes zu analysieren und den Tumor in einer anderen Farbe sichtbar zu machen. Das Entfernen eines Gehirntumors gilt als Balanceakt. Wird zu wenig entfernt, kann der Krebs erneut auftreten. Wird zu viel beseitigt, kann das die Lebensqualität der Patienten deutlich beeinträchtigen. Entscheidend ist also, die Begrenzungen des Tumors zu wissen. Chirurgen entfernen Abschnitte des Tumors und des umgebenden Gewebes und untersuchen sie unter dem Mikroskop, um die Umrisse zu kennen.[29]
Zur Analyse der Lichtreflexion wird die sogenannte Raman-Spektroskopie angewandt, mit der Materialeigenschaften etwa auch von Kunstwerken untersucht werden.[30]
Onkoknife, iKnife, oder intelligent scalpel
Tumoren werden mithilfe von elektrischen Messern entfernt – sie lassen das Gewebe verdampfen, wobei Rauch entsteht. Das neue Skalpell, welches iKnife getauft wurde, kann anhand einer Analyse des Rauchs die Zusammensetzung erkennen – so können Krebszellen ermittelt werden. Durch die neue Technik kann wesentlich mehr gesundes Gewebe erhalten bleiben.[31][32][33]
Prof. Zoltan Takats erwartet den Start des iKnifes offiziell im Jahr 2016.[34]
Intraoperative PET-CT oder PET-MR intraoperativ
Es ist absehbar, dass neue Zukunftstechnologien im OP wie PET-CT oder PET-MR auf einer intraoperativen Plattform aus Bildgebung und Navigation aufgesetzt wird.[27]
Bor-Neutroneneinfangtherapie
Das Ziel ist es, Bor-Verbindungen zu finden, die untoxisch sind und sich in Tumorgewebe anreichern, um dieses dann selektiv durch Neutronenbestrahlung zerstören zu können. Die Idee zur BNCT wurde bereits 1936 von Gordon L. Locher entwickelt und befindet sich zurzeit noch in der Entwicklung. Vielversprechende Ergebnisse bei der Behandlung von bestimmten Hirntumoren konnten erzielt werden.
Supportivtherapie
Diese Art der Therapie richtet sich nicht direkt gegen das Tumorwachstum, sondern behandelt Beschwerden und Symptome die entweder durch das Tumorleiden oder durch die Behandlung entstehen.
Typische Indikationen für eine supportive Therapie sind tumorspezifische Symptome (Hirndruck, Kopfschmerz, Anfälle), im Zusammenhang mit der Tumorbehandlung stehende Komplikationen (Erbrechen, Schmerzen, Infekte, Thrombosen, Blutbildveränderungen) oder psychische Probleme.
In weit fortgeschrittenem Erkrankungsstadium decken sich definitionsgemäß supportive und palliative Therapiemaßnahmen. Die Erhaltung von Lebensqualität sollte jedoch bei Erkrankungen mit raschem Verlauf immer im Vordergrund der therapeutischen Überlegungen stehen.
Zu den supportiven Maßnahmen bei Hirntumorpatienten gehören vor allem:
- Therapie epileptischer Anfälle
- psychoonkologische Unterstützung
- Therapie des chronischen Hirnödems
- Vermeiden von Übelkeit und Erbrechen
- Thromboseprophylaxe
- Schmerzbehandlung
- Therapie des Psychosyndroms
- Hilfsmittel bei Bettlägerigkeit
Alternativmedizin und Komplementärmedizin
Patienten setzen Hoffnung in Naturheilmittel, pflanzliche Medikamente, Homöopathie und andere sanfte Methoden. Dies ist auf den Wunsch zurückzuführen, selbst etwas gegen die Erkrankung zu unternehmen und nichts unversucht zu lassen, auch als Ausdruck des „Nicht-wahrhaben-Wollens“. In Deutschland stieg die Bekanntheit von traditionellen Heilweisen aus Asien und Amerika in den letzten Jahren enorm. Stellvertretend stehen hier Ayurveda, chinesische Medizin und schamanische Mittel. Viele dieser Methoden werden begleitend oder ergänzend zur Standardtherapie angewendet, jedoch fehlt in vielen Fällen der wissenschaftliche Nachweis der Wirksamkeit und Unbedenklichkeit, insbesondere für eine Anwendung bei Hirntumoren.
WHO-Klassifikation
Eine Möglichkeit der Systematisierung von Hirntumoren ist die Differenzierung hinsichtlich des zellulären Ursprungs, der Zellzusammensetzung und des Wachstumsverhaltens. Diese Aspekte liegen der WHO-Klassifikation der Weltgesundheitsorganisation zugrunde, deren aktuelle Version aus dem Jahre 2007 stammt. Sie unterscheidet vier grundlegende Tumorgrade:
- WHO Grad I: gutartige (benigne) Tumoren, z. B. pilozytisches Astrozytom; Eigenschaften: hochdifferenziert, extrem langsames Wachstum, gute Prognose
- WHO Grad II: halbgutartig (semibenigne) Tumoren, z. B. Astrozytom, Oligodendrogliom; Eigenschaften: hochdifferenziert, langsames Wachstum, gute Prognose
- WHO Grad III: halbbösartig (semimaligne) Tumoren, z. B. anaplastisches Astrozytom; Eigenschaften: wenig differenziert, schnelles Wachstum, ungünstige Prognose
- WHO Grad IV: bösartige (maligne) Tumoren, z. B. Glioblastoma multiforme; Eigenschaften: undifferenziert, sehr schnelles Wachstum, sehr ungünstige Prognose
Hirntumorarten
Nach der WHO-Klassifikation der Tumoren des zentralen Nervensystems werden folgende Entitäten unterschieden nach folgenden Graduierungen:
Neuroepitheliale Tumoren
- Astrozytäre Tumoren
- Pilozytisches Astrozytom, (WHO Grad I)
- Subependymales Riesenzellastrozytom, (WHO Grad I)
- Pilomyxoides Astrozytom, (WHO Grad II)
- Astrozytom (Varianten: fibrillär, protoplasmatisch, gemistozytisch), (WHO Grad II)
- Pleomorphes Xanthoastrozytom, (WHO Grad II)
- Anaplastisches Astrozytom (WHO Grad III)
- Glioblastom (Varianten: Gliosarkom, Riesenzellglioblastom), (WHO Grad IV)
- Oligodendrogliale Tumoren
- Oligodendrogliom, (WHO Grad II)
- Anaplastisches Oligodendrogliom, (WHO Grad III)
- Mischgliome
- Oligoastrozytom, (WHO Grad II)
- Anaplastisches Oligoastrozytom, (WHO Grad III)
- Ependymale Tumoren
- Myxopapilläres Ependymom
- Ependymom (Varianten: zellulär, papillär, tanyzytisch, klarzellig)
- Anaplastisches Ependymom
- Subependymom
- Plexus-Choroideus-Tumoren
- Gliome ungeklärter Abstammung
- Astroblastom
- Gliomatosis cerebri
- Chordoides Gliom des dritten Ventrikels
- Neuronale und gemischt neuronal–gliöse Tumoren
- Gangliozytom
- Dysplastisches Gangliozytom des Kleinhirns (Lhermitte-Duclos-Syndrom)
- Desmoplastisches infantiles Gangliogliom
- Dysembryoplastischer neuroepithelialer Tumor
- Gangliogliom
- Anaplastisches Gangliogliom
- Zentrales Neurozytom
- Extraventrikuläres Neurozytom
- Zerebelläres Liponeurozytom
- Paragangliom
- Angiozentrisches Gliom
- Papillärer glioneuronaler Tumor
- Rosettenformender glioneuronaler Tumor des vierten Ventrikels
- Neuroblast Tumoren
- Pinealisparenchymtumoren (Pinealome)
- Pineozytom
- Pineoblastom
- Pinealisparenchymtumor intermediärer Differenzierung
- Papillärer Tumor der Pinealisregion
- Embryonale Tumoren
- Medulloepitheliom
- Ependymoblastom
- Medulloblastom (Varianten: desmoplastisch, großzellig, melanotisch, Medullomyoblastom)
- Supratentorieller primitiver neuroektodermaler Tumor (PNET), (Varianten: Neuroblastom, Ganglioneuroblastom)
- Atypischer teratoider/rhabdoider Tumor (AT/RT)
Meningeale Tumoren
- Meningeotheliale Tumoren
- Meningeom (Varianten: meningeothelial, fibroblastisch, transitionell, psammomatös, agniomatös, mikozystisch, sekretorisch)
- Atypisches Meningeom (Varianten: klarzellig, chordoid), (WHO Grad II)
- Anaplastisches Meningeom (Varianten: papillär, rhabdoid), (WHO Grad III)
- Mesenchymale, nicht-meningotheliale Tumoren
- Hämangiom
- Epitheloides Hämangioendotehliom
- Hämangioperizytom
- Angiosarkom
- Lipom
- Angiolipom
- Liposarkom
- Malignes fibröses Histizytom
- Leiomyom
- Leiomyosarkom
- Rhabdomyosarkom
- Cholesteatom
- Chondrom
- Chondrosarkom
- Chordom
- Osteom
- Osteosarkom
- Osteochondrom
- Kaposi-Sarkom
- Primäre melanozytäre Tumoren
- Melanozytose
- Melanozytom
- Malignes Melanom
- Meningeale Melanomatose
- Tumoren unsicherer Histogenese
- Hämangioblastom (Von-Hippel-Lindau-Erkrankung)
Lymphome und hämatopoetische Tumoren
- Malignes Lymphom
- Plasmozytom
- Granulozytäres Sarkom
Keimzelltumoren
- Germinom
- Embryonales Karzinom
- Dottersack-Tumor
- Chorionkarzinom
- Teratom (Varianten: reifes, unreifes, mit maligner Transformation)
- Gemischte Keimzelltumoren
Tumoren der Sellaregion
- Kraniopharyngeom (Varianten: adamantinös, papillär)
- Granularzelltumor
- Pituizytom
- Spindelzellonkozytom der Adenohypophyse
Metastasen
Prognose
Für keinen Hirntumor lässt sich eine genaue prognostische Aussage hinsichtlich seines Verlaufs treffen. So können selbst gutartige Tumoren eine schlechte Prognose haben, nämlich dann, wenn sie an ungünstiger Stelle lebenswichtige Hirnfunktionen beeinträchtigen und nicht operabel sind. Umgekehrt kann ein kleiner, bösartiger Tumor, der gut zu operieren ist und im Ganzen entfernt werden kann, eine bessere Prognose haben.
Da viele Hirntumoren jedoch schnell wachsen können, das Gehirn als empfindliche Schaltzentrale viele lebenswichtige Funktionen übernimmt und viele Tumoren trotz der heutigen Technik nicht oder nur teilweise entfernt werden können, gibt es viele Krankheitsverläufe, bei denen schon nach wenigen Monaten der Tod eintritt. Die Prognose des einzelnen ist jedoch von so vielen Faktoren abhängig, dass auch Durchschnittswerte immer mit Vorsicht behandelt werden sollten.
Literatur
- Cavenee, Louis, Ohgaki, Wiestler (Hrsg.): WHO Classification of Tumours of the Central Nervous System. IARC Press, Lyon 2007, ISBN 92-832-2430-2.
- Immo von Hattingberg: Gehirntumoren (brain tumor, tumeur cérébral). In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1352–1355.
Weblinks
- Allgemeine Informationen zu Diagnostik und Therapie von Hirntumoren von der Deutschen Hirntumorhilfe
- Leitlinien zu Diagnostik und Therapie von Hirntumoren bei der Neuro-onkologischen Arbeitsgemeinschaft (NOA)
- Leitlinie Leitsymptome und Diagnostik der Hirntumoren im Kindes- und Jugendalter, AWMF-Registernummer 025/022 (online: Volltext), Stand 9/2010
- Therapie. Gliom
Einzelnachweise
- Raumforderung
- Frank Schneider, Gereon R. Fink (Hrsg.): Funktionelle MRT in Psychiatrie und Neurologie. Springer, Berlin 2007, ISBN 3-540-20474-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Klinikum rechts der Isar Technische Universität München, Neuro-Kopf-Zentrum, Abteilung für Diagnostische und Interventionelle Neuroradiologie
- Robert H. Eibl, Markus Schneemann: Liquid Biopsy and Primary Brain Tumors. In: Cancers. 13, 29. Oktober 2021, S. 5429. doi:10.3390/cancers13215429. PMID 34771592. PMC 8582521 (freier Volltext).
- Virtual Reality OP-Planung. In: kockro.com. Archiviert vom Original am 3. Juli 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Neurosurgical Planning and Neuro-Navigation – Neurosurgery. In: unimedizin-mainz.de. Archiviert vom Original am 18. November 2016. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Abgerufen am 3. Juli 2015.
- IMRIS Neurosurgery intraoperative imaging for neurosurgery. In: imris.com. Archiviert vom Original am 18. August 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Robot-Assisted Surgery: Neurosurgery. In: brown.edu. Archiviert vom Original am 5. Juni 2013. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Hirntumorchirurgie. In: uniklinikum-dresden.de.
- Brain mapping. In: uniklinikum-dresden.de.
- Ulrich Marsch: Hirntumore: Millimeter um Millimeter zu einer besseren Prognose. Technische Universität München, Pressemitteilung vom 21. Mai 2015 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- Universitätsklinikum Würzburg – Strahlentherapie: Intensitätsmodulierte Strahlentherapie – IMRT. In: ukw.de. Archiviert vom Original am 22. September 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Fibertracking. In: insel.ch.
- Deutsche Hirntumorhilfe e.V.: Elektrische Wechselfelder. Deutsche Hirntumorhilfe, abgerufen am 21. Juli 2021.
- Charité etabliert NanoTherm® Therapie bei Rückfällen von Gehirntumoren. Charité – Universitätsmedizin Berlin. 2011. Archiviert vom Original am 23. September 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Abgerufen am 19. August 2015.
- Charité und Vivantes: Konkurrenten werden zu Partnern. In: Ärzte Zeitung.
- MagForce AG – NanoTherm® Therapie. In: magforce.de.
- Eintrag zu Boosterung im Flexikon, einem Wiki der Firma DocCheck, abgerufen am 25. November 2015.
- Immuntherapie – Hoffnung für Unheilbare: Mäuse mit menschlichen Präsentationsmolekülen. In: FOCUS Online. 27. Januar 2015.
- Aspirin could help boost cancer treatment, experts find. In: Telegraph.co.uk. 3. September 2015.
- Die blauen Ratgeber: Gehirn Tumoren (Memento vom 9. Dezember 2014 im Internet Archive)
- Glioblastom: neuer Therapieansatz. In: uni-ulm.de. Archiviert vom Original am 3. Februar 2016. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Neurochirurgen machen Seh- und Gefühlszentren während Hirn-OP sichtbar. In: Deutsches Ärzteblatt.
- Bildgebende Verfahren – Alles so schön bunt hier …. In: SWR odysso.
- Seh- und Gefühlszentren werden durch Licht sichtbar - Biermann Medizin Newsportal. In: biermann-medizin.de. (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Carola Mensch: Medizintechnik: Schlangenroboter sollen Gehirntumore entfernen. In: Welt Online. 19. Mai 2015.
- Intraoperative Bildgebung. In: insel.ch.
- Laser detects brain tumour during surgery. In: Telegraph.co.uk. 26. August 2015.
- selbstbestimmung.ch - Wissenschaft & Technik - Hirntumor: Komplett-Entfernung durch neuen Laser. In: selbstbestimmung.ch.
- Tumorforschung: Chirurgen finden mit Laser krebskrankes Hirngewebe. In: FOCUS Online. 28. August 2015.
- Intelligentes Skalpell: iKnife erkennt Krebsgewebe - N24.de. In: N24.de. 19. Juli 2013.
- Krebs-Operation: Intelligentes Messer iKnife erkennt krankes Gewebe. In: Spiegel Online. 18. Juli 2013.
- Laser detects brain tumour cells during surgery. In: BBC News.
- Nick Heath: The intelligent knife that helps surgeons sniff out cancer. In: TechRepublic. 26. November 2014.