Funktionelle Magnetresonanztomographie
Die funktionelle Magnetresonanztomographie, abgekürzt fMRT oder fMRI (für englisch functional magnetic resonance imaging), ist ein bildgebendes Verfahren, um physiologische Funktionen im Inneren des Körpers mit den Methoden der Magnetresonanztomographie (MRT) darzustellen. fMRT im engeren Sinn bezeichnet Verfahren, welche aktivierte Hirnareale (meist basierend auf der Blutoxygenierung) mit hoher räumlicher Auflösung darstellen können;[1] im weiteren Sinn werden auch andere funktionell bildgebende Techniken wie etwa die dynamische Herz-MRT, die zeitaufgelöste MRT-Untersuchung von Gelenkbewegungen oder die Perfusions-MRT als funktionelle MRT bezeichnet.[2][3] Bisweilen wird das Verfahren bzw. sein Ergebnis auch als Gehirnscan bezeichnet.[4][5]
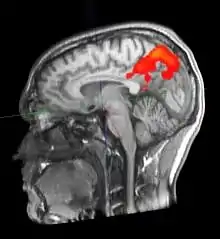
Einführung
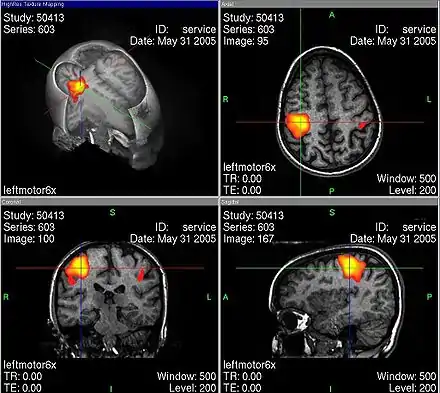
Durch fMRT-Aufnahmen ist es möglich, Durchblutungsänderungen von Hirnarealen sichtbar zu machen, die auf Stoffwechselvorgänge zurückgeführt werden, welche wiederum mit neuronaler Aktivität in Zusammenhang stehen. Hierbei macht man sich die unterschiedlichen magnetischen Eigenschaften von oxygeniertem und desoxygeniertem Blut zunutze (BOLD-Kontrast). Bei der Aktivierung von Kortexarealen kommt es zu einer Steigerung des Stoffwechsels, wodurch das aktivierte Areal mit einer überproportionalen Erhöhung des Blutflusses reagiert (sog. neurovaskuläre Kopplung). Dadurch erhöht sich die Konzentration von oxygeniertem (diamagnetischem) relativ zu desoxygeniertem (paramagnetischem) Hämoglobin. Über den intermolekularen Elektronendipol-Kerndipol-Relaxationsmechanismus bewirkt diese Konzentrationsänderung eine Veränderung der effektiven transversalen Relaxationszeit der beobachteten Wasserstoff-Kernspins und führt damit zu einer Signaländerung in der MRT. Um so Rückschlüsse auf den Ort einer neuronalen Aktivität zu ziehen, wird das Magnetresonanz-Signal des Gewebes zu zwei Zeitpunkten verglichen – z. B. im stimulierten oder Experimentalzustand einerseits sowie im Ruhe- oder Kontrollzustand andererseits. Die Aufnahmen können durch statistische Testverfahren miteinander verglichen und die statistisch signifikanten Unterschiede (die den stimulierten Arealen entsprechen) räumlich zugeordnet und dargestellt werden.

Eine fMRT-Untersuchung läuft in der Regel in drei Phasen ab:
- Prescan: ein kurzer, gering auflösender Scan. Hiermit kann die korrekte Lagerung des Patienten geprüft werden.
- Anatomischer MRT-Scan: ein räumlich hoch auflösender Scan, um die Anatomie des zu untersuchenden Bereichs via Bildfusion detailgetreu darstellen zu können.
- Der eigentliche fMRT-Scan: ein schneller Scan, der durch Anwendung des BOLD-Kontrasts Durchblutungsunterschiede im untersuchten Gewebe darstellt.
Bei einer Untersuchung des Gehirns zu Versuchszwecken kann dem Probanden im dritten Teilscan zum Beispiel ein wiederholter Reiz präsentiert werden. Häufig wird der Reiz mit einer Aufgabe für den Probanden verknüpft, etwa der Aufforderung, bei jedem gezeigten Objekt X eine Taste zu drücken. Den meisten Versuchen gemein ist die häufige Wiederholung der Aufgabe. So kann dann durch statistische Verfahren ein Vergleich aufgezeichneter Daten aus der Reizphase mit denen aus der Ruhephase stattfinden. Der hieraus berechnete Unterschied wird dann in Falschfarben auf den zuvor durchgeführten anatomischen MR-Scan projiziert.
Vor allem die Neurologie und Neuropsychologie profitieren von den Möglichkeiten der fMRT. So konnten zum Beispiel durch Vergleichsstudien mit fMRT zwischen Menschen, die an psychischen Störungen wie Depressionen, Angst- und Zwangsstörungen leiden, und gesunden Kontrollpersonen deutliche und z. T. chronifizierte Unterschiede im Hirnstoffwechsel nachgewiesen werden.
Geschichtliche Entwicklung
Bereits 1935 hatte Linus Pauling festgestellt, dass sich die magnetischen Eigenschaften von Hämoglobin in Abhängigkeit vom Oxygenierungsgrad verändern.[6] Dieser Effekt bildet die Grundlagen für die Messung von Hirnaktivitäten mit der funktionellen MRT, die in den 1980er und 1990er Jahren entwickelt wurde. Im Jahre 1982 zeigten Keith Thulborn und Mitarbeiter, dass sich Hämoglobin in Blutproben in Abhängigkeit vom Oxygenierungsgrad in seinem MRT-Signal unterschiedlich darstellt.[7] Die gleiche Beobachtung wurde 1990 von Seiji Ogawa und Mitarbeitern in vivo an Sprague-Dawley Ratten gemacht;[8] die Eigenschaft des Hämoglobins, unterschiedliche MRT-Signale zu verursachen, wurde „blood oxygenation level dependent (BOLD)“-Effekt genannt. Erste fMRT-Ergebnisse an Menschen, welche die Hirnaktivität nach visueller Stimulation zeigten, wurden 1991 von John W. Belliveau und Mitarbeitern veröffentlicht.[9]
Grenzen
Im Vergleich zu den anderen etablierten nicht-invasiven neurophysiologischen Untersuchungsmethoden, etwa EEG zeigt die (verhältnismäßig junge) fMRT zwar deutlich mächtigere Möglichkeiten in der räumlich-lokalisierenden Untersuchung, aber eine prinzipbedingt sehr viel niedrigere zeitliche Auflösung. Eine zusätzliche Unsicherheit ergibt sich aus dem indirekten Charakter der Methode – die neuronale Aktivität wird nicht direkt gemessen, sondern aus Änderungen von Blutfluss und -oxygenierung geschlossen.[10] Dabei wird ein grob lineares Verhältnis zwischen Stimuli, die länger als vier Sekunden sind, und BOLD-Effekt angenommen.[11] Ob der BOLD-Effekt bei kürzeren Stimuli zuverlässig neuronale Aktivität wiedergibt, ist strittig und noch Gegenstand aktueller Forschung.
Weitere technische Limitationen der fMRT-Messung sind:
- In intakten Geweben wird der BOLD-Effekt nicht nur durch das Blut in den Gefäßen, sondern auch durch das Zellgewebe um die Gefäße herum verursacht.[12]
- Wird bei der Messung des BOLD-Effekts eine minimale Größe des Mess-Voxels unterschritten, können Gefäße, die einen Querschnitt haben, der größer ist als die festgelegte Voxelgröße, fälschlicherweise als neuronale Aktivität gedeutet werden.[13]
Darüber hinaus gibt es an den grundlegenden Annahmen und möglichen Erkenntnissen aus fMRT-Untersuchungen Kritik, die darauf beruht, dass die Visualisierung der Messdaten der fMRT eine konstruktive Komponente hat, wodurch eher die Modellvorstellungen der Forscher als tatsächliche Vorgänge dargestellt werden könnten. Des Weiteren fehlten bei zahlreichen Untersuchungen statistische Korrekturrechnungen, um Zufallsergebnisse auszuschließen.[14][15]
Laut einer im Jahr 2016 veröffentlichten Studie haben viele Wissenschaftler die notwendigen Voraussetzungen für den Einsatz der auswertenden Statistiksoftware nicht ausreichend kontrolliert. Dies führe zu falsch-positiven Signalen und zeige Aktivität im Gehirn an, wo keine sei. Viele der neueren Studien (mehrere tausend könnten betroffen sein), die sich mit Denkvorgängen und Emotionen befassten und dabei Messdaten mehrerer Probanden zusammenführten, könnten wertlos sein.[16][17]
Funktionelle Magnetresonanztomographie bei Säuglingen und Kindern
Die fMRT stellt kein invasives Verfahren dar und kann deshalb auch bei Säuglingen und Kindern angewendet werden. Die Reliabilität der Messung kann allerdings dadurch eingeschränkt sein, dass kleine Kinder nicht so lang stillhalten und Bewegungsartefakte auftreten können, die das Signal stören. Zu beachten ist weiterhin, dass sich die Proportionen der Hirnregionen im Laufe der Entwicklung noch verändern, sodass es schwer ist, Aktivierungsmuster über Altersgruppen hinweg zu vergleichen war. Beispielsweise hat das Gehirnvolumen mit circa fünf Jahren seinen vollen Umfang erreicht, aber das Verhältnis der grauen und weißen Substanz verändert sich noch bis zum Erwachsenenalter.[18]
Siehe auch
- Neuroethik
- AFNI, FSL – Softwarepakete zur Bearbeitung und Auswertung
Literatur
- Scott A. Huettel, Allen W. Song, Gregory McCarthy: Functional Magnetic Resonance Imaging. 2. Auflage. Palgrave Macmillan, 2008, ISBN 978-0-87893-286-3.
- N. K. Logothetis, J. Pauls, M. Augath, T. Trinath, A. Oeltermann: Neurophysiological investigation of the basis of the fMRI signal. In: Nature. 412, 2001, S. 150–157.
- Robert L. Savoy: Functional MRI, in Encyclopedia of the Brain, Ramachandran (Ed). Academic Press (2002).
- Peter A. Bandettini: fMRI. 2020, ISBN 978-0-262-53803-9.
Einzelnachweise
- Frank Schneider, Gereon R. Fink (Hrsg.): Funktionelle MRT in Psychiatrie und Neurologie. Springer, Berlin 2007, ISBN 3-540-20474-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michael Graf, Christian Grill, Hans-Dieter Wedig (Hrsg.): Beschleunigungsverletzung der Halswirbelsäule: HWS-Schleudertrauma. 1. Auflage. Steinkopff, Berlin 2008, ISBN 978-3-7985-1837-7, S. 160–161 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gabriele Benz-Bohm (Hrsg.): Kinderradiologie. 2. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-107492-2, S. 239 (eingeschränkte Vorschau in der Google-Buchsuche).
- Alexandra Jorzig; Frank Sarangi: Digitalisierung im Gesundheitswesen: Ein kompakter Streifzug durch Recht, Technik und Ethik. Springer Berlin Heidelberg, 22. Mai 2020, ISBN 978-3-662-58306-7, S. 114–.
- Claudia Steinbrink; Thomas Lachmann: Lese-Rechtschreibstörung: Grundlagen, Diagnostik, Intervention. Springer-Verlag, 22. April 2014, ISBN 978-3-642-41842-6, S. 39–.
- L. Pauling: The oxygen equilibrium of hemoglobin and its structural interpretation. In: Proc Natl Acad Sci U S A. Band 21, Nr. 4, 1935, S. 186–191, PMID 16587956.
- K. R. Thulborn, J. C. Waterton, P. M. Matthews, G. K. Radda: Oxygenation dependence of the transverse relaxation time of water protons in whole blood at high field. In: Biochim Biophys Acta. Band 714, Nr. 2, 1982, S. 265–270, doi:10.1016/0304-4165(82)90333-6, PMID 6275909.
- S. Ogawa, T. M. Lee, A. R. Kay, D. W. Tank: Brain magnetic resonance imaging with contrast dependent on blood oxygenation. In: Proc Natl Acad Sci U S A. Band 87, Nr. 24, 1990, S. 9868–9872, PMID 21247060.
- J. W. Belliveau, D. N. Kennedy, R. C. McKinstry, B. R. Buchbinder, R. M. Weisskoff, M. S. Cohen, J. M. Vevea, T. J. Brady, B. R. Rosen: Functional mapping of the human visual cortex by magnetic resonance imaging. In: Science. Band 254, 1991, S. 716–719, doi:10.1126/science.1948051, PMID 1948051.
- Yevgeniy B. Sirotin, Aniruddha Das: Anticipatory haemodynamic signals in sensory cortex not predicted by local neuronal activity. In: Nature. Band 457, S. 475–479, doi:10.1038/nature07664, PMID 19158795.
- A. M. Dale, R. L. Buckner: Selective averaging of rapidly presented individual trials using fMRI. In: Human Brain Mapping. Band 5, Nr. 5, 1997, S. 329–340, doi:10.1002/(SICI)1097-0193(1997)5:5<329::AID-HBM1>3.0.CO;2-5, PMID 20408237.
- S. Ogawa, T. M. Lee, A. S. Nayak, P. Glynn: Oxygenation-sensitive contrast in magnetic resonance image of rodent brain at high magnetic fields. In: Magn Reson Med. Band 14, Nr. 1, 1990, S. 68–78, doi:10.1002/mrm.1910140108, PMID 2161986.
- J. Frahm, K. D. Merboldt, W. Hänicke: Functional MRI of human brain activation at high spatial resolution. In: Magn Reson Med. Band 29, Nr. 1, 1993, S. 139–144, doi:10.1002/mrm.1910290126, PMID 8419736.
- Veronika Hackenbroch: Großhirn-Voodoo. In: Der Spiegel. 18/2011, 2. Mai 2011.
- Craig M. Bennett, Abigail A. Baird, Michael B. Miller, George L. Wolford: Neural Correlates of Interspecies Perspective Taking in the Post-Mortem Atlantic Salmon: An Argument For Proper Multiple Comparisons Correction. In: JSUR. 1(1), 2010, S. 1–5. (PDF; 864 kB) (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Hanno Charisius: Trugbilder im Hirnscan. In: Süddeutsche Zeitung. 6. Juli 2016, S. 16.
- Anders Eklund, Thomas E. Nichols, Hans Knutsson: Cluster failure: Why fMRI inferences for spatial extent have inflated false-positive rates. In: Proceedings of the National Academy of Sciences. Band 113, Nr. 28, 28. Juni 2016, ISSN 0027-8424, S. 7900–7905, doi:10.1073/pnas.1602413113 (pnas.org [abgerufen am 24. April 2019]).
- Jamie Ward: The student's guide to cognitive neuroscience. Fourth edition Auflage. Abingdon, Oxon 2020, ISBN 978-1-351-03518-7.
Weblinks
- Leicht verständliche Einführung in das Thema fMRT
- fmri for newbies Englischsprachige, umfangreiche Seite zur fMRT
- Artikel Functional Magnetic Resonance Imaging auf Scholarpedia (englisch)
- Großhirn-Voodoo Artikel von Veronika Hackenbroch, Der Spiegel 18/2011 vom 2. Mai 2011