Hirudin
Hirudin ist ein Gemisch chemisch sehr ähnlicher Polypeptide aus dem Speichel des medizinischen Blutegels (Hirudo medicinalis) mit blutgerinnungshemmenden (antikoagulatorischen) Eigenschaften. Sie gehören zu der pharmakologischen Gruppe der peptidischen Thrombin-Inhibitoren.[1]
| Hirudin-1 (Hirudo medicinalis) | ||
|---|---|---|
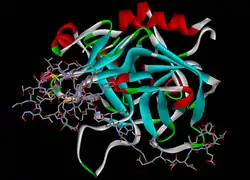 | ||
| Modell von Hirudin (Stäbchen) im Komplex mit Thrombin (Bänder) nach PDB 4HTC | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Masse/Länge Primärstruktur | 65 Aminosäuren | |
| Bezeichner | ||
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | B01AE01, B01AE02 | |
| DrugBank | DB00001 | |
| Wirkstoffklasse | Fibrinolytikum | |
| Inhibitorklassifikation | ||
| MEROPS | I14.001 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Hirudo medicinalis | |
1884 entdeckte der britische Physiologe John Berry Haycraft (1857–1922), dass Blutegel beim Blutsaugen einen Stoff mit stark gerinnungshemmender Wirkung absondern, der die Blutgerinnung an der Bissstelle unterdrückt,[2] und den Jakoby[3] 1904 Hirudin nannte.[4] Die Substanz wurde 1955 durch den Pharmakologen Fritz Markwardt erstmals durch Extraktion aus Blutegelköpfen isoliert.[5]
Chemischer Aufbau
Die Polypeptide des Hirudins sind linear aus 65 bis 66 Aminosäuren aufgebaut, weisen 3 Disulfidbrücken auf und besitzen einen sulfatierten Tyrosinrest in Position 63.[6] Der isoelektrische Punkt liegt bei etwa pH 3,9. Die vollständige Aminosäurensequenz der Hirudin-Variante-1 (HV-1) wurde 1984 beschrieben.[7][8]
Medizinisch verwendete Formen des Hirudins sind natives Hirudin (Gewinnung aus dem Kopf- und Schlundring des Blutegels; auch durch direktes Ansetzen lebender Egel am Patienten, hauptsächlich in der Naturheilkunde) und gentechnisch hergestelltes rekombinantes Hirudin (r-Hirudin). Solche aus gentechnisch veränderten Hefen (Saccharomyces cerevisiae) gewonnene r-Hirudine sind Lepirudin und Desirudin.
| Name | CAS | Anderer Name | Beschreibung |
|---|---|---|---|
| Hirudin | 8001-27-2 | – | native Hirudinpeptide |
| Desirudin (INN) | 120993-53-5 | 63-Desulfohirudin | rekombinante Isoform HV-1 |
| Lepirudin (INN) | 138068-37-8 | 1-Leu-2-Thr-63-Desulfohirudin | rekombinante Isoform HV-1 |
Wirkungsmechanismus und Anwendungsgebiete
Hirudin bindet an die Fibrinogenbindestelle von Thrombin und hemmt über einen Ausläufer das aktive Zentrum, wodurch dessen Wirkung blockiert wird. r-Hirudin wurde zur Gerinnungshemmung nach einer heparininduzierten Thrombozytopenie vom Typ II (HIT II) verwendet. Die äußerliche Verwendung nativen Hirudins in Form von Salben und Gelen zur Verringerung der Blutgerinnung bei oberflächlichen Thrombosen, Thrombophlebitiden und Blutergüssen (Hämatomen) angewendet ist nicht mehr gebräuchlich.
Hirudin überwindet die Plazenta-Schranke und tritt in die Muttermilch über.
Eine Steuerung der Therapie mit Hirudin ist über die Bestimmung der PTT möglich. Da es kein spezifisches Antidot gibt, ist im Falle einer Überdosierung eine Hämofiltration oder Hämodialyse erforderlich.
Bei der ab 1914 mit Georg Haas einsetzenden Entwicklung der Hämodialyse wurde Hirudin eingesetzt, anfangs allerdings in ungereinigter bzw. nicht ausreichend gereinigter und somit toxisch wirkender Form. Erst ab 1923 standen für die „Blutwäsche“ beim Menschen geeignete, untoxische Hirudinpräparate zur Verfügung.[9]
Fertigarzneimittel
- Lepirudin: war in der EU unter dem Namen Refludan als Fertigarzneimittel (Pulver zur Herstellung einer Injektionslösung) erhältlich. Der Wirkstoffhersteller gab die Produktion auf, so dass der Vertrieb von Refludan zum April 2012 eingestellt wurde, nachdem 2009 durch einen EPAR[10] die Risiko-Nutzen-Abschätzung in Frage gestellt wurde.
- Desirudin: Revasc (D, A)
- Bivalirudin: Angiox®
Literatur
- G. Nowak, K. Schrör: Hirudin – the long and stony way from an anticoagulant peptide in the saliva of medicinal leech to a recombinant drug and beyond. A historical piece. In: Thromb. Haemost. Band 98, 2007, S. 116–119. PMID 17598001 doi:10.1160/TH07-05-0364 PDF
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Lepirudin
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Desirudin
Einzelnachweise
- Zu den peptidischen Thrombin-Inhibitoren, so das: Bivalirudin (Angiox®, ausser Handel), Desirudin, Hirudin (aus dem Blutegel), Lepirudin (Refludan®, ausser Handel). Im Vergleich zu den nicht-peptidische Thrombin-Inhibitoren hierzu gehören das: Argatroban (Argatra®), Dabigatran (Pradaxa®, Antidot: Idarucizumab (Praxbind®)), Ximelagatran (Exanta®, ausser Handel, lebertoxisch), Prodrug von Melagatran.
- J. B. Haycraft: Über die Einwirkung eines Sekretes des officinellen Blutegels auf die Gerinnbarkeit des Blutes. In: Arch. Exp. Pathol. Pharmakol. Band 18 1884, S. 209–217.
- C. Jacoby: Über Hirudin. In: Deutsche Medizinische Wochenschrift. 30, 1904, S. 1786–1794.
- W. Forth, D. Henschler: Allgemeine und spezielle Pharmakologie und Toxikologie. 8. Auflage. 2001, S. 568.
- Fritz Markwardt: Untersuchungen über Hirudin. In: Naturwissenschaften. Band 42, 1955, S. 537–538. doi:10.1007/BF00630151
- E. Teuscher: Biogene Arzneimittel. 5. Auflage. Wissenschaftliche Verlagsgesellschaft, 1997, ISBN 3-8047-1482-X, S. 399.
- J. Dodt u. a.: The complete amino acid sequence of hirudin, a thrombin specific inhibitor Application of colour carboxymethylation. In: FEBS Lett. Band 165, 1984, S. 180–184. doi:10.1016/0014-5793(84)80165-9
- UniProt P01050
- Jost Benedum: Die Frühgeschichte der künstlichen Niere. In: AINS. Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, November 2003, S. 681–688, hier: S. 683.
- EPAR