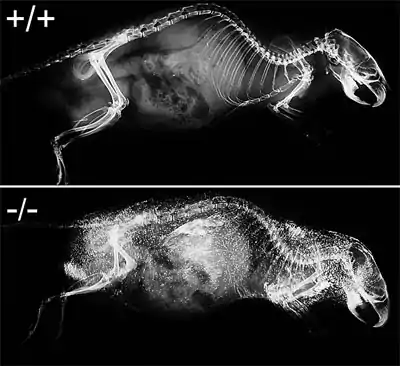
Knockout-Maus
Eine Knockout-Maus (engl. knock out „außer Gefecht setzen“) oder K.O.-Maus ist eine Maus (Mus musculus), bei der mittels einer genetischen Manipulation (Gene-Targeting) gezielt ein oder mehrere Gene deaktiviert wurden (Gen-Knockout). Diese Manipulation geschieht an den embryonalen Stammzellen (von Mäusen), die dann in die Keimbahn einer Maus eingebracht werden. Es gibt inzwischen Knockout-Mäuse für die unterschiedlichsten Forschungsgebiete. Mit Hilfe der genetisch veränderten Tiere können beispielsweise biologische Mechanismen untersucht werden. Außerdem eignen sie sich als Modelle für menschliche Erkrankungen und für pharmakologische Fragestellungen.
Für ihre Arbeiten an Knockout-Mäusen wurde der Nobelpreis für Physiologie oder Medizin 2007 an Martin Evans, Mario Capecchi und Oliver Smithies vergeben.[1]
Methode
Aus Blastozysten eines Inzuchtmäusestamms werden embryonale Stammzellen entnommen und in vitro vermehrt. Nun wird ein Inaktivierungsvektor durch Elektroporation, Mikroinjektion oder ein anderes geeignetes Verfahren in die noch undifferenzierten Stammzellen übertragen. Der Inaktivierungsvektor wird künstlich hergestellt und besteht aus dem zu inaktivierenden Gen, das eine Mutation trägt, so dass es nicht mehr transkribiert werden kann, bzw. das entstehende Protein inaktiv ist. Der Austausch zwischen den DNA-Abschnitten erfolgt durch homologe Rekombination. Bei der homologen Rekombination lagern sich die benachbarten Abschnitte des Gens auf dem Vektor an die gleiche Stelle im Maus-Genom und werden in manchen Fällen rekombiniert.
In der Regel wird der Sequenz noch ein positiver Marker angehängt. Meist wählt man hier ein Neomycinresistenzgen. Dadurch hat man die Möglichkeit, später durch Gabe von Neomycin (ein Antibiotikum) zu sehen, welche Zellen die Sequenz eingebaut haben und welche nicht. Nur Zellen mit der Neomycinresistenz überleben.
Um zu testen, ob der Einbau an der richtigen Stelle im Maus-Genom erfolgt ist, wird als Marker das Gen für die Thymidinkinase (HSV-tk) des Herpes-simplex-Virus (HSV) verwendet. Bei einer anschließenden Behandlung mit Ganciclovir (ein Virostatikum) wird im Fall einer Integration der HSV-tk-Kassette ein Produkt gebildet, welches die Replikation der Zellen hemmt. Zur Integration kommt es durch die ungezielte Rekombination, da die Selektionskassette das Homologiekonstrukt flankiert aber nicht bei der homologen Rekombination. Nach homologer Rekombination überleben die Zellen die Behandlung mit Ganciclovir. Damit ist sichergestellt, dass der Einbau an einer definierten Stelle passiert ist.
Die rekombinierten Stammzellen werden in eine Blastozyste eingesetzt, die wiederum einer vorbehandelten Empfängermaus eingepflanzt wird. In der Leihmutter entwickeln sich dann gemischtzellige Tiere (Chimären). Durch Rückkreuzung gegen den Wildtyp können die heterozygoten Tiere herausgefiltert werden. Durch Kreuzungen erhält man homozygote Tiere, bei denen also das gewünschte Gen in allen Zellen zerstört – ausgeknockt ist.
In der heute gängigen Anwendung wird das Cre/loxP-System genutzt. In einem ersten Schritt werden loxP-DNA-Sequenzen mittels homologer Rekombination eingebracht. In der Regel werden diese, um die Genexpression nicht zu stören, in Introns inseriert, die die zu deletierenden Exons flankieren. Die so veränderten Tiere werden im nächsten Schritt mit einer Maus verpaart, die als Transgen die Cre-Rekombinase exprimiert. So ist es möglich, gewebs- und entwicklungsspezifische Deletionen zu erzeugen. Ein weiterer Vorteil ist die Möglichkeit die Neomycin-Kassette schon in den embryonalen Stammzellen zu deletieren. Die Neomycinkassete interferriert häufig mit der Expression benachbarter Gene.[2]
Die Methode selbst hat sich dahin gewandelt, dass die Manipulation ohne vorherige Selektion rekombinanter Zellen direkt in der befruchteten Eizelle durchgeführt werden kann. Dies wurde durch die Entwicklung molekularer Genscheren, wie Transcription Activator-like Effector Nucleases und Zinkfingernukleasen, insbesondere aber die CRISPR/Cas-Methode möglich. Durch das CRISPR/Cas-System konnte die Herstellungszeit von Knockout-Mäusen erheblich verkürzt werden.[3]
Beispiele
BSE-resistente Mäuse
Um die Theorie des späteren Nobelpreisträgers Stanley Prusiner zu bestätigen, wonach Krankheiten wie Bovine spongiforme Enzephalopathie (BSE), Creutzfeldt-Jakob-Krankheit u. a. durch körpereigene Proteine, den sog. Prionen bzw. deren veränderten Formen, verursacht werden, wurde von Charles Weissmann in Zürich eine Knockout-Maus mit defektem Prion-Gen erzeugt (PrP−/PrP−). Obwohl das Prionprotein im Gehirn normaler Mäuse vorhanden ist, scheinen die Knockout-Mäuse ohne das Prp-Genprodukt voll lebensfähig zu sein. Diese Knockout-Mäuse sind aber gegenüber der Infektion mit sonst tödlichen Prionen resistent, so dass sich daraus die Möglichkeit ergibt, z. B. auch Rinder mit der Resistenz gegen Rinderwahnsinn zu züchten.
Biologische Mechanismen
In der Chronobiologie werden Knockout-Mäuse benutzt, um die molekularen Mechanismen, die hinter der circadianen Rhythmik stehen, zu verstehen. Durch das gezielte Ausschalten bestimmter Gene und somit ihrer Expression lässt sich anhand von tagesrhythmischen Verhaltensänderungen der Mäuse festmachen, welchen Platz diese Gene und die durch sie codierten Proteine bei der circadianen Rhythmik einnehmen.
Medizin
Bei vielen menschlichen Krankheiten ist der Hintergrund eine gestörte Genfunktion. Die Knockout-Mäuse sind hier ein ideales Krankheitsmodell. Durch die Möglichkeit, Knockout-Mäuse schnell zu züchten, ist es möglich, ein Tiermodell zur Verfügung zu haben, um Aussagen über die Rolle bestimmter Gene bei Krankheiten und ihren Behandlungen machen zu können. Problematisch ist dabei allerdings immer die Übertragbarkeit der Ergebnisse.
Kritik
Neben dem unbestreitbaren Nutzen für die Forschung ist das Knock-out-Verfahren auch Gegenstand der Kritik, da es per Definition an Tierversuche gebunden ist. Eine ausführlichere Diskussion über die ethischen Kritikpunkte siehe dort.
Literatur
- Jochen Graw (2007): Nobelpreis 2007 in Medizin: Herstellung von knockout-Mäusen. In: Biologie in unserer Zeit. 37(6):352-354. PDF
- Braun, R. & Willnow, E. (1996): Die Knockout-Maus als Krankheitsmodell: Prinzipien und klinische Relevanz. In: Deutsches Ärzteblatt. Bd. 93, Nr. 26, S. 1765.
Weblinks
- Länger leben dank der Knockout-Maus. Telepolis vom 26. Januar 2003.
- Nobelpreise 2007 – Kooperativer Genausfall-Einfall. Spektrumdirekt vom 8. Oktober 2007.
- Homologe Rekombination Methode und Knockout Mäuse (englisch)
Einzelnachweise
- Informationen der Nobelstiftung zur Preisverleihung 2007 an Martin Evans, Mario Capecchi und Oliver Smithies (englisch)
- K. Rana, M. V. Clarke, J. D. Zajac, R. A. Davey, H. E. MacLean: Normal phenotype in conditional androgen receptor (AR) exon 3-floxed neomycin-negative male mice. In: Endocr. Res. Band 39, Nummer 3, 2014, S. 130–135, doi:10.3109/07435800.2013.864303, PMID 24467187.
- H. Wang, H. Yang, C. S. Shivalila, M. M. Dawlaty, A. W. Cheng, F. Zhang, R. Jaenisch: One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. In: Cell. Band 153, Nummer 4, Mai 2013, S. 910–918, ISSN 1097-4172. doi:10.1016/j.cell.2013.04.025. PMID 23643243. PMC 3969854 (freier Volltext).