Gesneriengewächse
Gesneriengewächse (Gesneriaceae) sind eine Pflanzenfamilie innerhalb der Ordnung der Lippenblütlerartigen (Lamiales). Es ist eine überwiegend tropische Familie. Die 147 bis 160 Gattungen mit 3200 bis 3870 Arten sind weitverbreitet. Sorten einiger Arten werden als Zierpflanzen verwendet.
| Gesneriengewächse | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Typische zygomorphe Blüten mit röhrenförmigen Blütenkronen bei Pearcea intermedia | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Gesneriaceae | ||||||||||||
| Rich. & Juss. ex DC. |
Beschreibung

_(8611177560).jpg.webp)
.jpg.webp)

Erscheinungsbild
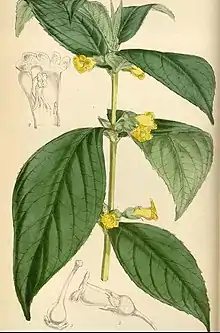
Es sind meistens ausdauernde, sehr selten einjährige krautige Pflanzen; außerdem gibt es auch einige verholzende Taxa: Halbsträucher, Sträucher und kleine Bäume[1] (Besleria, Peltanthera, Shuaria) oder selten Lianen.[2] Die Bäume erreichen Wuchshöhen von mehr als 13 Meter.[3] Die meisten Arten wachsen terrestrisch, doch gibt es auch viele epiphytische Arten. Sie wachsen selbständig aufrecht, kletternd, kriechend oder hängend.[2] Sie bilden Faserwurzeln. Die Stängel sind meist behaart; es können Drüsenhaare vorhanden sein. Einige Arten sind mehr oder weniger sukkulent.[2] Es ist nie Milchsaft vorhanden.[4]
Echte einjährige Pflanzen sind nur bei wenigen Gattungen bekannt, beispielsweise wenige Arten in der südafrikanischen Gattung Streptocarpus sowie in der asiatischen Gattung Chirita, vielleicht ist Sinningia nordestina die einzige einjährige Art in der Neotropis; alle echten einjährigen Arten gedeihen in rand- bis subtropischen Gebieten mit deutlichen saisonalen Klima. Monokarpe Arten sind meist keine einjährigen, sondern mehrjährige Pflanzen, sondern leben in den immerfeuchten Tropen, also ohne Jahreszeiten, einige bis viele Jahre vegetativ, bilden dann Blüten sowie Früchte und sterben nach der Samenreife ab. Eine besondere Ausprägung sind monokarpe Arten in tropischen Regenwäldern, die schon relativ früh nach der Keimung zu blühen beginnen sowie Samen bilden, sie blühen sowie fruchten ohne Unterbrechung einige bis viele Jahre lang, meist endet ihr Leben erst, wenn sie durch äußere Umstände zerstört werden (beispielsweise bei vielen Monophyllaea-Arten). Die ausdauernden (polykarpen), krautigen Pflanzen sind typisch für subtropische, warm-gemäßigte bis gemäßigte Gebiete der Welt mit mehr oder weniger deutlichen Jahreszeiten; dies können jahreszeitliche Temperatur- oder Niederschlagsschwankungen sein. Einige ausdauernde krautige Arten bilden Rhizome mit oder ohne schuppenförmigen kleinen Blättern oder Knollen als Überdauerungsorgane.[3]
Laubblätter
Die Laubblätter stehen bei vielen Arten in einer basalen Blattrosette zusammen, oft sind sie an der Sprossachse verteilt, meist gegenständig bis manchmal zu dritt oder viert quirlig, manchmal fast zweizeilig oder wechselständig und spiralig angeordnet.[2] Die Laubblätter sind meist gestielt.[3] Sitzende Laubblätter kommen nur bei Monophyllaea und „einblättrigen“ Streptocarpus-Arten vor. Die krautigen bis ledrigen, bifazialen (dorsiventralen) Blattspreiten sind meist einfach, seltener gelappt oder fiederspaltig. Manchmal ist auch nur ein großes Basalblatt, das aus einem Keimblatt weiterentwickelt wird vorhanden (einige Streptocarpus-Arten).[2] Die meist einfachen Blattspreiten sind sehr unterschiedlich geformt das reicht von linealisch bis lanzettlich, elliptisch bis ei- und fast kreis- oder herzförmig.[3] Die Blattränder sind glatt, gekerbt, gezähnt oder gesägt. Gebuchtete, mehr oder weniger stark gelappte Blattspreite kommen selten vor (beispielsweise bei wenigen Arten der Gattungen Ridleyandra, Chirita sowie Henckelia).[3] Die Blattflächen sind grün oder bei einigen Arten rötlich, manchmal mit weinroten Flecken auf der Blattunterseite. Es liegt meist Fiedernervatur, seltener Handnervatur vor. Domatien, hier als Gruben ausgebildet, gibt es bei Mitraria.[2] Die auf der Blattfläche verteilten oder in Gruppen zusammen stehenden Spaltöffnungen (Stomata) sind anisocytisch und oft sehr groß. Die Laubblätter der Gesneriaceae sind behaart (Indument). Oft wirken sie pelzig behaart. Die Trichome sind einfach und enthalten oft roten oder blauen Pflanzensaft oder sie sind langgestielt und mehrzellig. In den Blattspreiten bei beispielsweise Rhychoglossum und Monophyllaea sind schizogene Harz- und Ölkanäle vorhanden; jedoch bei den meisten Taxa fehlen sie. Im Mesophyll sind meist, in unterschiedlicher Menge und Form, Calciumoxalat-Kristalle vorhanden.[2][4]
Nebenblätter sind nie vorhanden.[1][2][4] Bei Rhytidophyllum-Arten kommen nebenblattähnliche Öhrchen an der Basis der Blattstiele vor, aber diese unterscheiden sich von echten Nebenblättern und entwickeln sich erst später als diese.[3]
Blütenstände
Es sind meist Blütenstandsschäfte vorhanden. Die Blütenstände stehen immer seitenständig, jedoch oft nahe dem oberen Ende der Sprossachsen und manchmal wirken sie wie endständig. Die Blüten stehen einzeln (reduzierte Zyme) oder in einem zusammengesetzten, nicht determinierten Gesamtblütenstand aus zweiblütigen, zymösen Teilblütenständen.[1] Es können Deckblätter vorhanden sein.[4]
Die zumeist auffälligen Blüten sind stark an ihre sehr unterschiedlichen Bestäuber (siehe unter Synökologie) angepasst und deshalb sehr formenreich. Die Blüten sind meist zwittrig; sehr wenige Arten sind einhäusig getrenntgeschlechtig (monözisch).[2]
Blüten
%252C_(Kornettblomma)%252C_(Cape_primrose)_C_IMG_3663.JPG.webp)

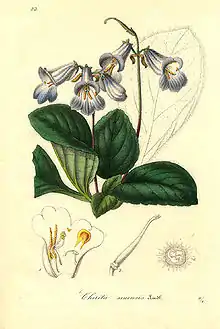
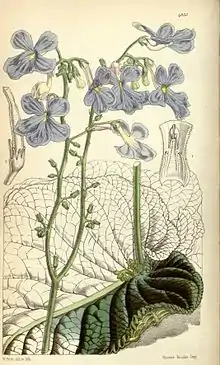
Die Blüten sind meist fünfzählig (sehr selten vierzählig) und mehr oder weniger stark zygomorph, selten radiärsymmetrisch. Die meist fünf Kelchblätter sind frei oder mehr oder weniger stark zu einem meist radiärsymmetrischen, selten zygomorphen Kelch verwachsen.[1] Wenn eine Kelchröhre vorhanden ist, dann endet sie mit gleichen langen bis kaum erkennbaren Kelchzähnen oder zweilippig. Die meist fünf Blütenkronblätter sind radförmig, glockig bis röhrig verwachsen. Die Blütenkronen sind meist zygomorph, selten radiärsymmetrisch und meist zweilippig.[1] Die Farben der Kronblätter reichen von Weiß und Grün, von Gelb über Orangefarben und Braun bis Rot, und von Violett bis Blau; manchmal sind mehrere Farben kombiniert mit oder ohne Zeichnungen.
Es ist nur ein Staubblattkreis vorhanden, es sind zwei Paare oder nur zwei, selten fünf, Staubblätter je Blüte. Ein oder drei Staminodien sind meist vorhanden. Die entweder langen und schlanken oder sehr kurzen Staubfäden sind immer mit den Kronblättern in je nach Taxon unterschiedlichen Höhen (nahe der Basis bis weit oben) verwachsen. Oft hängen die Staubbeutel paarweise oder alle zusammen.[4] Die Pollenkörner besitzen meist drei (zwei bis sechs) Aperturen und sind meist colporat (oder colporoidat) oder rugat. Bei den meisten Gattungen werden die Pollenkörner einzeln, also als Monaden, bei sechs Gattungen zu zweit, also als Dyaden, ausgebreitet.[2]
Meist sind Nektarien vorhanden, die mit der Fruchtknotenbasis verwachsen sind und alle Drüsen sind zu einem ring- bis becherförmigen Diskus (meist bei Taxa mit oberständigen Fruchtknoten) verwachsen oder seltener sind alle (zwei bis fünf) Drüsen frei, manchmal sind sie nicht funktionsfähig oder fehlen. Die Nektarien können auch durch ein, Osmophor genanntes, duftproduzierendes Gewebe ersetzt sein.[4]

Zwei Fruchtblätter sind zu einem ober- (alle Taxa der Alten Welt) oder halbunterständigen bis unterständigen, meist ein- selten zweikammerigen Fruchtknoten verwachsen; selten ist ein Fruchtblatt steril. In jedem Fruchtknoten befinden sich parietale, aufgespaltene Plazenten mit vielen anatropen, unitegmischen oder tenuinucellaten Samenanlagen.[4] Der meist gut ausgebildete Griffel endet in einer kopfigen, zweilippigen oder aus zwei unterschiedlichen Narbenästen bestehenden Narbe.[1]
Die Blütenformel lautet:

Früchte und Samen
Es werden trockene bis fleischige, sehr unterschiedlich geformte, lokulizide (fachspaltige), septizide (scheidewandspaltige) oder sich mit einem Deckel öffnende Kapselfrüchte oder fleischige, manchmal sehr auffällig bis unauffällig gefärbte Beeren gebildet.[4] Jede Frucht enthält viele Samen.[1][2]
Die immer winzigen Samen sind spindelförmig bis ellipsoid oder eiförmig und besitzen manchmal an einem oder beiden Enden Anhängsel.[1] Die Samen enthalten bei den meisten ölhaltiges Endosperm, das aus einer oder mehreren Schichten besteht; bei den Cyrtandroideae ist kein Endosperm vorhanden.[2]
Keimblätter
Der gerade Embryo besitzt zwei gleiche Keimblätter (Kotyledonen). Bei den paläotropischen Gesneriaceae wächst nach der Keimung ein Keimblatt schneller als das andere („anisocotyl“).[1]

Synökologie
Blütenökologie
Bei fast allen Arten der Familie Gesneriaceae erfolgt Fremdbestäubung. Um Fremdbestäubung zu begünstigen sind bei Gesneriaceae folgende Mechanismen ausgebildet: Protandrie, dabei reifen die Pollen und werden von den Staubbeuteln abgeben bevor in derselben Blüte die Narben aufnahmefähig für Pollen sind. Protogynie, dabei sind die Narben aufnahmefähig für Pollen und sind nicht mehr aufnahmefähig bevor in derselben Blüte die Pollen reifen und von den Staubbeuteln abgeben werden. Enantiostylie, es ist eine links-rechts-Position des Griffels kombiniert mit der gegenteiligen Position der Staubbeutel. Protandrie überwiegt insgesamt in der Familie der Gesneriaceae. Protogynie scheint nur bei einigen von Fledertieren bestäubten Gesneria-Arten vorzukommen. Enantiostylie kommt bei den Gattungen Didymocarpus, Henckelia und Saintpaulia vor; bei ihnen bleiben die Staubbeutel in einer unveränderlichen Position.[3]

_001.jpg.webp)

Fakultative oder obligate Selbstbestäubung ist nur von wenigen Arten bekannt oder vermutet (Autogamie beispielsweise bei Arten der Gattungen Epithema, Rhynchoglossum, Monophyllaea). Bei diesen Arten sind die Blüten meist klein sowie unauffällig und oft werden sie in großer Menge gebildet. Der Fruchtansatz beträgt nahezu 100 %. In wenigen Fällen öffnen sich die Blüten nicht und die Befruchtung findet in den Blütenknospen statt (Kleistogamie beispielsweise bei Streptocarpus nobilis, Codonanthopsis dissimulata).[3]
Bei fast allen Arten der Familie Gesneriaceae erfolgt die Bestäubung durch Tiere (Zoophilie). Bei der Bestäubung spielen Vögel die Hauptrolle, danach erst Insekten und Fledertiere.[3]
Bei den Arten der Neotropis überwiegt die Ornithophilie, die Bestäubung erfolgt also durch Vögel. Etwa 60 % der neotropischen Unterfamilie Gesnerioideae (also etwa 1000 Arten) werden von Kolibris (Trochilidae) bestäubt. Das Zentrum der vogelbestäubten Arten liegt in Kolumbien sowie Ecuador. Es gibt deutlich mehr epiphytische als terrestrische Arten, die von Vögeln bestäubt werden.[3] Erkennbar sind die ornithophilien Arten bereits am oft röhren- bis stieltellerförmigen Bau der Blütenkrone sowie an den Farben der Blüten, die ganz unterschiedliche, aber meist leuchtende, Rottöne (von rot über orangefarben bis leuchtend gelb) aufweisen. Vogelblüten bieten zudem immer reichlich Nektar an. Durch die Lage von Staubblättern und Narbe wird sichergestellt, dass der Pollen am Kopf des Vogels abgestreift wird und dann beim Besuch der nächsten Blüte eine Bestäubung erfolgt. Außer den Eigenschaften der Blüten spielen auch andere Merkmale für die Attraktivität für Kolibris eine Rolle. Große, farbige Deckblätter in den Blütenständen (beispielsweise DrymoniaArten) oder rote Flecken und Ränder oder durchscheinende Fenster auf den Laubblättern (beispielsweise Columnea sect. Collandra) dienen der Anlockung von Vögeln, bei solchen Arten sind die Blüten oft relativ unscheinbar flowers und in den Laubblättern versteckt. Bei Columnea florida wurde beobachtet, dass junge unerfahrene Kolibris (Brauner Zwergschattenkolibri (Phaethornis longuemareus) und Grünstirn-Brillantkolibri (Heliodoxa jacula)) zuerst auf die durchscheinenden, roten „Fensterscheiben“ der Laubblätter zielen und dann einige Sekunden damit verbringen, unterschiedliche Pflanzenteile zu untersuchen, bevor sie die Blüten finden; erfahrene Exemplare schwirren über den roten Flecken und tauchen dann schnell unter die Laubblätter, um direkt die Blüten in den Blattachseln zu erreichen. Bestäubung durch Vögel ist bei den Gesneriaceae der Alten Welt viel weniger häufig (bei den Gattungen Aeschynanthus, Agalmyla und bei jeweils wenigen Arten der ansonsten bienenbestäubten Gattungen Henckelia, Streptocarpus, Cyrtandra). In Afrika sowie Asien kommen wohl Vogelarten der Nektarvögel (Nectariniidae) und in einigen Gebieten von Sulawesi bis Neuseeland Honigfresser (Meliphagidae) als Bestäuber in Frage.[3]
Die Bestäubung durch Fledertiere (Chiropterophilie) ist nur aus der Neotropis bekannt und entwickelte sich mehreremale unabhängig in einigen Gattungen (Capanea, Drymonia, Kohleria, Gesneria, Rhytidophyllum, Sinningia und Paliavana). Bei solchen Arten besitzen die mehr oder weniger zygomorphen Blütenkronen kurze sowie breite oder deutlich glockenförmige Kronröhren. Ihre Blütenkronen sind gelblich oder grünlich mit braunen oder schmutzig-violetten Flecken. Es wird Nektar in großen Mengen produziert. Neue Berichte über Bestäubung von Sinningia brasiliensis sowie Paliavana prasinata durch Blattnasen- (Phyllostomidae) und Blütenfledermaus-Arten (Glossophaginae) beschreiben, dass für chiropterophile Bestäubung eine Anthese während der Nacht, unangenehmer Geruch und das Ansteigen der Nektarsekretion in der Nacht typisch sind.[3]
Unter den Insekten spielen Bienen (Apidae) die größte Rolle. In den Neotropen sind dabei Prachtbienen (Euglossini) besonders wichtig, aber auch Anthophoridae, vermutlich Xylocopinae sowie andere auch.[3] Etwa 30 % der Unterfamilie Gesnerioideae werden von beiden Geschlechtern (bei Orchideen beispielsweise geschieht das nur durch die Männchen) der Prachtbienen (Euglossini) bestäubt. Die Bestäubung durch Schmetterlinge scheint selten zu sein, es gibt einzelne Berichte von Nachtfaltern. Bestäubung durch Tagfalter wird vermutet (es gibt noch keine Berichte darüber) wenn die Blüten Nektar anbieten und rote oder blaue, stieltellerförmige Blütenkronen mit langen, engen Kronröhren und flachen Kronlappen besitzen (beispielsweise bei einigen Arten der Gattungen Achimenes, Sinningia sowie Episcia). Von Nachtfaltern bestäubt werden stark duftende Blüten mit weißen, cremefarbenen bis gelben Blütenkronen mit langen, engen Kronröhren (beispielsweise Sinningia tubiflora). Andere Blütenbesucher wie Wespen und Zweiflügler (Diptera) wie Mücken (Nematocera) sowie Schwebfliegen (Syrphidae) sind vielleicht an der Bestäubung auch beteiligt; jedoch ist keine Art auf einen dieser Bestäuber speziell angepasst. Die „Schlüssellochblüten“ einiger Streptocarpus-Arten mit engen Kronröhren, flachen Kronlappen sowie kleinen, seitlich verschmälerten Blütenöffnungen werden vermutlich von langrüsseligen Fliegen besucht.[3]


Die Hauptwirkung zur Anlockung von Bestäubern erfolgt visuell. Folgende blütenökologische Anpassungen der Blüten zur Anlockung bestimmter Bestäuber sind bei Gesneraceae verwirklicht: Nektarblüten, bei ihren zygomorphen Blütenkronen sind die mehr oder weniger auffällig gefärbten Kronblätter zu einer, oft langen, Kronröhre verwachsen und es ist ein Diskus zur Nektarsekretion vorhanden; der Nektar wird oft in speziellen Ausbuchtung an der Basis der Kronröhre gesammelt und bei ihnen ist der Pollen klebrig. Trugnektarblüten, sie besitzen das Aussehen von Nektarblüten, aber falls überhaupt Nektarien vorhanden sind, dann sind sie nicht funktionsfähig. Einige Ornithoboea-Arten könnte man zu den Trugnektarblüten einordnen, durch ausgebreitete Blütenkelche und die Form der Blütenkronen wirken ihre Blüten wie Orchideen-Blüten; es könnte sich tatsächlich um eine Mimikry von Orchideen-Blüten (vielleicht Calanthe), aber mindestens besitzen sie die Form von Nektarblüten. Pollenblüten, ihre Blüten sind nickend und die Kronblätter sind zu einer nur kurzen, glockenförmigen Kronröhre verwachsen; sie besitzen manchmal fünf fertile Staubblätter und die relativ großen, oft leuchtend gelben oder orangefarbenen Staubbeutel ragen mehr oder weniger weit aus der Kronröhre heraus und hängen manchmal zusammen, bei ihnen öffnen sich die Staubbeutel am oberen Ende mit Poren oder Querschlitzen und entlassen nicht klebrigen, puderigen Pollen, der beim Summen der Blütenbesucher ausgestreut wird; Nektarien sind nicht funktionsfähig oder reduziert (Ramonda, Conandron, Didymocarpus cordatus, Bellonia, Niphaea, Phinea, Napeanthus). Teilweise und vollständige Trugpollenblüten, reichhaltig Pollen wird durch gelbe Staubbeutelwände vorgetäuscht (beispielsweise bei Saintpaulia sind die robusten, gelben Staubbeutelwänden viel länger attraktiv als Pollen vorhanden ist; beispielsweise besitzt Petrocosmea kerrii einen gelben Fleck auf der Krone über dem Staubbeutel; gelbe Staubfädenkniee gibt es bei Henckelia caerulea, aber die echten Staubbeutel besitzen eine verbergende Farbe). Duftblüten, am bekanntesten ist dieser Blütentyp bei Gloxinia perennis, er kommt wohl auch bei Monopyle vor, ihre Kronblätter sind zu einer sehr kurzen und breiten Kronröhre verwachsen und Osmophoren (duftproduzierende Gewebe) sind nahe der Kronröhrenbasis anstatt der Nektarien vorhanden; die Osmophore besteht aus palisadenähnlichen, purpurbraunen Epidermiszellen, die winzige Tropfen von Terpenen sezernieren, die von Bienen gesammelt werden.[3]
Die meisten Arten der Gesneriaceae besitzen geruchlose Blüten, auf alle Fälle alle von Vögeln bestäubten Arten. Einige Arten aus etwa 15 Gattungen, besonders aus der Neotropis, besitzen duftende Blüten. Es gibt eine überraschende Vielfalt an Düften, es wird von süß-honigähnlich, moschusartig, zitronen-, nelken-, kohl-, aas-ähnlich und anderen berichtet. Der Duft scheint an bestimmte Bestäuber gerichtet zu sein. Bei Sinningia tubiflora lockt der zitronige Duft Nachtfalter an oder der kohlartige Geruch von Capanea cf. grandiflora lockt Fledertiere an. Berichte über Duft gibt es auch für wenige paläotropische Arten, beispielsweise Streptocarpus vandeleurii.[3]

Ausbreitungsökologie
Die Diasporen sind entweder die Beeren oder bei Kapselfrüchten die Samen.[3]
Bei den Arten mit Kapselfrüchten werden die bei Reife die winzigen Samen ausgestreut und durch Wind oder Regen ausgebreitet. Die Ausbreitung von Samen mit Anhängsel erfolgt offensichtlich durch Wind. Meist sind es epiphytische Arten, deren Samen Haare als Anhängsel besitzen, bei ihnen helfen diese Haare, besonders wenn sie feucht werden, sich an der Rinde von Ästen und der Borke von Baumstämmen anzuhaften. Bei Arten mit einem Haarschweif breiten sich die Haare bei trockenem Wetter aus und formen einen Fallschirm. Die große Effektivität der Ausbreitung mit Haarschweifen erklärt die weite Verbreitung von Aeschynanthus sect. Polytrichium in Asien und Malesien.[3]
Bei den Arten mit Beeren oder fleischigen Kapselfrüchten erfolgt Tierausbreitung durch meist Vögel (Ornithochorie), kleine Säugetiere oder Ameisen (Myrmekochorie).[3]
Damit die Samen durch Ameisen weiter getragen werden gibt es unterschiedliche Anpassungen, beispielsweise: Bei der Gattung Codonanthe besitzen einige Arten für diese Familie mit einer Länge von etwa 3 Millimeter ungewöhnlich große Samen, die in der unteren Hälfte von einem arillusähnlichen Becher umkleidet sind oder andere Arten besitzen die Samen mehrzellige, hyaline, lange Samenstiele (Funikel) und wieder andere Arten sind typische „Ameisengarten-Pflanzen“ bei denen der Samentransport durch Ameisen dokumentiert wurde. Die vergrößerten, fleischigen, weißen Funikel von Chrysothemis friedrichsthaliana enthalten fette Öle und bieten den Ameisen so etwas ähnliches wie Elaiosome. Bei Rufodorsia minor wurde der Samentransport durch Ameisen beobachtet nachdem die Beeren meist durch Vögel aufgebrochen wurden. Ameisen sind häufig sekundäre Samenausbreiter wenn die eigentlich geschlossenen Früchte erstmal geöffnet wurden.[3]
Wenn Vögel und kleine Säugetiere für die Ausbreitung sorgen, handelt es sich um Endochorie, die sogenannte Verdauungsausbreitung, bei der die Samen den Verdauungstrakt der Tiere passieren. Um Tiere anzulocken, die die Früchte oder Teile davon mit den Samen fressen sollen gibt es bei Gesneriaceae einige Anpassungen. Dafür wirken die ganzen reifen Beeren attraktiv oder es wird nach dem Öffnen der Früchte eine Fruchtmasse zur Schau gestellt. Auch der haltbare Kelch kann als Schauorgan wirken.[3]
Nutzung
Außer als Zierpflanzen werden kaum Arten aus der Familie der Gesneriaceae genutzt. So finden sich nur folgende Angabe: Von Conandron ramondioides werden die Blätter gegart gegessen, wenn es sonst nichts mehr anderes gibt.[5]
Zierpflanzen
Die meisten Gesneriaceae mögen es entsprechend ihrer tropischen Herkunft ganzjährig warm. Viele der Arten bevorzugen helle warme Standorte ohne direkte Sonneneinstrahlung.
Es gibt viele Gattungen, Arten und Sorten bei den Gesneriengewächsen, die sich als Zimmerpflanzen eignen (Auswahl):
- Usambaraveilchen (Saintpaulia), lassen sich leicht über Blatt-Stecklinge vermehren.
- Drehfrucht (Streptocarpus), lassen sich leicht über Blattteil-Stecklinge vermehren.
- Gloxinie (Sinningia speciosa (Lodd.) Hiern), sie bilden Knollen.
- Columnea, ursprünglich Epiphyten, werden oft als „Ampelpflanzen“ kultiviert.
- Episcia, bodendeckende Pflanzen.
- Schamblumen (Aeschynanthus), ursprünglich Epiphyten, werden oft als „Ampelpflanzen“ kultiviert.
- Kußmäulchen (Nematanthus, Syn.: Hypocyrta Mart., p.p.)
- Schiefteller (Achimenes), sie bilden Knollen und lassen sich leicht über Kopf-Stecklinge vermehren.
- Smithiantha, sie bilden Knollen.
- Chrysothemis
- Kohleria
- Codonanthe.
 Usambaraveilchen (Saintpaulia-ionantha-Hybride)
Usambaraveilchen (Saintpaulia-ionantha-Hybride)
mit der typischen blauen Farbe Drehfrucht (Streptocarpus)
Drehfrucht (Streptocarpus) Schiefteller (Achimenes)
Schiefteller (Achimenes) Episcia reptans
Episcia reptans
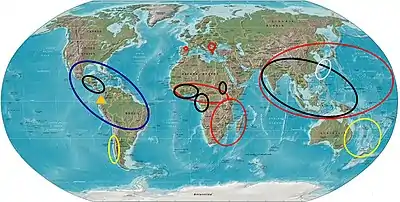
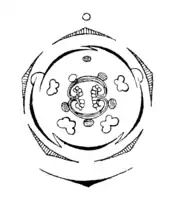
(Dreieck) Sanangoideae;
[weiße Ellipse] Gesnerioideae-Titanotricheae;
(gelbe Ellipse) Gesnerioideae-Coronanthereae;
(blaue Ellipse) Gesnerioideae-Beslerieae+Napeantheae+Gesnerieae (“Kern-Gesnerioideae”);
(schwarze Ellipse) Didymocarpoideae-Epithemateae;
(rote Ellipse) Didymocarpeae-Trichosporeae
Verbreitung
Die Familie Gesneriaceae besitzt ein weites Verbreitungsgebiet in der Alten Welt und Neuen Welt. Die Arten der Familie Gesneriaceae gedeihen weltweit hauptsächlich in den Tropen bis Subtropen. Einige Arten kommen in den Gemäßigten Gebieten in Südamerika, Europa, im Himalaja und nördlichen China vor.[3]
Nach Süden reicht das Gesamtverbreitungsgebiet bis ins südöstliche Australien, Neuseeland und südliche Chile. Die wenigen Arten der Gattungen Ramonda und Haberlea sind Tertiärrelikte in den Pyrenäen und auf der Balkanhalbinsel.
Jeweils etwa 60 Gattungen gibt es in der Indo-Malaiischen Bioregion (einschließlich Afghanistan, Pakistan, Südasien und Südostasien) und in der Neotropis. In Afrika gibt es etwa neun Gattungen mit etwa 160 Arten, in Europa gibt es nur drei Gattungen mit nur sechs Arten. Nur etwa neun Gattungen und 20 Arten gibt es ausschließlich auf der Südhalbkugel. Ein stark disjunktes Areal besitzen die Gattungen Rhynchoglossum in Asien aber auch einer Art in der Neotropis und Epithema mit einer Art in Westafrika aber den anderen 20 Arten in Asien und auf dem Indonesischen Archipel. In China gibt es etwa 56 Gattungen (davon 25 nur dort) und etwa 442 Arten (davon 354 endemisch). In Australien sind nur fünf Gattungen heimisch, zwei monotypische Gattung kommen nur dort vor.
In der Neotropis gibt es sieben Tribus mit etwa 60 Gattungen und etwa 1200 Arten. In der Neotropis sind Zentren der Artenvielfalt: mit über 400 Arten das Gebiet von Kolumbien bis Peru, mit etwa 250 Arten Zentralamerika, mit über 200 Arten das östliche Brasilien, mit etwa 100 Arten das Guyanaschild und mit etwa 100 Arten das tropische Mexiko.[4]
Systematik und botanische Geschichte










_flower-01.JPG.webp)



.jpg.webp)

_Gesneraid_Family_(3073307484)_(2).jpg.webp)












Taxonomie
Als Erstveröffentlichung der Familie Gesneriaceae unter dem Namen „Gessnerieae“ gilt Louis Claude Marie Richard und Antoine Laurent de Jussieu in Augustin-Pyrame de Candolle: Essai sur les Propriétés Médicales des Plantes, 2. Auflage, S. 192 vom 11. Mai 1816. Typusgattung ist Gesneria L. Der Gattungsname Gesneria und damit auch der Familie Gesneriaceae ehrt den Zürcher Naturforscher und Mediziner Conrad Gessner (1516–1565). Synonyme für Gesneriaceae (Rich. & Juss.) ex DC. sind: Belloniaceae Martinov, Didymocarpaceae D.Don, Ramondaceae Godr., Besleriaceae Raf., Cyrtandraceae Jack.
Äußere Systematik
Innerhalb der Ordnung der Lamiales sind die Gesneriaceae am nächsten mit den Calceolariaceae verwandt.
- Nicht mehr zur Familie Gesneriaceae gehören:
- Zu anderen Familien der Lamiales gestellt werden:
- Brookea Benth. (sie gehört zu den Plantaginaceae s. lat.)[6]
- Charadrophila Marloth (sie gehört zu den Stilbaceae)[6]
- Cyrtandromea Zoll. (sie gehört zu den Phrymaceae)[6] Die etwa zwölf Arten sind in der Neotropis verbreitet.
- Cubitanthus Barringer: (sie gehört zu den Linderniaceae)[6] Sie enthält nur eine Art:
- Cubitanthus alatus (Cham. & Schltdl.) Barringer: Die Heimat ist der brasilianische Bundesstaat Bahia.
- Rehmannia Fisch. & C.Mey.: Die etwa neun Arten kommen nur in China vor. (sie gehört zu den Orobanchaceae)[7][8][6]
- Zu anderen Familien der Lamiales gestellt werden:
Innere Systematik und botanische Geschichte
Die Familie der Gesneriengewächse (Gesneriaceae) wurde vor 2003/4 in vier Unterfamilien gegliedert. Nach A. Weber 2004[9] stellten sie vier informelle Gruppen dar, da sie nicht monophyletisch sind, haben aber den gleichen Umfang an Tribus und Gattungen. Dies stellte also nur eine Übergangslösung dar, bis weitere Untersuchungen wieder monophyletische Gruppen ergeben. Seit Weber et al. 2013 gibt es wieder vier Unterfamilie, aber in anderem Umfang als vor 2004.[6]
Die Familie Gesneriaceae enthält je nach Autor 147 bis 160 Gattungen mit 3200 bis 3870 Arten.
Etwa 40 Gattungen waren 2003/4 monotypisch.[10] Die Familie Gesneriaceae wurde vor 2013 in zwölf Tribus gegliedert:
- Didymocarpoid Gesneriaceae (nach A. Weber 2004), bisher Unterfamilie Didymocarpoideae oder Cyrtandroideae: Die Chromosomenzahl ist sehr unterschiedlich. Musste nach den Untersuchungen seit 1998 neu geordnet werden. Hier waren etwa 82 Gattungen und etwa 2000 Arten eingeordnet. Die alte Darstellung mit vier Tribus war:
- Hier aber nicht in einer Tribus eingeordnet waren drei Gattungen.
- Tribus Cyrtandreae Bartl.: Hier waren drei Gattungen eingeordnet.
- Tribus Didymocarpeae Endl.
- Tribus Titanotricheae W.T.Wang: Hier war nur eine monotypische Gattung eingeordnet.
- Tribus Trichosporeae Nees: Hier waren etwa fünf Gattungen eingeordnet.
- Epithematoid Gesneriaceae (nach A. Weber 2004), bisher Unterfamilie Epithematoideae: Die Chromosomenzahl n = meist 10 (8-12). Hier war nur eine Tribus eingeordnet. Verbreitung: hauptsächlich in Indien und Südostasien; eine Art gibt es in Westafrika und eine Art von Zentralamerika bis Peru:
- Tribus Klugieae Fritsch: Hier waren sechs bis sieben Gattungen eingeordnet.
- Gesnerioid Gesneriaceae (nach Anton Weber 2004), etwa der Umfang der frühen Unterfamilie Gesnerioideae: Die Chromosomenzahl n = 6-16. Hier warden sechs Tribus mit etwa 53 Gattungen und etwa 1500 Arten aus der Neuen Welt (Neotropis) eingeordnet. Viele Taxa sind Epiphyten, meistens werden sie von Vögeln bestäubt und verbreitet:
- Tribus Beslerieae Bartl.: Hier waren etwa acht Gattungen eingeordnet.[11]
- Tribus Napeantheae Wiehler: Hier war nur eine Gattung eingeordnet.
- Tribus Gesnerieae Dumort.: Hier waren nur zwei Gattungen eingeordnet.
- Tribus Gloxinieae (G.Don) G.Don nach E.H.Roalson et al. 2005[12]: Hier waren etwa 20 Gattungen eingeordnet.
- Tribus Sinningieae Fritsch: Die nur drei Gattungen kommen hauptsächlich in Brasilien vor.
- Tribus Sphaerorrhizeae Roalson & Boggan: Hier war nur eine Gattung eingeordnet.
- Tribus Episcieae Endl.
- Coronantheroid Gesneriaceae (nach Anton Weber 2004), bisher Unterfamilie Coronatheroideae: Es sind verholzende Pflanzen. Die Chromosomenzahl n = 37-45. Hier wurde nur eine Tribus eingeordnet:
- Tribus Coronanthereae Fritsch: Hier wurden etwa zehn meist monotypische Gattungen mit etwa 20 Arten und einer Verbreitung auf den Salomon-Inseln, Antillen, Neukaledonien und im südlichen Südamerika eingeordnet.
Seit Weber 2013 wird die Familie Gesneriaceae wieder in vier Unterfamilien mit vielen Tribus und Subtribus gegliedert:[13][14][6]
- Unterfamilie Sanangoideae A.Weber, J.L.Clark & Mich.Möller
- Tribus Titanotricheae Yamaz. ex W.T.Wang:[14][6]
- Sie enthält nur eine monotypische Gattung:[6][6]
- Titanotrichum Soler.: Sie enthält nur eine Art:
- Titanotrichum oldhamii (Hemsl.) Soler.: Sie kommt von Fujian und Taiwan über die Ryūkyū-Inseln bis auf weiteren japanischen Inseln vor.
- Titanotrichum Soler.: Sie enthält nur eine Art:
- Sie enthält nur eine monotypische Gattung:[6][6]
- Tribus Napeantheae Wiehler:[14][6]
- Sie enthält nur eine Gattung:[6]
- Napeanthus Gardner: Die mindestens 23 Arten sind in der Neotropis weitverbreitet.
- Sie enthält nur eine Gattung:[6]
- Tribus Beslerieae Bartl.:[14] Sie wird in zwei Subtribus gegliedert:[6]
- Subtribus Anetanthinae A.Weber & J.L.Clark:[14] Sie enthält etwa fünf Gattungen:[6]
- Anetanthus Hiern ex Benth. & Hook. f.: Die beiden Arten Anetanthus gracilis Hiern und Anetanthus rubra L.E.Skog sind in Peru, Bolivien, im zentralen Kolumbien und im südöstlichen Brasilien verbreitet.
- Cremospermopsis L.E.Skog & L.P.Kvist: Die zwei Arten Cremospermopsis cestroides (Fritsch) L.E.Skog & L.P.Kvist, Cremospermopsis parviflora L.E.Skog & L.P.Kvist kommen in den kolumbianischen Departamentos Antioquia und angrenzenden Bolivar vor.
- Resia H.E.Moore: Die beiden Arten Resia ichthyoides Leeuwenb. und Resia nimbicola H.E.Moore kommen in Kolumbien und Venezuela vor.
- Shuaria D.A.Neill & J.L.Clark: Sie wurde 2010 aufgestellt[6] und enthält nur eine Art:
- Shuaria ecuadorica D.A.Neill & J.L.Clark: Dieser mit nur 3 bis 5 Meter Wuchshöhe kleine Baum gedeiht im Unterholz in der Cordillera del Cóndor sowie im Amazonasgebiet im südöstlichen Ecuador. Da die einzelnen Standorte sehr isoliert sind wird sie als „Near Threatened“ = „potenziell gefährdet“ bewertet.[15]
- Tylopsacas Leeuwenb.: Sie enthält nur eine Art:
- Tylopsacas cuneata (Gleason) Leeuwenb.: Sie gedeiht im Bergwald im Guayana-Hochland.
- Subtribus Besleriinae G.Don:[14] Sie enthält etwa vier Gattungen mit etwa 240 Arten:[6]
- Besleria L.: Die über 200 Arten sind in der Neotropis weitverbreitet, mit Zentren der Artenvielfalt in den Anden Kolumbiens und Ekuadors. Viele der Arten sind Endemiten teilweise in kleinen Gebieten.
- Cremosperma Benth.: Die 20 bis 25 Arten sind von Panama bis zu den Anden Perus verbreitet.
- Gasteranthus Benth.: Die etwa 35 Arten sind von Guatemala und angrenzenden Gebieten in Mexiko, Costa Rica und Panama über das westliche Südamerika bis Bolivien, mit dem Zentrum der Artenvielfalt im westlichen Ekuador.
- Reldia Wiehler: Die etwa 60 Arten gedeihen meist in Bergwäldern oder selten in Tiefland-Regenwäldern von Panama bis ins nördliche Peru.
- Subtribus Anetanthinae A.Weber & J.L.Clark:[14] Sie enthält etwa fünf Gattungen:[6]
- Tribus Coronanthereae Fritsch[14] (Syn.: Coronantheroid Gesneriaceae (nach Anton Weber 2004), Unterfamilie Coronatheroideae (nach Wiehler 1983)): Es sind verholzende Pflanzen. Die Chromosomenzahl beträgt n = 37-45. Sie wird in drei Subtribus gegliedert:[6]
- Subtribus Coronantherinae Fritsch:[14] Sie enthält zwei Gattungen:[6]
- Coronanthera C.B.Clarke: Von den etwa elf Arten kommen zehn in Neukaledonien und eine auf den Salomonen vor.
- Rhabdothamnus Cunn.: Sie enthält nur eine Art:
- Rhabdothamnus solandri Cunn.: Sie kommt nur auf der Nordinsel Neuseelands vor.
- Subtribuse Mitrariinae Hanst.:[14] Sie enthält vier monotypische Gattungen, also nur vier Arten auf der Südhalbkugel:[6]
- Asteranthera Hanst.: Sie enthält nur eine Art:
- Asteranthera ovata Hanst.: Sie kommt im südlichen Chile und angrenzenden Gebieten in Argentinien vor.
- Fieldia Cunn.: Sie enthält nur eine Art:
- Fieldia australis Cunn.: Sie wächst in den Regenwäldern des südöstlichen Australiens auf Bäumen oder bemoosten Felsen.
- Mitraria Cav.: Sie enthält nur eine Art:
- Mitraria coccinea Cav.: Sie kommt in Chile und im angrenzenden Argentinien vor.
- Sarmienta Ruiz & Pav.: Sie enthält nur eine Art:
- Sarmienta scandens (J.D.Brandis) Pers. (Syn.: Sarmienta repens Ruiz & Pav. nom. illeg.): Sie gedeiht in den kühlen Regenwäldern im südlichen Chile und auf der Insel Chiloé.
- Asteranthera Hanst.: Sie enthält nur eine Art:
- Subtribus Negriinae V.L.Woo, J.F.Smith & Garn.-Jones:[14] Sie hat drei Gattungen mit etwa vier Arten enthalten[6] und enthält seit 2021 eine weitere monotypische Gattung.[16] Alle fünf Arten kommen auf der Südhalbkugel vor:
- Bopopia Munzinger & J.R.Morel: Sie wurde 2021 aufgestellt und enthält nur eine Art:[16]
- Bopopia parviflora Munzinger & J.R.Morel: Ein Endemit von Neukaledonien.[16]
- Depanthus S.Moore: Die nur zwei Arten kommen nur in Bergwäldern Neukaledoniens vor.
- Lenbrassia G.W.Gillett: Sie enthält nur eine Art:
- Lenbrassia australiana (C.T.White) G.W.Gillett: Die zwei Varietäten gedeihen im nördlichen Queensland im nordöstlichen Australien im Regenwald über Granit in Höhenlagen von 750 bis 1100 Metern.
- Negria F.Muell.: Sie enthält nur eine Art:
- Negria rhabdothamnoides F.Muell.: Es ist ein Endemit der Lord-Howe-Insel.
- Bopopia Munzinger & J.R.Morel: Sie wurde 2021 aufgestellt und enthält nur eine Art:[16]
- Subtribus Coronantherinae Fritsch:[14] Sie enthält zwei Gattungen:[6]
- Tribus Gesnerieae Dumort.[14][6]
- Subtribus Columneinae Hanst.: Entspricht etwa dem Umfang der bisherigen Tribus Episcieae Endl.:[14][6]
- Alloplectus Mart.: s. str.: Die nur noch etwa fünf Arten sind von Costa Rica bis zu den Anden Kolumbiens, nördlichen Ekuadors und Perus verbreitet.
- Alsobia Hanst.: Die beiden Arten Alsobia dianthiflora (H.E.Moore & R.G.Wilson) Wiehler und Alsobia punctata (Lindl.) Hanst. kommen in Mexiko, Guatemala und Costa Rica vor.
- Centrosolenia Benth.: Sie wurde 2016 reaktiviert.[6] Die etwa 13 Arten kommen vom nördlichen Südamerika bis ins nördliche Brasilien vor
- Christopheria J.F.Sm. & J.L.Clark: Sie wurde 2013 aufgestellt und enthält nur eine Art:[6]
- Christopheria xantha (Leeuwenb.) J.F.Sm. & J.L.Clark: Sie kommt im nördlichen Südamerika vor.
- Chrysothemis Decne. (Syn.: Tussacia Benth., Tussacia Raf., Tussacia Klotzsch ex Beer, Tussacia Willd. ex Roem. & Schult.): Die etwa sieben Arten sind von Ekuador bis Guatemala, im zentralen Brasilien, in den Guyana-Staaten, Venezuela und auf den Kleinen Antillen verbreitet.
- Cobananthus Wiehler: Sie enthält nur eine Art:
- Cobananthus calochlamys (Donn. Sm.) Wiehler: Es handelt sich um einen Endemiten der Region von Cobán in Alta Verapaz in Guatemala.
- Codonanthe (Mart.) Hanst. (Syn.: Coccanthera K.Koch & Hanst., Comes Buc'hoz): Sie enthält seit 2013 nicht mehr über 20 Arten, sondern nur noch etwa neun in Brasilien.[6]
- Codonanthopsis Mansf.: Die seit 2013 etwa 13 Arten sind in der Neotropis verbreitet.[6]
- Columnea L. (Syn.: Achimenes P.Browne non Pers., Aponoa Raf., Bucinella Wiehler, Collandra Lem., Eusynetra Raf., Glycanthes Raf., Kohlerianthus Fritsch, Pterygoloma Hanst., Stenanthus Oerst. ex Hanst., Stygnanthe Hanst., Vireya Raf.): s. l.: Der Umfang der Gattung wird kontrovers diskutiert: mit etwa 270 Arten s. l.; s. str.: 75 Arten, zusätzlich vier bisherige Gattungen, inklusive Dalbergaria Tussac mit etwa 90 Arten, Tricantha Hook. mit 75 Arten, Ortholoma (Benth.) Hanst. und Pentadenia Hanst.
- Corytoplectus Oerst.: Die etwa 15 Arten gedeihen in größeren Höhenlagen der westlichen Gebirgskette von Panama bis Bolivien und an der Küste Venezuelas sowie im Hochland von Guayana.
- Cremersia Feuillet & L.E.Skog: Sie enthält nur eine Art:
- Cremersia platula C.Feuillet & L.E.Skog: Dieser Endemit kommt nur Französisch-Guyana vor.
- Crantzia Scop.: Sie wurde 2005/6 reaktiviert und enthält zwei bis vier Arten, die vor 2005 in die Gattung Alloplectus eingegliedert waren.[6] Sie kommen im tropischen, nördlichen Südamerika vor.
- Drymonia Mart.: Die etwa 140 Arten sind weitverbreitet.
- Episcia Mart.: Die acht bis neun Arten sind von Mexiko bis Peru, im nördlichen Brasilien und den Guyanas verbreitet, beispielsweise:
- Episcia lilacina Hanst.
- Glossoloma Hanst.: Sie wurde 2005/6 reaktiviert.[6] Die etwa 28 Arten sind in der Neotropis von Mexiko bis Bolivien weitverbreitet.
- Lampadaria Feuillet & L.E.Skog: Sie enthält nur eine Art:
- Lampadaria rupestris Feuillet & L.E.Skog: Sie kommt nur in Guyana vor.
- Lembocarpus Leeuwenb.: Sie enthält nur eine Art:
- Lembocarpus amoenus Leeuwenb.: Sie kommt in Regenwäldern auf Granit in Surinam und Französisch-Guayana vor.
- Lesia J.L.Clark & J.F.Sm.: Sie wurde 2013 aufgestellt und enthält nur zwei Arten im tropischen Südamerika.[6]
- Nautilocalyx Hanst. (Syn.: Physodeira Hanst., Skiophila Hanst., Nauticalyx Hort. ex Loud., Episcia subgen. Physodeira Hanst., Episcia sect. Nautilocalyx (Hanst.) Benth., Episcia sect. Skiophila (Hanst.) Benth., Episcia sect. Physodeira (Hanst.) Benth., Episcia sect. Episcia subsect. Centrosolenia (Benth.) Leeuwenb. p.p., Episcia sect. Episcia subsect. Physodeira (Hanst.) Leeuwenb., Episcia sect. Tarachanthus Leeuwenb., Episcia sect. Trichosperma Leeuwenb.): Die über 70 Arten sind in der Neotropis weitverbreitet, nur im südöstlichen Brasilien kommt keine Art vor.
- Nematanthus Schrad. (Syn.: Hypocyrta Mart. 1829, p.p.): Die etwa 30 Arten kommen im östlichen Brasilien vor.
- Neomortonia Wiehler: Sie enthält seit 2013 nur noch eine Art:[6]
- Neomortonia rosea Wiehler: Sie kommt von Costa Rica über Panama, bis Kolumbien und Ecuador vor.
- Oerstedina Wiehler: Die nur drei Arten sind von Mexiko bis Zentralamerika verbreitet.
- Pachycaulos J.L.Clark & J.F.Sm.: Sie wurde 2013 aufgestellt und enthält nur eine Art:[6]
- Pagothyra (Leeuwenb.) J.F.Sm. & J.L.Clark: Sie hat seit 2013 den Rang einer Gattung und enthält nur eine Art:[6]
- Pagothyra maculata (Hook. f.) J.F.Sm. & J.L.Clark: Sie kommt im nördlichen Südamerika vor.
- Paradrymonia Hanst.:[6] Die früher 34 bis 70, seit 2016 nur noch etwa 10 Arten sind von Costa Rica über Panama und von Kolumbien, Ecuador bis Bolivien, im nördlichen Brasilien sowie in den Guyanas verbreitet.
- Rhoogeton Leeuwenb.: Die zwei bis vier Arten kommen in Venezuela und Guyana vor.
- Rufodorsia Wiehler: Die etwa vier Arten sind von Nicaragua bis Panama verbreitet.
- Trichodrymonia Oerst.: Sie wurde 2016 reaktiviert.[6] Die etwa 29 Arten sind in der Neotropis verbreitet.
- Subtribus Gesneriinae Oerst.[14]: Sie enthält 2020 vier Gattungen mit über 100 Arten auf karibischen Inseln und in Kolumbien sowie Venezuela:[6]
- Bellonia L.: Von den nur zwei Arten kommt Bellonia aspera L. auf Kuba und Bellonia spinosa Swartz auf Hispaniola vor.
- Gesneria L.: Die 46 bis 60 Arten kommen auf karibischen Inseln vor.
- Pheidonocarpa L.E.Skog: Sie enthält nur eine Art:
- Pheidonocarpa corymbosa (Sw.) L.E.Skog: sie kommt nur auf den karibischen Inseln Kuba und Jamaica vor.
- Rhytidophyllum Mart.: Die etwa 20 Arten sind auf karibischen Inseln und in Kolumbien sowie Venezuela verbreitet.
- Subtribus Gloxiniinae G.Don (Syn.: Tribus Gloxinieae (G.Don) G.Don: Sie hat etwa 20 nach E.H.Roalson et al. 2005 Gattungen[12] enthalten):[14][6]
- Schiefteller (Achimenes Pers.): Die etwa 24 Arten sind von Mexiko bis Kolumbien einschließlich der Karibischen Inseln verbreitet.
- Amalophyllon Brandegee: Sie wurde 2008 reaktiviert und enthält etwa 13 Arten die vom südlichen Mexiko über Zentralamerika bis ins nördliche Südamerika verbreitet sind.
- Chautemsia A.O.Araujo & V.C.Souza: Sie wurde 2010 aufgestellt und enthält nur eine Art:[6]
- Chautemsia calcicola A.O.Araujo & V.C.Souza: Sie kommt im südöstlichen Brasilien vor.
- Diastema Benth.: Die über 20 Arten sind in der Neotropis verbreitet.
- Eucodonia Hanst.: Die nur zwei Arten kommen im zentralen und südlichen Mexiko vor.
- Gloxinella (H.E.Moore) Roalson & Boggan: Sie hat seit 2005 den Rang einer Gattung[6] enthält nur eine Art:
- Gloxinella lindeniana (Regel) Roalson & Boggan: Diese Art war lange Zeit nur aus Kultur bekannt mit unbekannter Herkunft und wurde in Peru (Cajamarca) wiederentdeckt.
- Gloxinia L'Hér. (Syn.: Anodiscus Benth., Escheria Regel, Eucolum Salisb., Fiebrigia Fritsch, Fritschiantha Kuntze, Koellikeria Regel, Salisia Regel):[6] Die seit 2005 nur noch etwa drei Arten[6] und seit 2020 etwa fünf Arten sind in der Neotropis, hauptsächlich in den Anden verbreitet.
- Gloxiniopsis Roalson & Boggan: Sie wurde 2005 aufgestellt und enthält nur eine Art:[6]
- Gloxiniopsis racemosa (Benth.) Roalson & Boggan: Sie gedeiht in den Anden Kolumbiens.
- Goyazia Taub.: Die nur zwei Arten kommen im zentralen Brasilien (Planalto) vor.
- Heppiella Regel: Die etwa vier Arten sind von Peru bis ins westliche Venezuela verbreitet.
- Kohleria Regel (Syn.: Brachyloma Hanst., Calycostemma Hanst., Capanea Decne. ex Planch., Cryptoloma Hanst., Capanea Decne., Gesneria Mart. sect. Isoloma Benth., Giesleria Regel, Isoloma (Benth.) Decne. non J.Smith, Sciadocalyx Regel, Synepileana Baill., Tydaea Decne.):[6] Der Umfang der Gattung wurde kontrovers diskutiert und enthält etwa 17 bis 22 Arten. Die Heimat sind die Gebirgskette von Peru bis Mexiko, Venezuela, Trinidad und die Guayanas. Das Diversitätszentrum liegt in Kolumbien.
- Mandirola Decne.: Sie wurde 2005 reaktiviert. Die nur drei Arten sind in Brasilien verbreitet.[6]
- Monopyle Moritz ex Benth.: Die etwa 17 Arten sind von Bolivien bis Guatemala verbreitet.
- Moussonia Regel: Die etwa elf Arten sind von Mexiko bis Panama verbreitet.
- Niphaea Lindl.: Die etwa fünf Arten kommen in Mexiko und Guatemala vor.
- Nomopyle Roalson & Boggan: Die nur zwei Arten kommen in Ekuador und Peru vor.
- Pearcea Regel (inklusive Parakohleria Wiehler): Die heute etwa 17 Arten sind im nördlichen Südamerika verbreitet.
- Phinaea Benth.: Sie hat früher 10 bis 16 Arten enthalten, seit 2008 gibt es nur noch drei Arten.[6] Von den noch drei Arten kommt eine vom nordöstlichen Kolumbien bis nordbrasilianischen Pará vor, eine kommt vom westlichen bis ins zentrale Mexiko vor und eine ist ein Endemit im westlichen Kuba.
- Seemannia Regel: Sie wurde 2005 reaktiviert.[6] Die etwa vier Arten sind hauptsächlich die Anden: Bolivien, nördliches Argentinien und südliches Peru verbreitet. Seemannia sylvatica reicht bis ins südliche Ekuador.
- Smithiantha Kuntze: Die etwa sieben Arten sind vom zentralen und nördlichen Mexiko bis Guatemala verbreitet.
- Solenophora Benth: Die etwa 16 Arten sind in Zentralamerika verbreitet.
- Subtribus Ligeriinae Hanst.: Sie entspricht der früheren Tribus Sinningieae Fritsch[14]: Sie enthält nur noch drei Gattungen,[6] die hauptsächlich in Brasilien vorkommen:
- Paliavana Vand.: Die etwa sechs Arten sind im östlichen und südöstlichen Brasilien verbreitet.
- Sinningia Nees (Syn.: Alagophyla Raf., Almana Raf., Biglandularia Seem., Corytholoma (Benth.) Decne., Dircaea Decne., Dolichodeira Hanst., Fimbrolina Raf., Gesnera Mart., Lietzia Regel, Ligeria Decne., Megapleilis Raf., Orthanthe Lem., Rechsteineria Regel, Rosanowia Regel, Stenogastra Hanst., Styrosinia Raf., Tapeinotes DC., Tapina Mart., Tulisma Raf., Anodiscus Benth. und Koellikeria Regel): Die etwa 65 Arten sind in der Neotropis, hauptsächlich im südlichen und östlichen Brasilien verbreitet. Einschließlich der von Gärtner Gloxinie genannten Sinningia speciosa (Lodd.) Hiern.
- Vanhouttea Lem.: Die etwa acht Arten kommen im südöstlichen Brasilien vor.
- Subtribus Sphaerorrhizinae A.Weber & J.L.Clark (Syn.: Tribus Sphaerorrhizeae Roalson & Boggan):[14] Sie enthält nur eine Gattung:[6]
- Sphaerorrhiza Roalson & Boggan: Sie wurde 2005 aufgestellt.[6] Die beiden Arten Sphaerorrhiza sarmentiana (Gardn. ex Hook.) Roalson & Boggan und Sphaerorrhiza burchellii (S.M.Phillips) Roalson & Boggan sind in Brasilien verbreitet.
- Subtribus Columneinae Hanst.: Entspricht etwa dem Umfang der bisherigen Tribus Episcieae Endl.:[14][6]
- Tribus Epithemateae C.B.Clarke (Syn.: Tribus Klugieae Fritsch):[14] Sie entspricht den bisherigen Epithematoid Gesneriaceae nach A. Weber 2004, davor Unterfamilie Epithematoideae: Sie wird in vier Subtribus gegliedert und enthält sieben Gattungen mit etwa 85 Arten. Das Verbreitungsgebiet reicht hauptsächlich von Indien bis Südostasien; eine Art gibt es in Westafrika und eine Art kommt von Zentralamerika bis Peru vor. Die Chromosomenzahl beträgt n = meist 10 (8-12):[6]
- Subtribus Epithematinae DC. ex Meisn.[14] Sie enthält nur eine Gattung:[6]
- Epithema Blume: Die seit 2015 etwa zwanzig Arten sind in Süd- und Südostasien sowie Westafrika verbreitet.
- Subtribus Loxoniinae A.DC.:[14] Sie enthält drei Gattungen:[6]
- Gyrogyne W.T.Wang: Sie enthält nur eine Art:
- Gyrogyne subaequifolia W.T.Wang: Dieser Endemit gedeiht in niedrigen Höhenlagen im westlichen Guangxi nur im Bose Xian.[1]
- Loxonia Jack: Die etwa drei Arten sind im westlichen Malesien: Sumatra, Malaiische Halbinsel, Borneo und Java verbreitet.
- Stauranthera Benth.: Die etwa zehn Arten sind in Südostasien und auf Pazifischen Inseln verbreitet.
- Gyrogyne W.T.Wang: Sie enthält nur eine Art:
- Subtribus Loxotidinae G.Don[14] Sie enthält nur eine Gattung:[6]
- Rhynchoglossum Blume (Syn.: Antonia R.Br., Glossanthus Klein ex Benth., Klugia Schltdl., Loxotis R.Br. ex Benth.): Von den etwa 13 Arten sind etwa zwölf Arten in Süd- bis Südostasien sowie auf Pazifischen Inseln verbreitet und eine Art ist in der Neotropis verbreitet.
- Subtribus Monophyllaeinae A.Weber & Mich.Möller:[14] Sie enthält nur zwei Gattungen:[6]
- Monophyllaea R.Br.: Die über 30 Arten sind in Malesien von Sumatra bis Neuguinea und vom südlichen Thailand und Luzon bis Java verbreitet.
- Whytockia W.W.Sm.: Die etwa sechs Arten sind in China (fünf Arten) und Taiwan (eine Art) verbreitet.
- Subtribus Epithematinae DC. ex Meisn.[14] Sie enthält nur eine Gattung:[6]
- Tribus Trichosporeae Nees: Sie entspricht weitgehend den bisherigen Didymocarpoid Gesneriaceae nach A. Weber 2004, davor Unterfamilie Didymocarpoideae oder Cyrtandroideae.[14] Sie enthält etwa 71 Gattungen mit etwa 2400 Arten. Auch 2020 konnten die natürlichen Verwandtschaftsgruppen noch nicht hinreichend gut geklärt werden. 2020 erfolgte noch eine Gliederung in zehn Subtribus, die teilweise nur eine Gattung enthalten. Weitere molekulargenetische Untersuchungen zur weiteren Klärung sind erforderlich.[6]
- Subtribus Corallodiscinae A.Weber & Mich.Möller[14] Sie enthält nur eine Gattung:[6]
- Corallodiscus Batalin: Die drei bis fünf Arten sind im nördlichen Indien, Bhutan, Nepal, Sikkim, Thailand und China (drei Arten) verbreitet.
- Subtribus Didissandrinae A.Weber & Mich.Möller[14] Sie enthält nur zwei Gattungen mit etwa zehn Arten:[6]
- Subtribus Didymocarpinae G.Don[14]: Sie enthält 2020 etwa 35 Gattungen mit etwa 1900 Arten:[6]
- Schamblumen (Aeschynanthus Jack, Syn.: Euthamnus Schltr., Micraeschynanthus Ridl., Oxychlamys Schltr., Rheithrophyllum Hassk., Trichosporum D.Don.):[6] Die etwa 140 Arten sind in Asien und auf Pazifischen Inseln verbreitet.
- Agalmyla Blume (Syn.: Orithalia Blume nom. illeg., Orythia Endl., Dichrotrichum Reinw. ex De Vriese, Tetradema Schltr.): Die etwa 100 Arten sind in Malesien verbreitet.
- Allocheilos W.T.Wang: Die zwei Arten kommen im südlichen China vor: Allocheilos cortusiflorus W.T.Wang und Allocheilos guangxiensis H.Q.Wen, Y.G.Wei & S.H.Zhong in Höhenlagen von etwa 1400 Metern im tropischen Karst im südwestlichen Guizhou (Xingyi Xian) und östlichen Yunnan (Luoping Xian) in Höhenlagen von etwa 100 Metern in Guangxi.[1]
- Allostigma W.T.Wang: Sie enthält nur eine Art:
- Allostigma guangxiense W.T.Wang: Es ist im südlichen China ein Endemit des Autonomen Gebiets Guangxi.[1]
- Anna Pellegr.: Die nur drei Arten kommen in China und im nördlichen Vietnam vor.
- Chayamaritia D.J.Middleton & Mich.Möller: Sie wurde 2015 aufgestellt.[6] Die nur zwei Arten kommen in Indochina vor.
- Billolivia D.J.Middleton: Sie wurde 2014 aufgestellt[17][6] und enthält etwa 15 Arten nur in Vietnam.
- Briggsiopsis K.Y.Pan: Sie enthält nur eine Art:
- Briggsiopsis delavayi (Franch.) K.Y.Pan: Sie kommt im südlichen China vor.
- Cathayanthe Chun: Sie enthält nur eine Art:
- Cathayanthe biflora Chun: Dieser Endemit gedeiht in Höhenlagen von etwa 2400 Metern nur in der chinesischen Provinz Hainan.[1]
- Chayamaritia D.J.Middleton & Mich.Möller: Sie wurde 2015 aufgestellt.[6] Die zwei Arten kommen in Laos und Thailand vor.
- Conandron Sieb. & Zucc.: Sie enthält nur eine Art:
- Conandron ramondioides Sieb. & Zucc.: Sie kommt in Japan, Taiwan und im östlichen China (südlichen Anhui, nördlichen Fujian, nordöstlichen Jiangxi, Zhejiang) vor.
- Codonoboea Ridl. (Syn.: Platyadenia B.L.Burtt): Die seit 2011 etwa 129 Arten sind von Thailand bis ins westliche Malesien verbreitet.[18][6]
- Cyrtandra J.R.Forst. & G.Forst.: Sie ist mit 550 bis 600 Arten die artenreichste Gattung der Familie. Ihr Verbreitungsgebiet reicht von den Nikobaren und südliche Thailand über Malesien und die südlichen Pazifischen Inseln bis Hawaii.
- Deinostigma W.T.Wang & Z.YuLi: Sie war monotypisch und enthält seit 2010 etwa fünf und seit 2020 etwa acht Arten in China und Vietnam.[6]
- Didymocarpus Wall. (Syn.: Roettlera Vahl, Rottlera Vahl):[6] Die etwa 75 Arten sind vom nördlichen und nordöstlichen Indien, Nepal und südlichen China südwärts bis zur Malaiischen Halbinsel und auf dem nördlichen Sumatra verbreitet.
- Didymostigma W.T.Wang: Die nur zwei oder drei Arten sind in China verbreitet.
- Glabrella Mich.Möller & W.H.Chen: Sie wurde 2014 aufgestellt.[6] Die drei Arten kommen im südlichen China vor.
- Gyrocheilos W.T.Wang: Die nur vier Arten sind in China verbreitet.
- Hemiboea C.B.Clarke (Syn.: Metabriggsia W.T.Wang): Die früher etwa 23 Arten seit 2011 etwa 40 Arten[6] sind vom östlichen Himalaja über China bis Taiwan, südlichen Japan und nördlichen Vietnam verbreitet.
- Hexatheca C.B.Clarke: Die etwa vier Arten kommen in Borneo (vom westlichen Kalimantan und Sarawak bis Sabah) vor.
- Henckelia Spreng. (Syn.: Henckelia sect. Henckelia Weber & Burtt, Babactes DC. ex Meisn., Calosacme Wall., Ceratoscyphus Chun, Didymocarpus sect. Orthoboea Benth., Hemiboeopsis W.T.Wang, Chirita Buch.-Ham. ex D.Don, Chirita sect. Euchirita C.B.Clarke, Didymocarpus sect. Euchirita (C.B.Clarke) Chun, Gonatostemon Regel, Roettlera sect. Euchirita (C.B.Clarke) Fritsch): Die Gattung Henckelia hat seit Weber 2011 einen anderen Umfang,[18] der 2013 auf etwa 73 Arten reduziert wurde. Die Arten entsprechend dem Umfang von 2013 sind von Sri Lanka, südlichen Indien, Bangladesh, Assam, Nepal, Tibet, China, Taiwan, Myanmar, Thailand, Vietnam, Laos bis Malaysia verbreitet.[6]
- Liebigia Endl. (Syn.: Tromsdorffia Blume non Bernhardi nec Martius, Morstdorffia Steud., Chirita sect. Liebigia (Endl.) C.B.Clarke, Hypopteron Hassk. nom. inval., Bilabium Miq.): Sie wurde 2011 reaktiviert. Die etwa zwölf Arten kommen von Indonesien bis Sumatra vor.[18][6]
- Loxostigma C.B.Clarke: Die seit 2014 etwa 13 Arten[6] sind in Indien, Bhutan, Nepal, Sikkim, Myanmar, China (sieben Arten) und nördlichen Vietnam verbreitet.
- Lysionotus D.Don: Die etwa 25 Arten sind im nördlichen Indien, in Bhutan, Myanmar, Nepal, China, Laos, nördlichen Thailand, im nördlichen Vietnam und südlichen Japan verbreitet.
- Metapetrocosmea W.T.Wang: Sie enthält nur eine Art:
- Metapetrocosmea peltata (Merrill & W.Y.Chun) W.T.Wang: Sie gedeiht in Höhenlagen von 300 bis 700 Metern nur in Hainan vor.[1]
- Michaelmoelleria F.Wen, Z.B.Xin & T.V.Do: Sie wurde 2020 aufgestellt und enthält nur eine Art:[19]
- Michaelmoelleria vietnamensis F.Wen, Z.B.Xin & T.V.Do: Sie wurde 2020 erstbeschrieben. Sie wurde bisher nur in einem Lorbeerwald in einer Granitgestein Bergregion in einer Höhenlage von 140 bis 200 Metern im südlichen Vietnam gefunden.[19]
- Microchirita (C.B.Clarke) Y.Z.Wang (Syn.: Chirita sect. Microchirita C.B.Clarke, Roettlera sect. Microchirita (C.B.Clarke) Fritsch, Didymocarpus sect. Microchirita (C.B.Clarke) Chun): Sie hat seit 2011 den Rang einer Gattung.[18][6] Die etwa 39 Arten sind in Indien und vom südlichen China über Indochina bis Südostasien verbreitet.[18]
- Oreocharis Benth. (Syn.: Ancylostemon Craib, Bournea Oliv., Briggsia Craib, Dasydesmus Craib, Dayaoshania W.T.Wang, Deinocheilos W.T.Wang, Isometrum Craib, Opithandra B.L.Burtt, Paraisometrum W.T.Wang, Perantha Craib, Schistolobos W.T.Wang, Thamnocharis W.T.Wang, Tremacron Craib):[6] Die 19 bis 28 Arten sind im südlichen China (27 Arten), Thailand und Vietnam verbreitet.
- Petrocodon Hance (Syn.: Calcareoboea C.Y.Wu, Dolicholoma D.Fang & W.T.Wang, Lagarosolen W.T.Wang, Paralagarosolen Y.G.Wei, Tengia W.Y.Chun): Bis 2011 waren es nur zwei oder drei Arten. 2011 wurden einige Arten einiger Gattung in diese Gattung gestellt: Calcareoboea C.Y.Wu, Dolicholoma D.Fang & W.T.Wang, Lagarosolen W.T.Wang, Paralagarosolen Y.G.Wei, Tengia W.Y.Chun und einige Arten aus der Gattung Didymocarpus.[20] Seitdem kamen weitere Arten hinzu. Die seit 2020 etwa 39 Arten kommen hauptsächlich in China und Indochina vor und gedeihen meist an Standorten des tropischen Karst.[21][22][23][24][25][26][6]
- Petrocosmea Oliv.: Die etwa 30 Arten sind in China (24 Arten), im nordöstlichen Indien, in Myanmar, Thailand und im südlichen Vietnam verbreitet.
- Primulina Hance (Syn.: Chirita sect. Gibbosaccus C.B.Clarke, Chiritopsis W.T.Wang, Deltocheilos W.T.Wang, Wentsaiboea D.Fang & D.H.Qin): Die früher monotypische Gattung enthält seit 2015 über 170 und seit 2019 über 200 Arten, die früher teilweise in Chirita enthalten waren und es wurden in diesem Jahrhundert viele neue Arten beschrieben.[18][27][6] Die meisten Arten kommen in China vor, nur etwa 19 Arten kommen in Vietnam vor. Viele Arten gedeihen nur im tropischen Karst.[28]
- Pseudochirita W.T.Wang: Sie enthält seit 2021 zwei Arten mit zwei Varietäten[1], die im tropischen Karst in Guangxi und nördlichen Vietnam gedeihen.
- Rachunia D.J.Middleton & C.Puglisi: Sie enthält nur eine Art:[29][6]
- Rachunia cymbiformis D.J.Middleton: Sie wurde 2018 aus Thailand erstbeschrieben.[29]
- Raphiocarpus Chun: Sie enthält nur eine Art:
- Raphiocarpus maguanensis Y.M.Shui & W.H.Chen: Dieser Endemit gedeiht im Immergrünen Regenwald in Höhenlagen von etwa 1600 Metern nur in Maguan in Yunnan.[1]
- Ridleyandra A.Weber & B.L.Burtt: 2017 enthält sie 31 Arten von Thailand, über die Malaiischen Halbinsel, dort kommen etwa 23 vor bis Borneo mit etwa fünf Arten.[30]
- Sepikea Schltr. ist vielleicht ein Synonym von Cyrtandra: Sie enthält nur eine Art:
- Subtribus Jerdoniinae A.Weber & Mich.Möller[14] Sie enthält nur eine Gattung:[6]
- Jerdonia Wight: Sie enthält nur eine Art:
- Jerdonia indica Wight: Sie gedeiht auf Felsen in den Nilghiri- und Anamally-Bergen im südwestlichen Indien.
- Jerdonia Wight: Sie enthält nur eine Art:
- Subtribus Leptoboeinae C.B.Clarke[14] Sie enthält etwa sieben Gattungen.[6]
- Beccarinda Kuntze: Die etwa acht Arten sind im nordöstlichen Indien (Assam), Burma, südlichen China & Hainan (fünf Arten), Vietnam (Tonkin) und Sumatra verbreitet.
- Billolivia D.J.Middleton: Sie wurde 2014 aufgestellt. Die etwa 14 Arten kommen nur in Vietnam vor.[6]
- Boeica C.B.Clarke: Die etwa zwölf Arten sind im südlichen China (sieben Arten), in Bhutan, im nördlichen bis nordöstlichen Indien, in Myanmar, im nördlichen Vietnam und auf der nordwestlichen Malaiischen Halbinsel verbreitet.
- Championia Gardn.: Sie enthält nur eine Art:
- Championia reticulata Gardn.: Dieser Endemit kommt nur in Sri Lanka vor.
- Leptoboea Benth.: Die etwa drei Arten sind im nördlichen Indien, Bhutan, Sikkim, Myanmar, Thailand und China verbreitet.
- Middletonia C.Puglisi: Sie wurde 2013 aufgestellt.[6] Es gibt etwa fünf Arten vom östlichen Himalaja über China und Indochina bis zur Malaiischen Halbinsel.
- Ornithoboea Parish ex C.B.Clarke: Die etwa elf Arten sind in China (fünf Arten), Malaysia, östlichen Myanmar, Thailand und Vietnam verbreitet.
- Paraboea (C.B.Clarke) Ridl. s. l. (Syn.: Buxiphyllum W.T.Wang & C.Z.Gao, Chlamydoboea Stapf, Dichiloboea Stapf, Phylloboea Benth., Trisepalum C.B.Clarke):[6] Die früher etwa 87 bis 90, seit 2016 etwa 146 Arten sind in Bhutan, Myanmar, China, Vietnam, Thailand, Malaysia, Indonesien und auf den Philippinen verbreitet.
- Platystemma Wall.: Sie enthält nur eine Art:
- Platystemma violoides Wall.: Sie kommt im nördlichen Indien, Bhutan, Nepal und südlichen Tibet (Nyalam Xian) vor.
- Rhynchotechum Blume: Die etwa 13 Arten sind in Südostasien und auf Pazifischen Inseln verbreitet.
- Subtribus Litostigminae A.Weber & Mich.Möller[14] Sie enthält nur eine Gattun[6]
- Litostigma Y.G.Wei, F.Wen & Mich.Möller: Sie wurde 2010 aufgestellt und enthält nur zwei Arten vom südlichen-zentralen China bis Vietnam.[6]
- Subtribus Loxocarpinae A.DC.[14] Sie enthält 2020 etwa 14 Gattungen:[6]
- Boea Lam.: Die etwa 14 Arten sind im südlichen China, nordöstlichen Indien, nördlichen Thailand, in Vietnam, auf den Philippinen, Sulawesi, Sumbawa, Flores, Neuguinea, den Salomonen, dem Bismarck und Louisiade-Archipel und in Australien verbreitet.
- Damrongia Kerr ex Craib: Sie wurde 2010 reaktiviert und enthält etwa elf Arten, die vom südöstlichen China über Myanmar, Thailand bis Malaysia und Sumatra vorkommen.[18][6]
- Dorcoceras Bunge: Sie wurde 2016/7 reaktiviert.[6] Die etwa sechs Arten kommen von Assam über Indochina bis China und dem zentralen Malesien vor.
- Emarhendia Kiew, A.Weber & B.L.Burtt: Sie wurde 1998 aufgestellt und enthält nur eine Art:
- Emarhendia bettiana (M.R.Hend.) Kiew, A.Weber & B.L.Burtt: Sie kommt nur auf der Malaiischen Halbinsel vor.
- Kaisupeea B.L.Burtt: Sie wurde 2001 aufgestellt. Die etwa drei Arten kommen in Myanmar und Thailand vor.
- Loxocarpus R.Br.: Sie wurde 2013 reaktiviert[6] und enthält etwa 26 Arten im westlichen Malesien.
- Orchadocarpa Ridl.: Sie enthält nur eine Art:
- Orchadocarpa lilacina Ridl.: Sie gedeiht in Bergwälder auf sauren Böden auf der Malaiischen Halbinsel.
- Ornithoboea C.S.P.Parish ex C.B.Clarke (Syn.: Brachiostemon Hand.-Mazz., Lepadanthus Ridl., Sinoboea Chun): Die etwa 17 Arten sind von China bis Indochina verbreitet.
- Rhabdothamnopsis Hemsl.: Sie enthält nur eine Art:
- Rhabdothamnopsis sinensis Hemsl.: Sie gedeiht in Wäldern im tropischen Karst in Höhenlagen von 1600 bis 4600 Metern im westlichen Guizhou, westlichen bis südwestlichen Sichuan und zentralen bis nördlichen Yunnan.[1]
- Somrania D.J.Middleton: Sie wurde 2012/3 aufgestellt[6] und enthält nur drei Arten nur in Thailand.
- Senyumia Kiew, A.Weber & B.L.Burtt: Sie wurde 1998 aufgestellt. Die beiden Arten kommen nur auf der Malaiischen Halbinsel vor.
- Spelaeanthus Kiew, A.Weber & B.L.Burtt: Sie wurde 1998 aufgestellt und enthält nur eine Art:
- Spelaeanthus chinii Kiew, A.Weber & B.L.Burtt: Sie kommt nur auf der Malaiischen Halbinsel vor.
- Subtribus Ramondinae DC. ex Meisn.[14] Sie enthält die in Europa vorkommenden zwei bis drei Gattungen mit insgesamt fünf bis sechs Arten:[6]
- Haberlea Friv.: Die je nach Autor eine (Petrova et al. 2014) oder zwei Arten sind in Europa beheimatet. Diese Gattung ist ein Relikt aus Zeiten, in denen in Europa tropisches Klima herrschte.
- Jancaea Boiss.: Sie enthält nur eine Art:
- Jancaea heldreichii (Boiss.) Boiss.: Dieser Endemit kommt nur auf dem Olymp in Thessalien, Griechenland vor. Er gedeiht an schattigen und feuchten Felsspalten im Kalkstein in Höhenlagen von (100 bis) meist 1000 bis 2100 Metern.
- Felsenteller (Ramonda Rich.): Die nur drei Arten kommen in Spanien und auf der Balkanhalbinsel vor.
- Subtribus Streptocarpinae Ivanina[14] Sie enthält nur eine Gattung:[6]
- Drehfrucht (Streptocarpus Lindl. s l. (nach Nishii et al. 2015), Syn.: Acanthonema Hook. f., Carolofritschia Engl., Colpogyne B.L.Burtt, Hovanella A.Weber & B.L.Burtt, Linnaeopsis Engl., Nodonema B.L.Burtt, Saintpaulia H.Wendl., Schizoboea (Fritsch) B.L.Burtt, Trachystigma C.B.Clarke):[6] Die seit Nishii et al. 2015 etwa 180 Arten in zwei Untergattungen sind hauptsächlich im tropischen und südöstlichen Afrika, Madagaskar und Komoren verbreitet. Es wird kontrovers diskutiert ob diese weite Auffassung dieser Gattung das richtige Konzept ist oder ob sie in viele kleinere Gattungen aufzuteilen ist.[6]
- Subtribus Tetraphyllinae A.Weber & Mich.Möller[14] Sie enthält nur eine Gattung:[6]
- Tetraphyllum Griff. ex C.B.Clarke: Von den drei Arten kommt eine nur in Vietnam vor und eine wohl nur im nordöstlichen Indien vor, weitere Fundortangaben gibt es für Bangladesbh, Myanmar sowie Thailand.[6]
- Subtribus Corallodiscinae A.Weber & Mich.Möller[14] Sie enthält nur eine Gattung:[6]
- Tribus Titanotricheae W.T.Wang:
- Sie enthält nur eine monotypische Gattung:[6]
- Titanotrichum Soler.: Sie enthält nur eine Art:
- Titanotrichum oldhamii (Hemsl.) Soler.: Sie kommt von Fujian und Taiwan über die Ryūkyū-Inseln bis auf weiteren japanischen Inseln vor.
- Titanotrichum Soler.: Sie enthält nur eine Art:
- Sie enthält nur eine monotypische Gattung:[6]
- Gattungshybriden
Gefährdung
In der Roten Liste der gefährdeten Arten der IUCN sind im Jahr 2013 152 Arten der Familie der Gesneriaceae eingetragen.[31] Es werden aber beispielsweise in Australien und Südafrika nationale Rote Listen geführt, deren Arten nicht bei der IUCN eingetragen werden. Es sind also viel mehr Arten gefährdet.
Quellen
- Die Familie Gesneriaceae bei der APWebsite. (Abschnitte Systematik und Beschreibung)
- Die Familie Gesneriaceae bei DELTA von L. Watson & M. J. Dallwitz. (Abschnitt Beschreibung)
- Anton Weber, Laurence E. Skog: The Genera of Gesneriaceae: Umfassende Webseite zur Familie der Gesneriaceae, 2. Auflage, ab 2007 laufend weiterbearbeitet, Institute of Botany, University of Vienna, Austria & Department of Systematic Biology, Botany, Smithsonian Institution, Washington D.C., USA. (Abschnitt Systematik)
- Anton Weber: Gesneriaceae. In: Joachim W. Kadereit (Hrsg.): The Families and Genera of Vascular Plants. Volume 7: Flowering plants, Dicotyledons. Lamiales (except Acanthaceae including Avicenniaceae). Springer, Berlin/Heidelberg/New York 2004, ISBN 3-540-40593-3, S. 63–158 (englisch, eingeschränkte Vorschau in der Google-Buchsuche). (Abschnitt Systematik und Beschreibung)
- Wencai Wang, Kai-yu Pan, Zhen-yu Li, Anna L. Weitzman, Laurence E. Skog: In: Wu Zheng-yi, Peter H. Raven (Hrsg.): Flora of China. Volume 18: Scrophulariaceae through Gesneriaceae. Science Press und Missouri Botanical Garden Press, Beijing und St. Louis 1998, ISBN 0-915279-55-X. Gesneriaceae., S. 244 - textgleich online wie gedrucktes Werk. (Abschnitte Systematik und Beschreibung)
- A. Chautems, 2009: Neotropical Gesneriaceae bei Neotropikey - Interactive key and information resources for flowering plants of the Neotropics. (Abschnitte Beschreibung und Systematik)
- Ron Myhr: The Gesneriad Reference Web.
- Laurence E. Skog, John K. Boggan: A new classification of the western hemisphere Gesneriaceae. In: Gesneriads, Volume 56, Issue 3, 2006, S. 12–19.
Einzelnachweise
- Wencai Wang, Kai-yu Pan, Zhen-yu Li, Anna L. Weitzman, Laurence E. Skog: Gesneriaceae. - textgleich online wie gedrucktes Werk, In: Wu Zheng-yi, Peter H. Raven (Hrsg.): Flora of China. Volume 18: Scrophulariaceae through Gesneriaceae. Science Press/Missouri Botanical Garden Press, Beijing/St. Louis 1998, ISBN 0-915279-55-X, S. 244 (englisch).
- Die Familie Gesneriaceae bei DELTA von L. Watson & M. J. Dallwitz.
- Anton Weber: Gesneriaceae: A Scientific Perspective
- A. Chautems, 2009: Neotropical Gesneriaceae bei Neotropikey - Interactive key and information resources for flowering plants of the Neotropics.
- Conandron ramondioides bei Plants For A Future
- Anton Weber, David John Middleton, John Littner Clark: Keys to the infrafamilial taxa and genera of Gesneriaceae. In: Rheedia: Journal of the Indian Association for Angiosperm Taxonomy, Volume 30, Issue 1, 2020, S. 05–47. doi:10.22244/rheedea.2020.30.01.02 Volltext-PDF.
- Z. Xi, Y. Z. Wang, James F. Smith: Familial placement and relations of Rehmannia and Triaenophora (Scrophulariaceae s.l.) inferred from five gene regions. In: American Journal of Botany, Volume 96, 2009, S. 519–530. doi:10.3732/ajb.0800195
- Zhi Xia, Yin-Zheng Wang, James F. Smith: Familial placement and relations of Rehmannia and Triaenophora (Scrophulariaceae s.l.) inferred from five gene regions. In: American Journal of Botany, Volume 96, 2009, S. 519–530: doi:10.3732/ajb.0800195
- Anton Weber: Gesneriaceae. In: Joachim W. Kadereit (Hrsg.): The Families and Genera of Vascular Plants. Volume 7: Flowering plants, Dicotyledons. Lamiales (except Acanthaceae including Avicenniaceae). Springer, Berlin/Heidelberg/New York 2004, ISBN 3-540-40593-3, S. 63–158 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- Anton Weber & Laurence E. Skog, 2007: Umfassende Webseite zur Familie der Gesneriaceae, da die Navigation der Hauptseite mindestens unter Firefox nicht funktioniert: Gattungs-Navigation.
- E. H. Roalson, John L. Clark: Phylogenetic patterns of diversification in the Beslerieae (Gesneriaceae), S. 251–268. In: A. K. Sharma, A. Sharma (Herausgeber): Plant Genome: Biodiversity and Evolution, Phanerograms 1C, Science Publishers, Enfield, New Hampshire, 2006.
- J. K. Boggan, L. E. Skog, E. A. Zimmer: Untangling Gloxinieae (Gesneriaceae). I. Phylogenetic patterns and generic boundaries inferred from nuclear, chloroplast, and morphological cladistic data sets. In: Taxon, Band 54, Nr. 2, 2005, S. 389–410.
- The classification of Gesneriaceae bei Gesneriaceae Resource Centre = GRC.
- Anton Weber, John Littner Clark, Michael Möller: A new formal classification of Gesneriaceae. In: Selbyana, Volume 31, Issue 2: Special Issue: Proceedings of the World Gesneriad Research Conference 2010, Marie Selby Botanical Gardens Inc., 2013, S. 68–94. JSTOR 24894283 PDF.
- John L. Clark, David A. Neill, Anton Weber, Jennifer A. Gruhn, Tuntiak Katan: Shuaria (Gesneriaceae), an Arborescent New Genus from the Cordillera del Cóndor and Amazonian Ecuador. In: Systematic Botany, Volume 35, Issue 3, 2010, S. 662–674: doi:10.1600/036364410792495917 bei BioOne.
- Jérémie Morel, Jérôme Duminil and Jérôme Munzinger: Bopopia, A New Monotypic Genus of Gesneriaceae (Gesnerioideae, Coronanthereae) from New Caledonia. In: European Journal of Taxonomy, Volume 736, Issue 1, 2021, S. 82–101. DOI:10.5852/ejt.2021.736.1253
- David John Middleton, H. Atkins, L. H. Truong, K. Nishii, Michael Möller: Billolivia, a new genus of Gesneriaceae from Vietnam with five new species. In: Phytotaxa, Volume 161, 2014, S. 241–269. doi:10.11646/phytotaxa.161.4.1
- Anton Weber, David John Middleton, Alan Forrest, Ruth Kiew, Chung Lu Lim, Rafidah Abdul Rahman, Susanne Sontag, Pramote Triboun, Yi-Gang Wei, Tze Leong Yao, Michael Moeller: Molecular systematics and remodelling of Chirita and associated genera (Gesneriaceae). In: Taxon, Volume 60, Issue 3, 2011, S. 767-790. doi:10.1002/tax.603012
- Fang Wen, Zi-Bing Xin, Long-Fei Fu, Shu Li, Lan-Ying Su, Stephen Maciejewski, Zhang-Jie Huang, Truong Van Do, Yi-Gang Wei: Michaelmoelleria (Gesneriaceae), a new lithophilous dwelling genus and species with zigzag corolla tube from southern Vietnam. In: PhytoKeys, Volume 146, Mai 2020, S. 89–107. doi:10.3897/phytokeys.146.49731
- Anton Weber, Yi-Gang Wei, Carmen Puglisi, Fang Wen, Veronika Mayer, Michael Möller: A new definition of the genus Petrocodon (Gesneriaceae). In: Phytotaxa, Volume 23, Issue 1, 2011, S. 49–67. doi:10.11646/phytotaxa.23.1.3
- Xin Hong, S. B. Zhou, Fang Wen: Petrocodon villosus (Gesneriaceae), a new species from Guangxi, China. In: Blumea, Volume 59, Issue 1, 2014, S. 33–36. doi:10.3767/000651914X682378
- W. H. Chen, M. Möller, Y. M. Shui, H. Wang, J. B. Yang, G. Y. Li: Three new species of Petrocodon (Gesneriaceae), endemic to the limestone areas of Southwest China, and preliminary insights into the diversification patterns of the genus. In: Systematic Botany, Volume 39, Issue 1, 2014, S. 316–330. doi:10.1600/036364414X678189
- J. Guo, T. Meng, H. Pang, Q. Zhang: Petrocodon retroflexus sp. nov. (Gesneriaceae) from a karst cave in Guizhou, China. In: Nordic Journal of Botany, Volume 34, Issue 2, 2016, S. 159–164. doi:10.1111/njb.00941
- H. F. Cen, L. F. Fu, Fang Wen: Petrocodon urceolatus sp. nov. (Gesneriaceae) from Zhangjiajie city, northwestern Hunan Province, China. In: Nordic Journal of Botany, Volume 35, Issue 3, 2017, S. 334–338. doi:10.1111/njb.01333
- L. Chen, W. H. Chen, S. W. Guo, Fang Wen, Y. M. Shui: Petrocodon tenuitubus (Gesneriaceae), a new species from Southeast Yunnan, China. In: Guihaia, Volume 39, Issue 5, 2019, S. 574–580.
- Rui-Li Zhang, Shu Li, Stephen Maciejewski, Yi-Gang Wei: Petrocodon rubiginosus, a new species of Gesneriaceae from Guangxi, China. In: PhytoKeys, Volume 157, August 2020, S. 175–181. doi:10.3897/phytokeys.157.32270
- B. Ai, Y. Gao, X. Zhang, J. Tao, M. Kang, H. Huang: Comparative transcriptomeresources of eleven Primulina species, a group of ‘stone plants’ from a biodiversityhot spot. In: Molecular Ecology Resources, Volume 15, 2015, S. 619–632 doi:10.1111/1755-0998.12333
- Xin Hong, Jeremy Keene, Zhi-Jing Qiu, Fang Wen: Primulina anisocymosa (Gesneriaceae), a new species with a unique inflorescence structure from Guangdong, China. In: PeerJ., Januar 2019, 7, e6157. doi:10.7717/peerj.6157
- David John Middleton, Gillian Khew, Manop Poopath, Michael Moeller: Rachunia cymbiformis, a new genus and species of Gesneriaceae from Thailand. In: Nordic Journal of Botany, Volume 36, Issue 11, November 2018, e01992. doi:10.1111/njb.01992
- Mat Yunoh Siti Munirah, Zaharil Dzulkafly: Ridleyandra merohmerea (Gesneriaceae), a new species from Kelantan, Peninsular Malaysia. In: PhytoKeys, Volume 89, 2017, S. 1-10. doi:10.3897/phytokeys.89.20344
- Suche nach „Gesneriaceae“ in der Roten Liste gefährdeter Arten der IUCN.
Weblinks
- American Gloxinia and Gesneriad Society - Amerikanische Gesneriaceen-Gesellschaft. (englisch)
- James F. Smith, 20. April 1998: Gesneriaceae beim The Tree of Life Web Project.
- Gesneriaceae bei PacificBulbSociety.
Weiterführende Literatur
- Laurence E. Skog: Gesneriaceae in the 21st Century. In: Selbyana, Volume 25, Issue 2, 2005, S. 179–181. JSTOR 41760462
- Z. Xu, B. L. Burtt, L. E. Skog, David John Middleton: A revision of Paraboea. In: Edinburgh Journal of Botany, Volume 65, Issue 2, 2008, S. 161–347. doi:10.1017/S0960428608005106
- E. H. Roalson, L. E. Skog, E. A. Zimmer: Untangling Gloxinieae (Gesneriaceae). II. Reconstructing biogeographic patterns and estimating divergence times among New World continental and island lineages. In: Systematic Botany, Volume 33, Issue 1, 2008, S. 159–175. doi:10.1600/036364408783887429
- Michael Möller, M. Pfosser, C. G. Jang, V. Mayer, A. Clark, M. L. Hollingsworth, M. H. J. Barfuss, Y. Z. Wang, M. Kiehn, Anton Weber: A preliminary phylogeny of the ‘Didymocarpoid Gesneriaceae’ based on three molecular data sets: incongruence with available tribal classifications. In: American Journal of Botany, Volume 96, 2009, S. 989–1010. doi:10.3732/ajb.0800291
- Y. G. Wei, Fang Wen, W. H. Chen, Y. M. Shui, Michael Möller: Litostigma, a new genus from China: a morphological link between basal and derived didymocarpoid Gesneriaceae. In: Edinburgh Journal of Botany, Volume 67, Issue 1, 2010, S. 161–184. doi:10.1017/S0960428609990291
- Michael Möller, A. Forrest, Y. G. Wei, Anton Weber: A molecular phylogenetic assessment ofthe advanced Asiatic and Malesian Didymocarpoid Gesneriaceae with focus on non-monophyletic and monotypic genera. In: Plant Systematics and Evolution, Volume 292, 2011, S. 223–248. doi:10.1007/s00606-010-0413-z
- Vincent L. Woo, Minde M. Funke, James F. Smith, Peter J. Lockhart, Philip J. Garnock-Jones: New World Origins of Southwest Pacific Gesneriaceae: Multiple Movements Across and Within the South Pacific, In: International Journal of Plant Sciences, Volume 172, Issue 3, 2011, S. 434–457: Online bei JSTOR.
- John L. Clark, Minde M. Funke, Aaron M. Duffy, James F. Smith: Phylogeny of a Neotropical Clade in the Gesneriaceae: More Tales of Convergent Evolution, In: International Journal of Plant Sciences, Volume 173, Issue 8, 2012, S. 894–916: doi:10.1086/667229
- David John Middleton, Michael Möller: Tribounia, a new genus of Gesneriaceae from Thailand. In: Taxon, Volume 61, Issue 6, 2012, S. 1286–1295.
- Mathieu Perret, Alain Chautems, Andréa Onofre De Araujo, Nicolas Salamin: Temporal and spatial origin of Gesneriaceae in the New World inferred from plastid DNA sequences. In: Botanical Journal of the Linnean Society, Volume 171, Issue 1, 2013, S. 61–79. doi:10.1111/j.1095-8339.2012.01303.x
- David Middleton, Hannah Atkins, Luu Hong Truong, Kanae Nishii, Michael Möller: Billolivia, a new genus of Gesneriaceae from Vietnam with five new species. In: Phytotaxa, Volume 161, Issue 4, 2014: doi:10.11646/phytotaxa.161.4.1
- S. M. Scott, David John Middleton: A revision of Ornithoboea (Gesneriaceae). In: Gardens’ Bulletin Singapore, Volume 66, Issue 1, 2014, S. 73–119.
- David John Middleton, Kanae Nishii, Carmen Puglisi, Laura L. Forrest, Michael Möller: Chayamaritia, (Gesneriaceae: Didymocarpoideae), a new genus from Southeast Asia. In: Plant Systematics and Evolution, Volume 301, 2015, S. 1–20. doi:10.1007/s00606-015-1213-2
- X. L. Yu, M. Li, J.J. Zhou, P. W. Li: Petrocodon hunanensis (Gesneriaceae), a new species identified by both morphological and molecular evidence from limestone area in Hunan, China. In: Phytotaxa, Volume 195, 2015, S. 65–72. doi:10.11646/phytotaxa.195.1.4
- Michael Möller, Y. G. Wei, Fang Wen, John L. Clark, Anton Weber: You win some you lose some: updated generic delineations and classification of Gesneriaceae—implications forthe family in China. In: Guihaia, Volume 36, 2016, S. 44–60.
- A. P. Janeesha, Michael Möller, Santhosh Nampy, Anton Weber: The Gesneriaceae of India: Consequences of updated generic concepts and new family classification. In: Rheedea, Volume 27, Issue 1, Juni 2017, S. 23-41. doi:10.22244/rheedea.2017.27.1.5
- M. L. Serrano-Serrano, J. Rolland, J. L. Clark, N. Salimin, M. Perret: Hummingbird pollination and the diversification of angiosperms: an old and successful association in Gesneriaceae. In: Proceedings of the Royal Society, Botany, Volume 284, 2017, 20162816. doi:10.1098/rspb.2016.2816
- W. B. Xu, J. Guo, B. Pan, Q. Zhang, Y. Liu: Diversity and distribution of Gesneriaceae in China. In: Guihaia, Volume 37, 2017, S. 1219–1226. doi:10.11931/guihaia.gxzw201707004 (in Chinesisch)
- Li-Hua Yang, Chen Feng, Mei-Zhen Xu, Zhi-Xia Sun, Ming Kang: Synopsis of Cytological Studies on Didymocarpoideae (Gesneriaceae) under New Classification System. In: Journal of Tropical and Subtropical Botany (Redai Yaredai Zhiwu Xuebao), Volume 27, Issue 5, 2019, S. 548–557.
- Fang Wen, S. Li, Z. Xin, L. F. Fu, X. Hong, L. Cai, J. Q. Qin, B. Pan, F. Z. Pan, Y. G. Wei: The updated plant list of Gesneriaceae in China under the new Chinese naming rules. In: Guangxi Sciences, Volume 26, Issue 1, 2019, S. 37–63. doi:10.13656/j.cnki.gxkx.20190225.002
- R. B. Zhang, T. Deng, L. F. Fu, S. Li, L. He, T. Deng, Q. L. Dou, Fang Wen: Petrocodon tongziensis (Gesneriaceae), a new species from limestone areas in Guizhou, China based on morphological and molecular evidence. In: Nordic Journal of Botany, c01774, 2019, S. 1–7. doi:10.1111/njb.01774
- S. Sirimongkol, J. A. N. Parnell, T. R. Hodkinson, David John Middleton, C. Puglisi: Five new species of Henckelia (Gesneriaceae) from Myanmar and Thailand. In: Thai Forest Bulletin, Botany, Volume 47, Issue 1, 2019, S. 38–54. doi:0.20531/tfb.2019.47.1.08
- Ke Tan, Tao Lu, Ming-Xun Ren: Biogeography and evolution of Asian Gesneriaceae based on updated taxonomy. In: Y-M. Shui, W-H. Chen, Ming-Xun Ren, Fang Wen, X. Hong, Z-J. Qiu, Y-G. Wei, M. Kang (Hrsg.): Taxonomy of Gesneriaceae in China and Vietnam. In: PhytoKeys, Volume 157, August 2020, S. 7–26. doi:10.3897/phytokeys.157.34032
- Ke Tan, Tao Lu, Ming-Xun Ren: Gesneriaceae in China and Vietnam: Perfection of taxonomy based on comprehensive morphological and molecular evidence. In: Y-M. Shui, W-H. Chen, Ming-Xun Ren, Fang Wen, X. Hong, Z-J. Qiu, Y-G. Wei, M. Kang (Hrsg.): Taxonomy of Gesneriaceae in China and Vietnam. In: PhytoKeys, Volume 157, August 2020, S. 7–26. doi:10.3897/phytokeys.157.34032