Samenanlage
Die Samenanlage (Ovulum) ist das weibliche Fortpflanzungsorgan der Samenpflanzen. Sie befindet sich bei den Bedecktsamern im Fruchtknoten, bei den Nacktsamern auf der Samenschuppe. Aus ihr entwickelt sich nach der Befruchtung der Same.
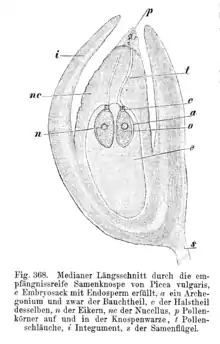
Forschungsgeschichte
Die Samenanlage wurde erstmals von Nehemiah Grew (1671) beschrieben. Grew entdeckte ein kleines Loch in der Hülle der Samenanlage, das ihn an das Spundloch von Bier- und Weinfässern erinnerte. Er nahm an, dass es ebenso dem Hindurchtreten von Luft bei einer Gärung diene. Erst 1806 schrieb Pierre Jean François Turpin dieser „Mikropyle“ korrekterweise eine Funktion bei der Befruchtung zu. Das Innere der Samenanlage erschien lange Zeit als ein homogenes Gewebe, das von einer oder mehreren Hüllen umgeben ist. 1888 beschrieb Eduard Strasburger als Erster die Reduktion der Chromosomenzahl (Meiose) bei Zellen in der Samenanlage.[1]
Stellung im Fruchtknoten
Je nach ihrer Orientierung im Fruchtknoten unterscheidet man bei Bedecktsamern aufrechte, hängende und waagrechte Samenanlagen.
 Aufrechte Samenanlagen
Aufrechte Samenanlagen Hängende Samenanlage
Hängende Samenanlage Waagrechte, horizontale Samenanlage
Waagrechte, horizontale Samenanlage
Mittelstellungen zwischen aufrecht und horizontal werden als aufsteigend, zwischen horizontal und hängend als absteigend bezeichnet.
Aufbau
Die Samenanlagen liegen bei den Nacktsamern frei; bei den Bedecktsamern sind sie im Fruchtknoten eingeschlossen.
Mit dem Stiel (Funiculus) ist die Samenanlage an der Plazenta am Fruchtblatt befestigt. Sie besitzt meist ein oder zwei (selten drei) Hüllen, die Integumente. Je nach der Anzahl der Hüllen spricht man von unitegmischen, bitegmischen oder tritegmischen Samenanlagen. Nacktsamer besitzen grundsätzlich nur ein Integument, die meisten Bedecktsamer zwei. Die Integumente umschließen das eigentliche Megasporangium, den Nucellus. Ontogenetisch wird zuerst der Nucellus gebildet. Anschließend wachsen von unten die Integumente am Nucellus empor. Bei bitegmischen Arten entsteht das innere vor dem äußeren. Bei den Bedecktsamern, die primär bitegmisch sind, kann die seltenere Form einer unitegmischen Samenanlage auf mehreren Wegen entstehen:
- Eines der beiden Integumente stellt frühzeitig das Wachstum ein.
- Es wächst die Basis der Integumente durch interkalares Wachstum hoch, sodass nur mehr die Spitze aus zwei Integumenten besteht, dies aber nicht mehr deutlich ersichtlich ist.
- Es bildet sich von Anfang an nur ein Integument.
Bei einigen parasitischen Pflanzen fehlen die Integumente ganz, etwa bei den Loranthaceae.
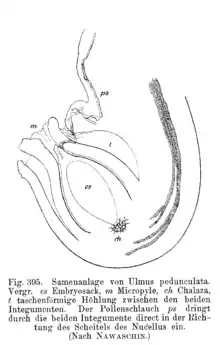
Die Stelle, an welcher die Samenanlage mit dem Funiculus in Verbindung steht, heißt (äußerer) Nabel oder Hilum. Die Übergangszone zwischen Funiculus und Nucellus heißt Chalaza. An der der Chalaza gegenüberliegenden Seite, wo die Integumente aneinanderstoßen, lassen sie eine Öffnung frei, die Mikropyle.
Die oft langgestreckte Verwachsungsstelle von Samenanlage und Funiculus wird Raphe genannt (griechisch endbetont ραφή ‚Naht‘) und ist bei Samen aus gegenläufigen Samenanlagen auffallend, sie kann dorsal oder ventral ansetzen. Wucherungen (Elaiosome, Arillode) der Raphe werden als Strophiole (Keimwarze), Auswüchse der Samenschale an der Mikropyle als Caruncula bezeichnet, beide gewöhnlich ebenfalls als „Samenschwiele“.[2] Als Obturator bezeichnet man eine Struktur, die den Eintritt des Pollenschlauchs in die Eizelle erleichtert. Morphologisch entsteht er meist in der Plazenta oder dem Funiculus und wächst zur Mikropyle.[3]
Ausbildung des Nucellus
Je nach der Lage der Megasporenmutterzelle werden folgende Formen von Samenanlagen unterschieden:
- crassinucellat: Hier ist der Nucellus kräftig entwickelt. Die Megasporenmutterzelle ist durch mindestens eine Zelle, die Parietal- oder Deckzelle, von der Epidermis getrennt. Die Menge des seitlich und apikal gelegenen Gewebes ist sehr unterschiedlich. Nach einer anderen Definition ist es einen Samenanlage, bei der die Archesporzelle eine primäre Wandzelle, die parietale Zelle, bildet. Dadurch liegt die Megasporenmutterzelle nicht subepidermal.
- tenuinucellat: Der Nucellus ist sehr schwach ausgeprägt und zur Zeit der Befruchtung meist geschwunden. Die Megasporenmutterzelle liegt am apikalen Pol des Nucellus subepidermal. Der Embryosack liegt dann apikal und ist nur von der Epidermis des Nucellus umschlossen.
- pseudocrassinucellat: Hier gibt die Megasporenmutterzelle keine parietale Zelle ab. Die apikale Zelle der Epidermis teilt sich periklin, wodurch eine Nucellarkappe entsteht.
Bei Samenpflanzen, die durch Spermatozoiden befruchtet werden (Cycadophyta, Ginkgophyta), befindet sich am apikalen Ende des Nucellus eine Vertiefung, die „Pollenkammer“ heißt.
Orientierung der Samenanlage
.svg.png.webp)
Nach der Orientierung der Längsachse werden die Samenanlagen folgendermaßen eingeteilt:[4]
- Bei atropen oder orthotropen Samenanlagen befinden sich Funiculus und Mikropyle auf einer Geraden, der Nucellus ist nicht gekrümmt.
- Bei anatropen Samenanlagen ist der Bereich von Chalaza, Integumenten und Nucellus um 180° gekrümmt, gegenläufig und die Mikropyle kommt neben dem Funiculus zu liegen. Der Nucellus selbst ist gerade.
- K(C)ampylo-, k(c)amptotrope Samenanlagen (nach der Vaskulatur; ana- oder ortho-) nehmen eine Zwischenstellung ein, hier ist der Nucellus deutlich gekrümmt, krummläufig. Die Mikropyle liegt neben dem Funiculus. In einigen Fällen ist die Krümmung nicht so groß das die Mikropyle neben den Funiculus zu liegen kommt, dies bezeichnet man als semikampylotrop.
- Bei amphitropen Samenanlagen (nach der Vaskulatur; ana- oder ortho-) erfasst die Krümmung auch den Embryosack.
- Hemitrop, hemi-, semianatrop; wenn die Nucellusachse gerade und gegen den Funiculus um 90° gedreht ist, halbumgewendet.
- Circinotrop (nach der Vaskulatur; ana- oder ortho-); dabei ist der Funiculus spiralig um die Samenanlage gewickelt und täuscht ein drittes Integument vor, das gar nicht existiert.
- Hypertrop; hier sind die hemitropen Samenanlagen umgewendet und stehen gegen den Funiculus um 90° gedreht.
- Heterotrop; wenn die Ovula sehr zahlreich sind, geschieht es nicht selten, dass ihre Lage variabel ist.
Bei gegen- und krummläufigen Samenanlagen wird weiter unterschieden, ob die Mikropyle zum Grund; apo-, hypotrop, der Spitze; epitrop oder den Flanken; pleurotrop zugekehrt ist. Moderner wird die verschiedene Orientierungen der gebogenen Ovula in Bezug auf die Karpellkrümmung unterschieden; syntropisch (in der gleichen Richtung) und antitropisch (in der entgegengesetzten Richtung).[5]
Bei den Bedecktsamern gelten anatrope, crassinucellate Samenanlagen mit zwei Integumenten als ursprünglich.
Meiose
Im Nucellus entsteht am apikalen Pol eine Megasporenmutterzelle, die hier Embryosackmutterzelle heißt. Durch Meiose entstehen aus dieser diploiden Zelle vier haploide Zellen, die Megasporen, von denen meistens nur eine als Embryosackzelle sich weiterentwickelt, während die übrigen zugrunde gehen. Meist sind sie linear angeordnet, seltener T-förmig. Die Megasporen der Nacktsamer besitzen eine Zellwand mit Sporopollenin, nicht jedoch die der Bedecktsamer.
Gametophyt
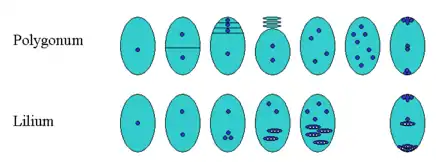
Der weibliche Gametophyt wird bei den Samenpflanzen Embryosack genannt. An seiner Bildung ist meist nur eine Megaspore beteiligt. Man spricht dann von einem monosporen Embryosack. Hier entwickelt sich meist die zuinnerst liegende Megaspore, seltener die äußere. Selten sind zwei Zellen (bisporer Embryosack), wie bei einigen Bedecktsamern, oder auch alle vier (tetrasporer Embryosack) beteiligt, so bei Gnetum, Welwitschia und einigen Bedecktsamern.
Bei den Nacktsamern ist der Gametophyt recht deutlich ausgebildet und ähnelt dem Prothallium der Farne. Bei allen Gruppen mit Ausnahme von Gnetum, Welwitschia und den Bedecktsamern bildet der Embryosack am apikalen Pol Archegonien, die weiblichen Fortpflanzungsorgane. Ginkgo bildet zwei oder drei Archegonien pro Samenanlage, Koniferen bis zu 60 und Microcycas calocoma bis zu 100. Ein Archegonium besteht aus einer Eizelle, die bis zu sechs Millimeter groß sein kann (Cycadopsida) und aus einer unterschiedlich großen Zahl von Halswandzellen. Halskanalzellen fehlen immer, manchmal ist eine Bauchkanalzelle oder zumindest ein Bauchkanalkern ausgebildet. Bei den Bedecktsamern ist der Gametophyt zu einem meist achtkernigen Embryosack reduziert.
Bedecktsamer
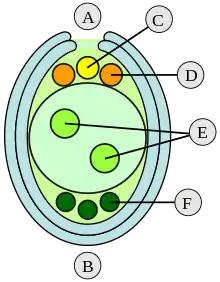
A Mikropyle B Integument C Eizelle D Synergiden E Polkerne F Antipoden
Bei den Bedecktsamern teilt sich der Kern der Megaspore in den meisten Fällen in drei freien Kernteilungen in zwei, vier und endlich acht Zellkerne. Je drei dieser Kerne wandern zum oberen beziehungsweise unteren Ende des Embryosackes. Dort umgeben sie sich mit eigenem Plasma, dann eigener Zellmembran und schließlich einer dünnen Zellwand. Die drei oberen Zellen bilden den Eiapparat. Die mittlere der drei ist die deutlich größere Eizelle (Gynogamet, Oosphere), die anderen die beiden Synergiden (Hilfszellen). Möglicherweise sind die beiden Synergiden den Halskanalzellen eines Archegoniums homolog. Die drei unteren Zellen sind die „Antipoden“.
Die zwei mittleren Zellkerne grenzen sich nicht vom Embryosackplasma ab und werden „Polkerne“ genannt. Sie verschmelzen zum sekundären Embryosackkern, der damit diploid ist. Dies geschieht vor oder nach dem Eindringen des Pollenschlauchs.
Von diesem Entwicklungstypus gibt es zahlreiche Abweichungen, je nachdem, ob ein, zwei oder alle vier Megasporen am Aufbau des Embryosacks beteiligt sind, sowie auch, wie der Embryosack weiter aufgebaut ist. Diese Typen werden nach der Gattung, bei der sie erstmals beschrieben wurden, bezeichnet.
Siehe auch
Literatur
- Wolfram Braune, Alfred Leman, Hans Taubert: Pflanzenanatomisches Praktikum II. Zur Einführung in den Bau, die Fortpflanzung und Ontogenie der niederen Pflanzen (auch der Bakterien und Pilze) und die Embryologie der Spermatophyta. 3. überarbeitete Auflage. Gustav Fischer, Jena 1990, ISBN 3-334-00301-9.
- Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. Begründet von Eduard Strasburger. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1010-X, S. 765–768.
- Gerhard Wagenitz: Wörterbuch der Botanik. Die Termini in ihrem historischen Zusammenhang. 2. erweiterte Auflage. Spektrum Akademischer Verlag, Heidelberg / Berlin 2003, ISBN 3-8274-1398-2.
Weblinks
- Rasterelektronenmikroskopische Aufnahmen der Samenanlagen von Epiphyllum phyllanthus auf biologie.uni-hamburg.de.
Einzelnachweise
- B.M. Johri (Hg.): Embryology of Angiosperms. Springer, Berlin/Heidelberg/New York/Tokyo 1984, ISBN 978-3-642-69304-5, S. 123–125.
- Sylvia R. Silveira, Marcelo C. Dornelas und Adriana P. Martinelli: Perspectives for a Framework to Understand Aril Initiation and Development. In: Front. Plant Sci. 7, 2016, S. 1919, doi:10.3389/fpls.2016.01919.
- Kleber Del Claro, Paulo S. Oliveira, Victor Rico-Gray: Tropical Biology and Conservation Management. Volume I: Natural History of Tropical Plants, EOLSS, 2009, ISBN 978-1-84826-722-0, S. 63.
- B. M. Johri u. a.: Comparative Embryology of Angiosperms. Vol. 1, Springer, 1992, ISBN 978-3-642-76397-7, S. 21, 97–100.
- Peter K. Endress: Angiosperm ovules: diversity, development, evolution. In: Annals of Botany. Volume 107, Issue 9, 2011, S. 1465–1489, doi:10.1093/aob/mcr120.