Tischtschenko-Reaktion
Die Tischtschenko-Reaktion oder Claisen-Tischtschenko-Reaktion ist nach den Chemikern Ludwig Claisen (1851–1930) und Wjatscheslaw Jewgenjewitsch Tischtschenko (1861–1941) benannt.
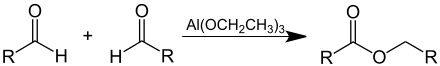
Normalerweise werden Carbonsäureester aus Carbonsäuren und Alkoholen durch saure Katalyse hergestellt. Es geht aber auch anders: Steht ein Aldehyd zur Verfügung, können Ester auch durch die Claisen-Tischtschenko-Reaktion in einer Umlagerungsreaktion mit Aluminiumalkoholat als Katalysator hergestellt werden. Bei nicht enolisierbaren Aldehyden kann statt eines Aluminiumalkoholats auch ein Natriumalkoholat eingesetzt werden. Großtechnisch wird auf diese Weise Essigsäureethylester aus Acetaldehyd mit Aluminiumtriethanolat als Katalysator hergestellt.
Wenn man statt von einem Aldehyd von einem Gemisch mehrere Aldehyde ausgeht, entstehen in der Regel komplexe Gemische verschiedener Ester, die aufwändig getrennt werden müssen.
Die Reaktion muss im Gegensatz zur Cannizzaro-Reaktion, bei der aus dem Aldehyd entsprechend Carbonsäure und Alkohol entstehen, zwingend in wasser- und alkoholfreiem Medium erfolgen.
Eine Tandem-Reaktion aus einer Aldol-Reaktion und einer Claisen-Tischtschenko-Reaktion wird als Aldol-Tischtschenko-Reaktion bezeichnet.
Mögliche Nebenreaktion
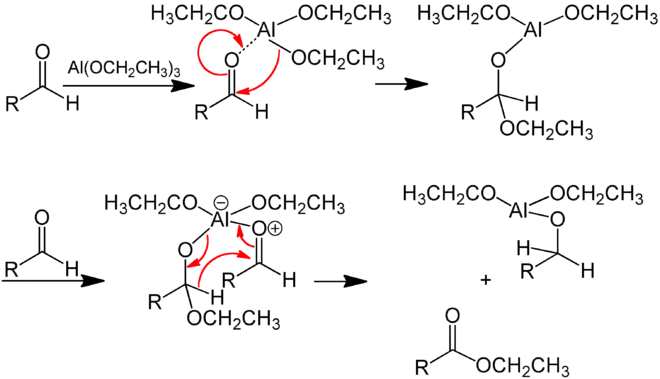
Das Aluminiumalkoholat setzt sich nacheinander mit zwei Molekülen des Aldehyds um und bildet dabei einen cyclischen Übergangszustand. Beim ersten Schritt wird durch Angriff eines Alkoholat-Ions auf den Carbonyl-Kohlenstoff des Aldehyds (nucleophile Addition) ein (deprotoniertes) Halbacetal gebildet. Der zweite Schritt ist eine Redoxreaktion, bei der das Halbacetal von seiner Oxidationsstufe +I auf die Oxidationsstufe +III eines Esters angehoben wird. Das Reduktionsmittel ist das zweite Aldehyd-Molekül, das von seiner Oxidationsstufe +I auf die eines primären Alkohols (-I) abgesenkt wird. Die Reduktion des zweiten Aldehyd-Moleküls zum Alkoholat ist mechanistisch analog dem zentralen Schritt der Oppenauer-Oxidation.
Die Nebenreaktion tritt vor allem bei erhöhter Katalysatorkonzentration auf.
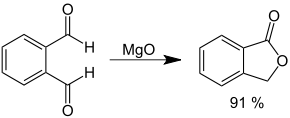
Intramolekulare Variante
Bei der intramolekularen Claisen-Tischtschenko-Reaktion nicht enolisierungsfähiger Dialdehyde können sich Lactone bilden.
Einzelnachweise
- Tsunetake Seki, Hiroto Tachikawa, Takashi Yamada, Hideshi Hattori: Synthesis of phthalide–skeleton using selective intramolecular Tishchenko reaction over solid base catalysts. In: Journal of Catalysis. 217, Nr. 1, 2003, S. 117–126, doi:10.1016/S0021-9517(02)00187-2.