Membranständige ATPasen
Membranständige ATPasen sind spezielle ATPasen, die den Aufbau oder den Abbau von ATP gekoppelt mit dem Transport von Teilchen (Ionen, kleine Moleküle, Proteine) von einer Seite der Zellmembran oder Organell-Membran zur anderen katalysieren. Sie spielen daher eine wichtige Rolle im Energiestoffwechsel und in der Signaltransduktion. Entdeckt wurden diese von dem dänischen Mediziner Jens Christian Skou, der 1997 den Nobelpreis für Chemie erhielt.
| Membranständige ATPasen | ||
|---|---|---|
| Transporter-Klassifikation | ||
| TCDB | 3.A | |
| Bezeichnung | P-P-Bindung Hydrolyse-getriebene Transporter | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.6.3.-, Hydrolase | |
| Substrat | Adenosindiphosphat + Phosphat bzw. ATP | |
| Produkte | ATP bzw. Adenosindiphosphat + Phosphat | |
Nach der TCDB-Klassifikation handelt es sich bei den membranständigen ATPasen um P-P-Bindung Hydrolyse-getriebene Transporter (TCDB 3.A), zu denen außerdem Transporter zählen, die ihre Energie auf Pyrophosphate und andere Nukleotide als ATP übertragen, bzw. sie von dort beziehen. Aufgrund ihres Aufbaus handelt es sich um Molekulare Maschinen.
Funktion
Hydrolyse von ATP
Wenn membranständige ATPasen Energie verbrauchen, werden diese auch als ATP-abhängige Pumpen bezeichnet. Solche ATP-abhängigen Pumpen beziehen ihre Energie aus der Spaltung des universalen Energieüberträgers ATP in ADP und Phosphat.
Energie für den Transport ist nötig, da solche ATP-abhängigen Pumpen meist gegen einen Gradienten (Konzentrationsgefälle, elektrochemischer Gradient etc.) arbeiten. Würde die Arbeit entlang eines solchen Gradienten erfolgen, würden die Teilchen von allein – mögliche Ursachen könnten u. a. die Brownsche Molekularbewegung oder elektrochemische Anziehungskräfte sein – die Membran passieren. Lipophile Teilchen würden die Membran einfach durchdringen können, hydrophile müssten durch Carrier- oder Tunnelproteine die Membran passieren.
Die Bindung des zu transportierenden Moleküls an solche Pumpen erfolgt nach dem Schlüssel-Schloss-Prinzip. ATP-abhängige Pumpen sind wie Enzyme oder Carrier-Proteine substratspezifisch. Somit ist eine spezielle chemische und räumliche Struktur notwendig. Es können also nur spezielle Moleküle andocken.
Der Transport findet folgendermaßen statt:
- Bindung des zu transportierenden Moleküls an die Substratbindestelle im Protein
- Energiefreisetzung durch ATP-Spaltung
- Änderung der räumlichen Struktur des Proteins (Konformationsänderung), so dass das zu transportierende Molekül auf der anderen Seite der Membran abgegeben werden kann
- Rückbildung zum Originalzustand
Synthese von ATP
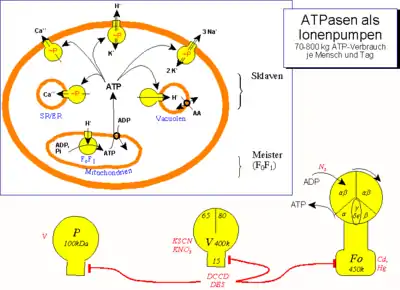
Zum Aufbau von ATP aus ADP und Phosphat wird Energie benötigt. Diese Energie stammt aus einem Protonengradienten.[Anmerkungen 1] Diffundieren die Protonen entsprechend ihrem Konzentrationsgradienten durch den Kanal, kann die dabei frei werdende Energie genutzt werden, um ATP herzustellen.
Typen
Man unterscheidet bei den membranständigen ATPasen mehrere Typen wie ABC-Transporter, F- und P-Typ kommen sowohl bei Prokaryoten als auch bei Eukaryoten vor, der V-Typ ist nur bei Eukaryoten zu finden. Weitere Familien existieren, mehrere davon ausschließlich bei Pflanzen oder Bakterien. Die Richtung, in der eine ATP-Synthase wirkt kann sich entsprechend dem chemisch-osmotischen Gleichgewicht auch umkehren – daran ändert auch die interne motorische Aktivität des Enzym nichts (siehe Gleichstrommaschine: in Abhängigkeit von der Richtung des Leistungsflusses: Dynamo versus Elektromotor).
F-Typ-ATPasen (Typ 1)
(TCDB 3.A.2.1) Diese ATPasen nutzen einen Protonengradienten zur Synthese von ATP aus ADP. Sie werden daher als ATP-Synthasen bezeichnet und sind sowohl bei Eukaryoten in den Chloroplasten und in den Mitochondrien als auch bei Prokaryoten zu finden (siehe chemiosmotische Kopplung).
In den Mitochondrien besteht eine solche ATPase (FoF1-ATP-Synthase) aus einem membrangebundenen Fo-Teil (Anmerkung: Es handelt sich hier nicht, wie vielfach falsch ausgesprochen, um die F-"null"- Untereinheit, sondern um die F-"o"- Untereinheit. Das "o" wird abgeleitet von der Oligomycin-Hemmbarkeit dieser Untereinheit!), der bei Escherichia coli aus drei, bei Eukaryoten aus 10 Untereinheiten besteht, die den Kanal bilden. Der in die Matrix ragende Teil F1 katalysiert die ATP-Synthese. Für die Synthese eines ATP-Moleküls werden 3 Protonen transportiert. Eine ähnliche Struktur weisen die V-Typ-ATPasen (VoV1-ATPasen) und archaeale A-Typ-ATPasen (AoA1-ATPasen) auf.[1][2][3][4]
P-Typ-ATPasen (Typ 2)
(TCDB 3.A.3) Diese ATPasen (manchmal auch E1-E2-ATPasen genannt) bauen einen Ionengradienten unter Hydrolyse von ATP auf. Sie unterscheiden sich in ihrem Aufbau aus Untereinheiten deutlich von den F-, A- und V-Typ-ATPasen, es gibt offenbar keine rotierenden Elemente.[5] Sie sind sowohl bei Prokaryoten als auch bei Eukaryoten zu finden und bestehen aus zwei Untereinheiten mit ungefähr 100 kDa. In vitro können die Bedingungen so geändert werden, dass die Ca2+-ATPasen auch ATP synthetisieren können. Die P-Typ-ATPasen werden durch Orthovanadate ([VO4]3−) inhibiert.
Uniport
(TCDB 3.A.3.2) Ca2+-ATPasen in der Zellmembran sorgen dafür, dass die Ca2+-Konzentration im Cytosol niedrig bleibt, in dem sie Calcium-Ionen aus dem Cytosol in den Extrazellular-Raum pumpen. Diese niedrige Konzentration ist notwendig, da auf Grund von Signalen Ionenkanäle in der Zellmembran oder in der Membran von endoplasmatischem (ER) und sarkoplasmatischem Retikulum (SR) in Nerven- und Muskelzellen geöffnet werden, so dass Calcium-Ionen passiv ausströmen und verschiedene Vorgänge in der Zelle initiieren können. Die ATPasen pumpen diese Calcium-Ionen wieder zurück.
Bei Physcomitrella patens pumpt eine membranständige Ca2+-ATPase cytosolische Ca2+-Ionen in kleine Vakuolen zurück und ist so neben dem Phytohormon ABA an der Signaltransduktion von abiotischen Stresssignalen (Dürre, Versalzung) beteiligt. Knockout-Moose für dieses Gen sind somit anfälliger gegen abiotischen Stress.[6][7]
Bei Escherichia coli pumpt eine K+-ATPase Kalium-Ionen ins Innere der Zelle.
Antiport
(TCDB 3.A.3.1) Die Na+-K+-austauschende ATPase (Natrium-Kalium-Pumpe) dient zur Aufrechterhaltung der Ionenkonzentrationen von Nervenzellen. Dabei werden drei Natriumionen nach außen und zwei Kaliumionen nach innen gepumpt. Sie gleicht die Leckströme aus. Entgegen einigen Vorstellungen ist sie nicht für die Repolarisation während eines Aktionspotentials zuständig, die Konzentrationen ändern sich während eines Aktionspotentials nur unwesentlich.
Die H+-K+-austauschende ATPase (Protonen-Kalium-Pumpe) in der Membran der Belegzellen des Magens transportiert Protonen aus der Zelle heraus und trägt damit zur Erniedrigung des pH-Wertes der Magensäure bei. Sie wirkt unmittelbar als Protonenpumpe.
V-Typ-ATPasen (Typ 3)
(TCDB 3.A.2.2) Diese ATPasen (VoV1-ATPasen) bauen einen Protonengradienten unter Hydrolyse von ATP auf.[5] Sie sind nur in den Vesikeln der Endo- und Exozytose sowie in Lysosomen, Endosomen und Golgi-Vesikeln der Eukaryoten und in den Vakuolen von Pflanzen und Hefepilzen zu finden. Sie steuern den pH-Wert in den Vesikeln. Der entstandene Protonengradient wird zum Im- und Export anderer Moleküle genutzt. Die ATPasen stellen einen Komplex aus 12 bis 14 Untereinheiten dar: Der VO-Komplex bildet den Kanal, der V1-Komplex ragt ins Cytosol und katalysiert die Hydrolyse von ATP zu ADP und Phosphat. Es besteht eine strukturelle Ähnlichkeit zum F-Typ.[8][3][4]
ABC-Transporter
(TCDB 3.A.1) Siehe dazu den Hauptartikel ABC-Transporter.
Sec-Proteine
(TCDB 3.A.5) Siehe dazu den Hauptartikel Sec-System.
Sec-Transporter für Präproteine sind hauptsächlich in Bakterien anzutreffen, ein wichtiger Proteinkomplex ist in Eukaryoten weiterentwickelt, der Sec61-Translokator im Endoplasmatischen Retikulum (ER).
MPT-Proteine
(TCDB 3.A.8) Mitochondriale Innenmembran-Import-Translokasen sind Proteinkomplexe, die Präproteine in die Mitochondrien der Eukaryoten transportieren.
ER-RT
(TCDB 3.A.16) Falsch gefaltete Proteine werden aus dem Endoplasmatischen Retikulum ins Zytosol durch ein so genanntes Retrotranslocon zum Abbau in Peroxisomen zurückbefördert. Die ATPase, deren Energie verwendet wird, heißt in Eukaryoten Derlin (Gen: DERL).
Pflanzliche Membran-ATPasen
(TCDB 3.A.9) Neben den Sec-Proteinen benutzen Pflanzen zusätzlich so genannte Chloroplasten-Hüllprotein-Translokasen (CEPT, Tic-Toc), um Präproteine in die Chloroplasten zu schaffen.
Bakterien-Membran-ATPasen
- die Arsenit- und Antimonit-Resistenz-Effluxpumpen (3.A.4)
- das Typ-III-Sekretionssystem für die Proteinsekretion in Gram-negativen Bakterien (3.A.6)
- die IVSP-Familie in Gram-negativen Bakterien, die Proteine und DNA aus der Zelle hinaus in andere Zellen (Bakterien, Hefen, Pflanzen) pumpen kann (3.A.7)
- die DNA-T-Familie für die Aufnahme einzelsträngiger DNA in verschiedenen Bakterienarten (3.A.11)
- die S-DNA-T-Familie für den Export von DNA (3.A.12)
- die FPhE-Familie für den Export filamentöser Phagen (3.A.13)
- die FPE-Familie für den Proteinexport (3.A.14)
- die MTB-Familie für den Proteinexport (beispielsweise von Pullulanase) aus gramnegativen Bakterien (3.A.15)
- die Phage T7-Injectisom-Familie für den DNA-Import (3.A.17)
N-Typ-ATPasen
Eine N-Type-ATPase wurde neben der F-Typ-ATPase bei Burkholderia pseudomallei gefunden.[9] N-Typ-ATPasen können auch Na+-Ionen anstelle von H+-Ionen ('Protonen') pumpen. Der Rotationsmenchanismus ist ähnlich wie beim F-, V- und A-Typ.[10][4]
E-Typ-ATPasen
E-Typ-ATPasen (mit E für ‘extrazellulär’) sind membrangebundene Enzyme an der Zelloberfläche mit einem breiten Spektrum an Aufgaben, wie die Hydrolyse auch anderer Nukleosidtriphosphate (NTPs) wie etwa UTP an Stelle von ATP.[5]
Anmerkungen
- Mit Protonen sind hier in der Chemie stets Wasserstoffionen H+ gemeint. Das schließt auch Schweren Wasserstoff (Deuterium) nicht aus, obwohl es sich bei H+ in diesem Fall streng genommen um Deuteronen handelt. Im übrigen sind die H+-Ionen in wässriger Lösung stets zu Hydronium-Ionen H3O+ hydriert. Von der Größe her entspricht das Hydronium-Ion etwa einem Natrium-Ion Na+, wodurch verständlich wird, dass in manchen Fällen 'Protonen' durch Na+ ersetzt sind.
Einzelnachweise
- V. Müller et al.: Structure and function of the A1A0-ATPases from methanogenic Archaea. In: J Bioenerg Biomembr., Februar 1999, 31(1), S. 15–27, PMID 10340845 (fehlerhaft A0 im Titel statt Ao)
- Armen Y Mulkidjanian, Michael Y Galperin, Kira S Makarova, Yuri I Wolf and Eugene V Koonin: Evolutionary primacy of sodium bioenergetics. In: Biology Direct. 3, Nr. 13, 2008. doi:10.1186/1745-6150-3-13.
- Armen Y Mulkidjanian, Kira S Makarova, Michael Y Galperin, Eugene V Koonin: Inventing the dynamo machine: the evolution of the F-type and V-type ATPases. In: Nature Reviews Microbiology. 5, Nr. 11, 2007, S. 892-899. doi:10.1038/nrmicro1767. Perspectives. (PDF) (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. Uni Osnabrück
- Armen Y Mulkidjanian, Michael Y Galperin, Eugene V Koonin: Co-evolution of primordial membranes and membrane proteins. In: Trends Biochem Sci.. 4, Nr. 34, 2009, S. 206–215. doi:10.1016/j.tibs.2009.01.005. PMC 2752816 (freier Volltext). (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Jennifer McDowall/Interpro: ATP Synthase: The ATPase-Family (englisch)
- Enas Qudeimat, Alexander M.C. Faltusz, Glen Wheeler, Daniel Lang, Colin Brownlee, Ralf Reski, Wolfgang Frank (2008): A PIIB-type Ca2+-ATPase is essential for stress adaptation in Physcomitrella patens. PNAS 105, 19554–19559. (Online)
- Bioökonomie BW: Ein Protein bringt Stress zur Sprache vom 3. März 2009
- Beyenbach KW, Wieczorek H: The V-type H+ ATPase: molecular structure and function, physiological roles and regulation. In: J. Exp. Biol.. 209, Nr. Pt 4, Februar 2006, S. 577–89. doi:10.1242/jeb.02014. PMID 16449553.
- S. Schulz, M. Wilkes, D. J. Mills, W. Kühlbrandt, T. Meier: Molecular architecture of the N-type ATPase rotor ring from Burkholderia pseudomallei. In: EMBO reports. Band 18, Nummer 4, April 2017, S. 526–535, doi:10.15252/embr.201643374, PMID 28283532, PMC 5376962 (freier Volltext).
- D. V. Dibrova et al.: Characterization of the N-ATPase, a distinct, laterally transferred Na+-translocating form of the bacterial F-type membrane ATPase. In: Bioinformatics, Vol. 26, Issue 12, 15. Juni 2010, S. 1473–1476, doi:10.1093/bioinformatics/btq234
Literatur
- Nick Lane: Der Funke des Lebens – Energie und Evolution. Konrad Theiss Verlag, 2017 by WBG, ISBN 978-3-8062-3484-8. Englischer Originaltitel: Nick Lane: The Vital Question - Energy, Evolution, and the Origins of Complex Life. Ww Norton, 2015-07-20, ISBN 978-0-393-08881-6; armscoop.com (PDF) Textpassagen nahe Abbildung/Figure 10. (Struktur der ATP-Synthase)
- E. Hilario, J. P. Gogarten: Horizontal transfer of ATPase genes--the tree of life becomes a net of life. In: Biosystems, 1993;31(2-3): S. 111–119. PMID 8155843