Haptophyta
Die Haptophyta (früher auch Prymnesiophyta genannt) sind überwiegend marin-planktonisch lebende, komplexe einzellige Algen. Die Gruppe gehört innerhalb der Diaphoretickes entweder zu den Harosa (alias Sar) oder zu den Hacrobia.
| Haptophyta | ||||||||
|---|---|---|---|---|---|---|---|---|
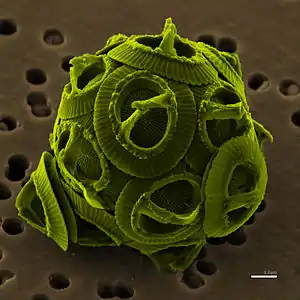
Falschfarbenbild von Gephyrocapsa oceanica, einer Vertreterin der Untergruppe Coccolithophyceae | ||||||||
| Systematik | ||||||||
| ||||||||
| Wissenschaftlicher Name | ||||||||
| Haptophyta | ||||||||
| D. J. Hibberd, 1976 |
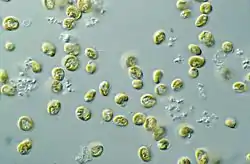
Eigenschaften
Die gelben, gelbbraunen oder braunen Chloroplasten enthalten Chlorophyll a und c, β-Carotin und Xanthophylle. Als Reservestoffe werden Chrysolaminarin, Öl und selten auch Paramylon (auch als Paramylum bezeichnet) abgelagert. Die Chloroplasten befinden sich in einer Falte des Endoplasmatischen Reticulums. Die Chloroplasten ähneln denen der Heterokonten, der übrige Zellaufbau weicht jedoch von diesen ab, weshalb die Haptophyta heute systematisch von den Heterokonta getrennt werden.

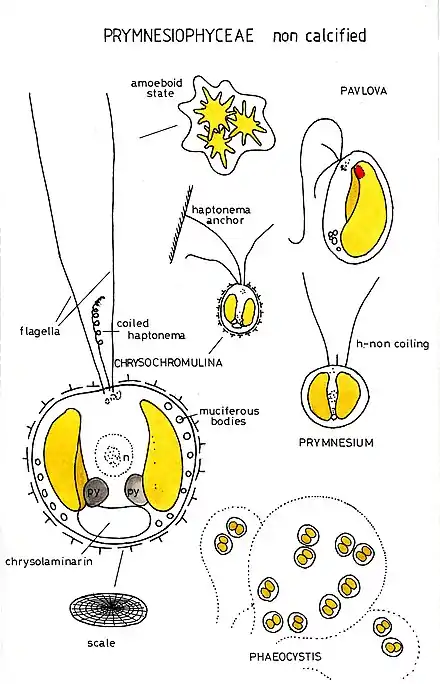
Begeißelte Zellen verfügen über zwei meist gleich lange oder nur wenig unterschiedlich lange Geißeln (isokonte Begeißelung). Die Geißeln sind nicht wie bei den Heterokonta mit Flimmerhaaren besetzt, sondern mit submikroskopischen Schüppchen oder Knoten. Im Gegensatz zu den Heterokonten besitzen die Geißeln auch keine geschwollene Basis (Geißelschwellung).
Neben den Geißeln besitzt jede Zelle ein Haptonema. Es ist ein fadenförmiges Anhängsel, das der Anheftung dient. Der Aufbau ähnelt oberflächlich dem einer Geißel, im Querschnitt befinden sich jedoch 6 oder 7 sichelförmig angeordnete Mikrotubuli.
Die Zellen sind außen mit Schuppen aus Polysacchariden (meist Cellulose), die in Golgi-Vesikeln gebildet und anschließend an der Zelloberfläche abgelagert werden, besetzt. Bei der Ordnung Coccolithales sind die äußeren Schuppen verkalkt und werden Coccolithen genannt. Die Funktion der Coccolithen ist bislang nur unzureichend bekannt. Vermutet werden u. a. Fraßschutz, Auftriebsregulation, Lichtzuführung oder Kalzifikation zur Unterstützung der Photosynthese. Teilweise ist auch ein Augenfleck, wie bei den Goldalgen und den Euglenozoa vorhanden.
Obwohl Vertreter der monadalen Organisationsstufe überwiegen, kommen auch capsale, kokkale und trichale Vertreter vor. Manche Arten besitzen einen heteromorphen Generationswechsel, d. h. die verschiedenen Generationen sind äußerlich gut unterscheidbar. Bei diesen Kalkalgen wechselt eine diploide (mit doppelten Chromosomensatz) Generation, bei der die Algen Flagellen besitzen und im Plankton leben, mit einem haploiden Stadium (mit einfachem Chromosomensatz), in dem sie benthisch, d. h. auf dem Meeresboden, leben.
Vorkommen
Nur wenige Arten leben im Süßwasser, die meisten Arten leben planktonisch im Meer. Sie können in sehr großen Mengen auftreten und einen wesentlichen Teil des Meeresplanktons bilden. Somit spielen die planktonischen Haptophyten eine bedeutende Rolle als Primärproduzenten im Meer. Einige Arten sind kosmopolitisch verbreitet, die Mehrheit kommt allerdings in den Meeren der gemäßigten Breiten vor. In besonders großen Mengen tritt die kosmopolitisch verbreitete Coccolithales-Art Emiliania huxleyi auf. Sie zählt zu den wichtigsten Produzenten von biogenem Calciumcarbonat und kann großräumige Algenblüten verursachen.
Haptophyten treten auch als Symbionten auf, so als Zooxanthellen in Acantharien[1].
Systematik
Ihre systematische Stellung war lange unklar, sie wurde mittlerweile durch molekularbiologische Methoden weitgehend überarbeitet und geklärt[2][3]. Die Abteilung wird in folgende Klassen eingeteilt:
- Coccolithophyceae[4] (alias Prymnesiophyceae, 650 Arten)
- Pavlovophyceae (15 Arten)
- Haptophyta incertae sedis (61 Arten)
Literatur
- N. Daugbjerg, R.A. Andersen: Phylogenetic analysis of the rbcL sequences from haptophytes and heterokont algae suggest their chloroplasts are unrelated. In: Mol. Biol. Evol. 14. 1997, 1242–1251.
- A. Houdan, A. Bonnard, J. Fresnel, S. Fouchard, C. Billard und I. Probert: Toxicity of coastal coccolithophores (Prymnesiophyceae, Haptophyta). In: J. Plankton Res. 26. 2004, 875–883.
- Christian van den Hoek, Hans M. Jahns, David G. Mann: Algen. 3. Auflage. Thieme, Stuttgart 1993, ISBN 3-13-551103-0
- Guiry, M.D. & Guiry, G.M. 2017. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; searched on 25 August 2017.
Nachweise
- Colette Febvre, Jean Febvre, Anthony Michaels: Acantharia In: John J. Lee, G. F. Leedale, P. Bradbury (Hrsg.): An Illustrated Guide to the Protozoa. Band 2. Allen, Lawrence 2000, ISBN 1-891276-23-9, S. 785.
- Cavalier-Smith, T. (1986). The kingdom Chromista: origin and systematics. In: Progress in phycological research. Vol. 4. (Round, F.E. & Chapman, D.J. Eds), pp. 309-347. Bristol: Bipress Ltd.
- Fujiwara, S., Tsuzuki, M., Kawachi, M., Minaka, N. & Inouye, I. (2001). Molecular phylogeny of the Haptophyta based on the rbcL gene and sequence variation in the spacer region of the RUBISCO operon. Journal of Phycology 37: 121-129.
- Silva, P.C., Throndsen, J. & Eikrem, W. (2007). Revisiting the nomenclature of haptophytes (Commentary). Phycologia 46: 471-475.