Paulinella
Paulinella[2][3][1] ist eine Gattung von etwa neun oder mehr Arten (Spezies) einzelliger Eukaryoten, die je nach Art im Süßwasser oder marinen Umgebungen leben.[4] Paulinella ist Mitglied der Familie Paulinellidae, diese gehört zu den Euglyphida unter den Silicofilosea (mit Schalen versehene Amöben mit Filopodien).
| Paulinella | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Paulinella chromatophora mit zwei Chromatophoren, außen die schuppenartige Schale, oben die Filopodien | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Paulinella | ||||||||||||
| Lauterborn, 1895[1] |
Die bekanntesten Spezies (Arten) dieser Gattung sind die drei photosynthetischen Vertreter P. chromatophora, P. micropora und P. longichromatophora, wobei es sich bei den ersten beiden um Süßwasserformen und bei der dritten um eine marine Form handelt.[5] Diese Arten gehören einer Paulinella-Klade an, die erst vor (evolutionär gesehen) kurzer Zeit ein Cyanobakterium als Endosymbionten (d. h. Cyanobionten) aufgenommen haben.[6][7] Sie sind nicht mehr in der Lage, wie ihre nicht-photosynthetischen Verwandten Phagozytose zu betreiben.[8]
Morphologie
Paulinella-Arten[9] sind Thecamoeben, die im Inneren einer vom Organismus selbst erzeugten und von der Zelle abgeschiedenen Schale leben. Diese Hülle wird als Testa oder Theca bezeichnet. Die Differenzierung der verschiedenen Arten der Gattung erfolgt anhand der Gestalt der Testa. Bei der am besten untersuchten Paulinella chromatophora ist die Testa etwa 20 bis 38 Mikrometer lang und 16 bis 29 Mikrometer breit. Die größte Art (deshalb Paulinella gigantica genannt) erreicht eine Länge von 47 Mikrometer bei einer Breite von 26 Mikrometer. Kleine Arten wie Paulinella agasizzi erreichen nur 13–17 Mikrometer Länge bei 9–12 Mikrometer Breite.
Die Testa ist je nach Art[9] etwas unterschiedlich beutel- birnen- oder vasenförmig ausgebildet. Jede Testa besteht aus einem System fest und unbeweglich miteinander fusionierter Einzelplättchen, die als Schuppen (eng. scales) bezeichnet werden. Bei den meisten Arten besteht die Testa aus fünf an den Kanten miteinander verbundenen Reihen von Schuppen, dazu gehört auch die Typusart Paulinella chromatophora. Bei der schlecht bekannten Paulinella intermedia sollen nur drei oder vier Reihen ausgebildet sein. Die Arten Paulinella multipora und Paulinella gigantica zeigen, abweichend von allen anderen, sieben bis acht bzw. zehn bis zwölf solcher Reihen, die außerdem miteinander überlappen. Die rechteckigen Schuppen sind im lichtmikroskopischen Bild einförmig, mit einem je nach Art unterschiedlichen Muster aus kleinen Poren. Im elektronenmikroskopischen Bild[10] zeigt sich ein komplexer Feinbau aus drei Schichten. Die Schuppenreihen sind seitlich jeweils miteinander verzahnt, ihre Verbindungslinie damit zickzackartig. Am hinteren (aboralen) Pol der Testa laufen sie zusammen in einer fünfeckigen Abschlussschuppe. Nur am oralen Pol ist die Testa geöffnet. Die schmale Öffnung ist, je nach Art, von zwei oder drei Kragenschuppen eingefasst, die meist etwas halsartig abgesetzt sind. Aus der Öffnung kann die Zelle lange, fadenartige Scheinfüßchen (Filopodien genannt) vorschieben, bei Paulinella chromatophora jeweils ein bis drei davon. Die Filopodien dienen bei den räuberischen Arten dem Beuterwerb und ermöglichen allen Arten die Fortbewegung. Sie können bei Paulinella indentata auch verzweigt sein und erreichen hier 50 Mikrometer Länge.[11] Die Testa besteht aus glasartig amorpher, kieseliger Substanz (wohl biogenem Opal) und ist am lebenden Organismus glasartig durchsichtig bis blass gelblich gefärbt.
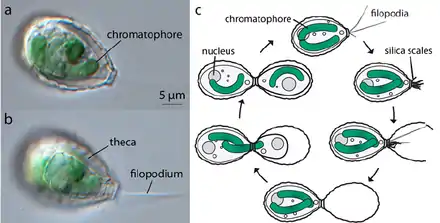
c: Schematische Darstellung der Zellteilung bei P. chromatophora.
Eva C. M. Nowack (2014)[12]
Die Zelle innerhalb der Testa füllt diese meist nicht vollständig aus. Sie enthält einen im hinteren Drittel liegenden Zellkern. Nahe dem oralen Pol sind (bei Paulinella chromatophora, die Verhältnisse bei der marinen Art sind unbekannt) zwei oder drei pulsierende Vakuolen eingelagert, die der Ausscheidung von überschüssigem Wasser und damit der Osmoregulation dienen. Der Golgi-Apparat besteht aus einem einzigen, sehr großen Dictyosom aus mehreren eng gepackten Zisternen. Dieses dient, soweit bekannt, vor allem der Bildung der Schuppen. Außerdem sind weitere Vakuolen vorhanden.[10]
Bei den autotrophen Arten wie Paulinella chromatophora sind genau zwei der photosynthetisch aktiven Plastiden (Chromatophoren) vorhanden. Sie sind im Querschnitt rund, verjüngen sich zu den Enden hin nicht und sind wurstförmig gebogen, bei Paulinella chromatophora von etwa 15 bis 20 Mikrometer Länge bei 3,5 bis 4 Mikrometer Durchmesser. Sie sind blaugrün gefärbt. Die Chromatophoren sind nur von zwei Membranen eingeschlossen (nicht vier wie bei den meist auf Rhodoplasten mittels sekundärer Endosymbiose zurückgehenden Plastiden der Ochrophyta). Außerdem ist zwischen diesen eine dünne Zellwand (aus Peptidoglycanen) ausgebildet. Im elektronenmikroskopischen Bild zeigen sich zehn bis zwanzig konzentrisch angeordnete, etwas wellenförmige Thylakoide, mit eingelagerten Phycobilisomen und Carboxysomen (für die Cyanobakterien typische Organellen zur Kohlenstoffdioxidanreicherung).[10]
Die Vermehrung erfolgt über einfache Zellteilung. Eine der Tochterzellen „erbt“ die Testa der Mutterzelle, für die andere wird eine neue ausgebildet. Dafür werden im Zytoplasma der Mutterzelle vor der Zellteilung zahlreiche Reserveschuppen vorgebildet. Diese werden dann durch Filopodien an die richtige Stelle geschoben und fusionieren. Nach der Teilung der Zelle quetscht sich eine der Tochterzellen durch die orale Öffnung der alten Testa in die neue hinein, die sich anschließend trennen. Jede der Tochterzellen erbt eine der Chromatophoren, die sich anschließend durch Teilung wieder verdoppeln. Die Teilung von Mutterzelle und Endosymbionten sind also synchronisiert.[12]
Chromatophoren
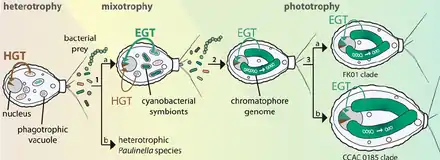
HGT: Horizontaler Gentransfer, EGT: Endosymbiotischer Gentransfer.
Eva C. M. Nowack (2014)[12]
Das aus dem Endosymbiose-Ereignis resultierende Organell ist ein photosynthetisches Plastid, das als Chromatophor bezeichnet wird; wegen seiner Ursprünglichkeit (Ähnlichkeit mit den cyanobakteriellen Vorfahren) wird es auch, wie bei den Glaucophyten, als Cyanell (cyanobakterienartiges Organell) bezeichnet. Dies ist erst das zweite bekannte primäre Endosymbiose-Ereignissen mit photosynthetischen Cyanobakterien. Das erste und bedeutendste war, nach der Endosymbiontentheorie, der Ursprung der Chloroplasten als Organellen der so entstandenen Archaeplastida, zu denen die Glaucophyten, Grünalgen und Landpflanzen gehören.[13][14] Derzeit (2017) ist zusätzlich lediglich ein weiteres primäres Endosymbiose-Ereignis, aber mit einem nicht-photosynthetischen cyanobakteriellen Symbionten, in der Kieselalgenfamilie Rhopalodiaceae (Ordnung Rhopalodiales) bekannt.[15] Das endosymbiotische Ereignis bei den Vorfahren der photosynthetisch aktiven Paulinella-Klade ereignete sich vor ca. 90–140 Millionen Jahren. Dabei war eine Cyanobakterienart beteiligt, die sich vor ca. 500 Millionen Jahren von ihrer Schwesterklade mit den heute lebenden Vertretern der Gattungen Prochlorococcus und Synechococcus abspaltete.[16][17][18][19] Es handelt sich dabei um eine andere Cyanobakterienklade als die, die zur Entstehung der Chloroplasten und anderen primären Plastiden der Archaeplastida führte.[20] Die Chloroplasten aller anderen bekannten photosynthetischen Eukaryoten stammen letztlich von dem Cyanobakterien-Endosymbionten ab, der vor etwa 1,6 Milliarden Jahren von dem Archaeplastida-Vorfahren aufgenommen wurde. Diese wurden nämlich anschließend durch sekundäre (und spätere tertiäre und quaternäre) Endosymbiose-Ereignisse in andere Eukaryotengruppen übernommen. Die einzige derzeit (2021) bekannte Ausnahme dazu ist das Wimpertierchen Pseudoblepharisma tenue[21] (Heterotrichea), das neben einem Grünalgen-Endosymbionten (Chlorella sp. K10, sekundäre Endosymbiose), auch ein photosynthetisch aktives Bakterium als Endosymbionten hat – dies ist aber kein Cyanobakterium, sondern ein Schwefelpurpurbakterium aus der Familie Chromatiaceae (Candidatus Thiodictyon intracellulare[22][23]).[24]
Das Chromatophoren-Genom hat eine Verkleinerung durchgemacht und ist jetzt nur noch ein Drittel so groß wie das Genom seiner nächsten frei lebenden Verwandten, aber immer noch 10-mal größer als die Plastiden-Genome. Einige der Gene sind verloren gegangen, andere sind durch endosymbiotischen Gentransfer (EGT) in den Zellkern der Wirtszelle gewandert.[25] Man kann also hier die gleiche Tendenz beobachten wie bei den Plastiden und mitochondrienverwandten Organellen (en. mitochondria-related organelles, MROs), bei denen die Reduktion des Organell-Genoms im Extrem bis zum Totalverlust geführt hat (siehe DNA-lose Chloroplasten, Hydrogenosom, Mitosomen). Wieder andere Gene sind durch die sogenannte Mullersche Ratsche (englisch Muller’s ratchet) – die Anhäufung schädlicher Mutationen durch genetische Isolation – degeneriert und wurden wahrscheinlich durch horizontalen Gentransfer (HGT) durch Gene aus anderen Mikroben ersetzt.[26]
Die Kerngene von P. chromatophora (d. h. die Regionen, die nicht durch den Symbionten per endosymbiotischen Gentransfer modifiziert wurden) sind am engsten mit der heterotrophen Schwesterspezies P. ovalis verwandt.[27] Auch der Räuber P. ovalis hat mindestens zwei cyanobakterienähnliche Gene, die wahrscheinlich ebenfalls durch horizontalen Gentransfer (HGT) von seiner cyanobakteriellen Beute in sein Genom integriert wurden, ohne dass diese zu Endosymbionten wurden. Ähnliche Gene könnten den Vorfahren der photosynthetischen Arten für die Aufnahme des Chromatophors vorgerüstet haben.[28]
Systematik
Typusart der Gattung ist Paulinella chromatophora Lauterborn, 1895. Robert Lauterborn fand sie am 24. Dezember 1894 in einem Altarm des Rheins bei Neuhofen südlich Ludwigshafen am Rhein.[29] Lauterborn benannte die Gattung nach seiner Stiefmutter Pauline Lauterborn, auch wenn er dies nicht in der Publikation selbst vermerkte.[30]
Die autotrophen Paulinella-Arten bilden zusammen eine Klade, die in die heterotrophen Vertreter dieser Gattung eingeschachtelt ist.[31] Dies zeigt klar, dass die heterotrophe, räuberische Lebensweise innerhalb der Gattung der ursprüngliche Zustand ist und nicht auf einen sekundären Verlust der Chromatophoren zurückgeht.
Spezies
Gattung Paulinella Lauterborn 1895[2][3][1]
- P. agassizi Nicholls 2009[2]
- P. bulloides d'Orbigny, 1826[32]
- P. carsoni Nicholls 2009[2]
- P. chromatophora Lauterborn 1895[18][1][3][2][33][34] (Modellorganismus)[35]
- P. gigantica Nicholls 2009[2]
- P. indentata Hannah, Rogerson & Anderson 1996[2]
- P. intermedia Vørs 1993[2]
- P. lauterborni Nicholls 2009[2]
- P. longichromatophora Kim & Park 2016[1][3]
- P. micropora Lhee et al. 2017[3][3]
- P. multipora Nicholls 2009[2]
- P. osloensis Feyling-Hanssen, 1954[32]
- P. ovalis (A. Wulff 1919) P.W. Johnson, P.E. Hargraves & J.M. Sieburth, 1988[1][2][36][37]
- P. sphaeroides (d'Orbigny, 1826)[32]
- P. subcarinata (d'Orbigny, 1839)[32]
- P. suzukii Nicholls 2009[2]
Unklar ist die Stellung einer weiteren Art, Paulinella gracilis. Hans Lohmann beschrieb 1908 eine neue Gattung Calycomonas mit den Arten Calycomonas gracilis und Calycomonas globosa, der später weitere Arten zugeordnet wurden. Die Gattung und die Art C.gracilis sind nach der taxonomischen Datenbank Algaebase weiterhin in Gebrauch[38] Andere Autoren haben, einem Vorschlag von Naja Vørs folgend[39] die Art in die Gattung Paulinella transferiert. Die Stellung ist damit bis heute unklar[40] Da es die Typusart der Gattung ist, wäre ggf. Calycomonas synonym zu Paulinella.
Äußere Systematik
Das National Center for Biotechnology Information (NCBI) listet in der Familie Paulinellidae folgende drei Einträge:[41]
- Micropyxidiella Tarnawski & Lara, 2015 mit der Spezies Micropyxidiella edaphonis Tarnawski & Lara, 2015 (bodenlebende Art).
- Paulinella
- ohne Gattungs- und Artzuweisung: Stamm „Paulinellidae sp. EL-2014b“
Die Stellung der Gattung Ovulinata[42] mit der bisher einzigen beschriebenen Art Ovulinata parva Anderson, Rogerson & Hannah, 1996 ist umstritten, ihre nahe Verwandtschaft zu Paulinella aber nachgewiesen. Sie wird teilweise in die Paulinellidae mit einbezogen,[43] teilweise in einer eigenen Familie Ovulinatidae Cavalier-Smith geführt (NCBI).[44] Ovulinata besitzt eine Testa aus organischem Material, ohne silikatische Schuppen.
Bei einer molekularen Analyse 2010 war Schwestergruppe der Paulinellidae die Familie Cyphoderiidae de Saedeleer, 1934.[45]
Einzelnachweise
- M. D. Guiry: Paulinella Lauterborn, 1895, in Guiry, M. D. & Guiry, G. M. 2013. . World-wide electronic publication, National University of Ireland, Galway. Abgerufen am 2. Juli 2021.
- Microworld: Paulinella, auf: Microworld arcella.nl (mit Zeichnungen zu diversen Spezies)
- Paulinella (English) In: NCBI taxonomy. National Center for Biotechnology Information.: „Lineage(full) cellular organisms; Eukaryota; Rhizaria; Cercozoa; Imbricatea; Silicofilosea; Euglyphida; Paulinellidae“; graphisch: Paulinella, auf: Lifemap, NCBI Version.
- Eukaryotes. speciesaccounts.org.
- Duckhyun Lhee, Ji-San Ha, Sunju Kim, Myung Gil Park, Debashish Bhattacharya & Hwan Su Yoon: Evolutionary dynamics of the chromatophore genome in three photosynthetic Paulinella species, in: Nature Scientific Reports, Band 9, Nr. 2560, 22. Februar 2019, doi:10.1038/s41598-019-38621-8
- Laura Wegener Parfrey, Erika Barbero, Elyse Lasser, Micah Dunthorn, Debashish Bhattacharya, David J. Patterson, Laura A. Katz: Evaluating support for the current classification of eukaryotic diversity, in: PLOS Genetics, Band 2, Nr. 12, e220, doi:10.1371/JOURNAL.PGEN.0020220, ISSN 1553-7390. PMC 1713255 (freier Volltext), PMID 17194223
- Jan de Vries, Sven B. Gould: The monoplastidic bottleneck in algae and plant evolution. In: Journal of Cell Science. 131, Nr. 2, 15. Januar 2018, ISSN 0021-9533, S. jcs203414. doi:10.1242/jcs.203414. PMID 28893840.
- Przemysław Gagat, Paweł Mackiewicz: Cymbomonas tetramitiformis - a peculiar prasinophyte with a taste for bacteria sheds light on plastid evolution, in: Symbiosis, 10. November 2016, doi:10.1007/s13199-016-0464-1
- Kenneth H. Nicholls (2009): Six new marine species of the genus Paulinella (Rhizopoda: Filosea, or Rhizaria: Cercozoa). Journal of the Marine Biological Association of the United Kingdom 89 (7): 1415–1425. doi:10.1017/S0025315409000514
- Ludwig Kies: Elektronenmikroskopische Untersuchungen an Paulinella chromatophora Lauterborn, einer Thekamöbe mit blau-grünen Endosymbionten (Cyanellen). In: Protoplasma, Band 80, 1974, S. 69-89; doi:10.1007/bf01666352.
- Fiona Hannah, Andrew Rogerson, Rofer Anderson (1996): A Description of Paulinella indentata N. Sp. (Filosea: Euglyphina) from Subtidal Coastal Benthic Sediments. Eukaryotic Microbiology 43 (1): 1-4. doi:10.1111/j.1550-7408.1996.tb02464.x
- Eva C. M. Nowack: Paulinella chromatophora – rethinking the transition from endosymbiont to organelle, in: Acta Societatis Botanicorum Poloniae, Band 83, Nr. 4, Dezember 2014, S. 387–397, doi:10.5586/asbp.2014.049, Fig. 1, Fig. 2, PDF
- Duckhyun Lhee, Ji-San Ha, Sunju Kim, Myung Gil Park, Debashish Bhattacharya, Hwan Su Yoon: Evolutionary dynamics of the chromatophore genome in three photosynthetic Paulinella species - Scientific Reports. In: Scientific Reports. 9, Nr. 1, 22. Februar 2019, S. 2560. doi:10.1038/s41598-019-38621-8. PMID 30796245. PMC 6384880 (freier Volltext).
- Arwa Gabr, Arthur R. Grossman, Debashish Bhattacharya; B. Palenik (Hrsg.): Paulinella, a model for understanding plastid primary endosymbiosis. In: Wiley (Hrsg.): Journal of Phycology. 56, Nr. 4, 5. Mai 2020, ISSN 0022-3646, S. 837–843. doi:10.1111/jpy.13003. PMID 32289879. PMC 7734844 (freier Volltext).
- Takuro Nakayama, Yuji Inagaki: Genomic divergence within non-photosynthetic cyanobacterial endosymbionts in rhopalodiacean diatoms, in: Nature Scientific Reports, Band 7, Nr. 13075, 12. Oktober 2017, doi:10.1038/s41598-017-13578-8
- Patricia Sánchez-Baracaldo, John A. Raven, Davide Pisani, Andrew H. Knoll: Early photosynthetic eukaryotes inhabited low-salinity habitats. In: Proceedings of the National Academy of Sciences. 114, Nr. 37, 12. September 2017, ISSN 0027-8424, S. E7737–E7745. doi:10.1073/pnas.1620089114. PMID 28808007. PMC 5603991 (freier Volltext).
- Luis Delaye, Cecilio Valadez-Cano, Bernardo Pérez-Zamorano: How Really Ancient Is Paulinella Chromatophora?, in: PLOS Currents 8, 15. März 2018, doi:10.1371/currents.tol.e68a099364bb1a1e129a17b4e06b0c6b, PMID 28515968, PMC 4866557 (freier Volltext)
- Birger Marin, Eva CM Nowack, Gernot Glöckner, Michael Melkonian: The ancestor of the Paulinella chromatophore obtained a carboxysomal operon by horizontal gene transfer from a Nitrococcus-like γ-proteobacterium. In: BMC Evol. Biol.. 7, 2007, S. 85. doi:10.1186/1471-2148-7-85. PMID 17550603. PMC 1904183 (freier Volltext).
- Arwa Gabr, Arthur R. Grossman, Debashish Bhattacharya: Paulinella, a model for understanding plastid primary endosymbiosis, in: J Phycol, Band 56, Nr. 4, August 2020, S. 837–843, Epub 5. Mai 2020, doi:10.1111/jpy.13003, PMID 32289879, PMC 7734844 (freier Volltext)
- Birger Marin, Eva C. M. Nowack, Gernot Glöckner, Michael Melkonian: The ancestor of the Paulinella chromatophore obtained a carboxysomal operon by horizontal gene transfer from a Nitrococcus-like γ-proteobacterium, in: BMC Evolutionary Biology, Band 7, Nr. 85, 5. Juni 2007, doi:10.1186/1471-2148-7-85, PMID 17550603, PMC 1904183 (freier Volltext)
- NCBI: Pseudoblepharisma tenue Kahl, 1926 (species); graphisch: Pseudoblepharisma tenue, auf: Lifemap, NCBI Version.
- NCBI: Thiodictyon endosymbiont of Pseudoblepharisma tenue (species)
- LPSN: "Candidatus Thiodictyon syntrophicum" Peduzzi et al. 2012
- Sergio A. Muñoz-Gómez, Martin Kreutz, Sebastian Hess: A microbial eukaryote with a unique combination of purple bacteria and green algae as endosymbionts, in: Science Advances, Band 7, Nr. 24, 11. Juni 2021, eabg4102, doi:10.1126/sciadv.abg4102. Dazu:
- Ungewöhnliche Symbiose aus Wimpertierchen, Grünalgen und Purpurbakterien, auf: EurekAlert! vom 14. Juni 2021
- Ru Zhang, Eva C. M. Nowack, Dana C. Price, Debashish Bhattacharya, Arthur R. Grossman: Impact of light intensity and quality on chromatophore and nuclear gene expression in Paulinella chromatophora, an amoeba with nascent photosynthetic organelles. In: The Plant Journal: For Cell and Molecular Biology. 90, Nr. 2, 1. April 2017, S. 221–234. doi:10.1111/tpj.13488. PMID 28182317.
- Eva C. M. Nowack, Dana C. Price, Debashish Bhattacharya, Anna Singer, Michael Melkonian, Arthur R. Grossman: Gene transfers from diverse bacteria compensate for reductive genome evolution in the chromatophore of Paulinella chromatophora, in: PNAS Band 113, Nr. 43, 25. Oktober 2016, S. 12214-12219; Epub 10. Oktober 2016, doi:10.1073/pnas.1608016113. Dazu:
- Patrick J. Keeling: Diversity and evolutionary history of plastids and their hosts. In: American Journal of Botany. 91, Nr. 10, 2004, S. 1481–1493. doi:10.3732/ajb.91.10.1481. PMID 21652304.
- David Smith: Steal My Sunshine, in: TheScientist vom 1. Januar 2013
- R. Lauterborn (1895): Protozoenstudien II. Paulinella chromatophora nov. gen., nov. spec., ein beschalter Rhizopode des Süsswassers mit blaugrünen chromatophorenartigen Einschlüssen. Zeitschrift für wissenschaftliche Zoologie 59: 537-544.
- Michael Melkoniana & Dieter Mollenhauer (2005): Robert Lauterborn (1869—1952) and his Paulinella chromatophora. Protist 156: 253—262. doi:10.1016/j.protis.2005.06.001
- Arwa Gabr, Arthur R. Grossman, Debashish Bhattacharya (2020): Paulinella, a model for understanding plastid primary endosymbiosis. Journal of Phycology 56 (4): 837-843. doi:10.1111/jpy.13003
- Paulinella. In: Integrated Taxonomic Information System.
- Wolfgang Bettighofer: Paulinella chromatophora, Multiebenen-Abbildung (Schalendetails); Paulinella chromatophora, Multiebenen-Abbildung (Kern und Cyanellen-Querschnitt). Probe aus einem kleinen Bach bei Roßbach im Spessart, 49,8775° N, 9,2382° O (63849 Leidersbach). Auf protisten.de
- Wolfgang Bettighofer, Winfried Hölz: Paulinella chromatophora, mehrere Exemplare. Probe aus Gewässern nahe Hausen (Hessisch Lichtenau). Auf protisten.de
- Yuri Mazei: INTERNATIONAL SCIENTIFIC FORUM «PROTIST–2016». In: Protistology, BAnd 10, Nr. 2, 6.–10. Juni 2016
- Paulinella ovalis, Photo, Alexandra Kraberg, Alfred Wegener Institute for Polar and Marine Research, Serie „North Sea, Helgoland Roads Phytoplankton Monitoring“, auf plankton net
- P. Tsarenko, O. Burova (Hrsg.): VI International Conference − Advances in Modern Phycology, 15. bis 17. Mai 2019, Kiew, Ukraine (Book of Abstracts)
- Calycomonas gracilis Lohmann 1908. M.D. Guiry in Guiry, M.D. & Guiry, G.M. 2021. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. www.algaebase.org, abgerufen am 6. Juli 2021.
- Gianfranco Novarino, Emilia Oliva, Blanca Pérez-Uz (2002): Nanoplankton protists from the western Mediterranean Sea. I. Occurrence, ultrastructure, taxonomy and ecological role of the mixotrophic flagellate Ollicola vangoorii (Chrysomonadidae = Chrysophyceae p.p.). Scientia Marina 66 (3): 233-247.
- Paulinella gracilis Authority not known. M.D. Guiry in Guiry, M.D. & Guiry, G.M. 2021. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. www.algaebase.org, abgerufen am 6. Juli 2021.
- NCBI: Paulinellidae (family); graphisch: Paulinellidae, auf: Lifemap, NCBI Version.
- NCBI: Ovulinata Howe et al. 2011 (genus); graphisch: Ovulinata, auf: Lifemap, NCBI Version.
- Sina M. Adl et al: Revisions to the Classification, Nomenclature, and Diversity of Eukaryotes. Journal of Eukaryotic Microbiology, Band 66, Nr. 1, 2019, S. 4-119. doi:10.1111/jeu.12691
- Alexis T. Howe, David Bass, Josephine M. Scoble, Rhodri Lewis, Keith Vickerman, Hartmut Arndt, Thomas Cavalier-Smith: Novel Cultured Protists Identify Deep-branching Environmental DNA Clades of Cercozoa: New Genera Tremula, Micrometopion, Minimassisteria, Nudifila, Peregrinia. In: Protist, Band 162, April 2011, S. 332–372, doi:10.1016/j.protis.2010.10.002
- Thierry J. Heger, Edward A.D. Mitchell, Milcho Todorov, Vassil Golemansky, Enrique Lara, Brian S. Leander, Jan Pawlowski: Molecular Phylogenetics and Evolution, Band 55, Nr. 1, 2010, S. 113-122, doi:10.1016/j.ympev.2009.11.023
Weblinks
- Paulinella, The World of Protozoa, Rotifera, Nematoda and Oligochaeta. National Institute for Environmental Studies (NIES), Japan